黑曲霉A.niger 6640生物转化制备蔗果低聚糖*
2015-12-19刘冬梅周劲松尚雍贺杨丹霞柯亦纯于淑娟
刘冬梅 周劲松 尚雍贺 杨丹霞 柯亦纯 于淑娟
(华南理工大学 轻工与食品学院,广东 广州510640)
蔗果低聚糖(FOS)是由1 ~3 个果糖基通过β-1,2 糖苷键与蔗糖(GF)中的果糖基结合生成的蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)等的混合物[1-2],是一种新型的功能性低聚糖.FOS 热量低,具有降血脂、防龋齿、防止有害菌生长等优异性能,还能促进人体中益生菌(如双歧杆菌)的生长,因此被广泛应用于食品、饲料和化妆品等行业[3-4].目前生产FOS 的方法主要有5 种:(1)直接从天然植物原料中提取;(2)利用天然多糖的酶水解反应获得;(3)利用天然多糖的酸水解反应获得;(4)利用微生物发酵及其转移酶、水解酶催化的糖基转移反应合成[5-7];(5)通过化学合成的方法获得.其中利用微生物及其相应的酶制备FOS 不仅能够提高生产效率,还能够降低生产成本,故而得到广泛应用,具有良好的发展前景.但目前报道的生产菌株产量不高,其中β-呋喃果糖苷转移酶的酶活低且不稳定[8-11],因此筛选出高产和稳定的菌株及其转移酶,是目前该行业的重要研究内容之一.笔者前期研究已筛选得到一株黑曲霉A.niger 6640,能耐受50 ~60 ℃的高温,而且能耐受糖蜜中的无机盐发酵产生高浓度FOS,但该菌株及β-呋喃果糖苷转移酶(简称β-Ffase)的性质尚未清晰.本研究首先利用高效液相色谱法检测黑曲霉A.niger 6640 的发酵产物中FOS 的含量,并优化其发酵条件;对A.niger 6640中β-Ffase 粗酶的性质(pH 值、发酵时间、酶用量)等进行研究,最后用阴离子柱DEAE Sepharose CL-6B 分离纯化β-Ffase,利用SDS-PAGE 电泳初步鉴定β-Ffase 的分子质量.
1 材料与方法
1.1 材料
1.1.1 菌株
黑曲霉A.niger 6640,由华南理工大学食品质量与安全实验室筛选,于2012年9月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.6640.
1.1.2 主要试剂
蔗糖、磷酸氢二钠、柠檬酸,分析纯,广州化学试剂厂生产;蛋白胨、酵母浸膏,生物试剂,广东环凯生物科技有限公司生产;玉米粉,食品级,天津市福晨化学试剂厂生产;蔗果三糖(1-Kestose)、蔗果四糖(Nystose)、蔗果五糖(1F-Fructofuranosylnystose),色谱纯,日本和光纯药工业株式会社生产;果糖、葡萄糖、蔗糖,色谱纯,西格玛奥德里奇(上海)贸易有限公司产品.
1.1.3 主要仪器与设备
SW-CJ-1F 无菌工作台、立式压力蒸汽灭菌锅,上海博讯实业有限公司生产;PYX2190S2A 恒温培养箱,科力电器公司生产;pHS-3C 酸度计,上海精科仪器有限公司生产;AG22331 型低温高速冷冻离心机,德国艾本德公司生产;高效液相色谱仪系统,Waters 1525 Binary HPLC Pump 二元梯度泵,2487 Dual λ absorbance 双波长检测器,Waters 717 plus Autosampler 717+自动进样器,沃特世科技(上海)有限公司提供;Rezex RCM-Monosaccharife Cat 7 mm×D300 mm,美国菲罗门公司生产.
1.1.4 培养基及配方
培养基中各成分的含量以质量浓度计.
黑曲霉A.niger 6640 种子液培养基(简称BMC):蔗糖40 g/L、蛋白胨10 g/L、NaCl 3 g/L.
黑曲霉A.niger 6640 发酵制备FOS 用培养基(简称BMF):蔗糖400 g/L、K2HPO4·3H2O 11 g/L、MgSO4·7H2O 1.5 g/L、酵母膏35 g/L、NaNO310 g/L.
黑曲霉A.niger 6640 产β-Ffase 的种子液培养基(简称BMCE):蔗糖20 g/L、玉米粉30 g/L、酵母浸膏75 g/L、NaNO32 g/L.
黑曲霉A.niger 6640 产β-Ffase 的诱导培养基(简称BMFE):蔗糖70g/L、玉米粉15g/L、酵母浸膏20 g/L、NaNO33 g/L.
缓冲液A 为磷酸氢二钠- 柠檬酸缓冲液,将0.2 mol/L 磷酸氢二钠和0.1 mol/L 柠檬酸溶液配制成不同pH 值的缓冲液;缓冲液B 为Tris-HCl 缓冲液.
1.2 实验方法
1.2.1 FOS 含量的测定
采用高效液相色谱法检测黑曲霉A.niger 6640的发酵产物中FOS 的含量.流动相为双蒸水,使用前经0.22 μm 滤膜过滤,超声脱气,流动相流速为0.6 mL/min,柱温80℃;样品溶液在8000r/min 下离心10 min 后取上清液,先稀释12 倍,然后再用0.22 μm膜过滤后进样,进样体积为10 μL;共有蔗果三糖、蔗果四糖、蔗果五糖、葡萄糖、果糖、蔗糖6 个标准品,每个标准品分别配制成4 种不同质量浓度的溶液,其中前5 个标准品溶液的质量浓度均相同,各为1.333、2.670、3.560、5.333 g/L;蔗糖溶液的质量浓度分别为1.333、3.333、4.670、6.670 g/L.用Empower 积分软件进行数据处理.FOS 含量为蔗果三糖、蔗果四糖和蔗果五糖绝对含量的总和,单位为g/L.FOS 相对百分比为FOS 的面积占总面积百分比.
1.2.2 黑曲霉A.niger 6640 发酵制备FOS 的条件优化
将A.niger 6640 孢子接种于BMC 中,培养24 h(温度28 ℃,转速125 r/min)后为种子液,以体积分数10 %将种子液接种至BMF 中,用于条件优化研究的基本条件为蔗糖质量分数为40%,调节pH 值为8.3,发酵48 h(温度28 ℃,转速125 r/min)后为发酵液,发酵液经灭菌后置于4 ℃备用.
将BMF 培养基分别调节pH 值为6.5、7.1、7.6、8.3、9.0,其他条件不变,研究pH 值对A.niger 6640 发酵制备FOS 的影响.
其他条件不变,在发酵温度分别为24、28、32、36、40 ℃条件下研究发酵温度对A.niger 6640 发酵制备FOS 的影响.
其他条件不变,在发酵时间分别为24、32、40、48、56 h 的条件下研究发酵时间对A.niger 6640 发酵制备FOS 的影响.
其他条件不变,在蔗糖质量分数为40%、50%、60%的条件下研究蔗糖质量分数对A.niger 6640 发酵制备FOS 的影响
1.2.3 黑曲霉A.niger 6640 中β-Ffase 的性质初步研究
1.2.3.1 A.niger 6640 中β-Ffase 粗酶制备
制备工艺为种子液活化→酶的诱导→菌丝体分离→真空干燥或真空冷冻干燥→菌丝体破碎→β-Ffase 粗酶.具体为:在100mL 的BMCE 中接入1 环A.niger 6640 孢子,培养24h(温度33 ℃、转速130 r/min)后为产酶种子液;于500mL 的锥形瓶中,将产酶种子液以体积分数5%接种至200 mL BMFE 中,培养48 h(温度33 ℃、转速130 r/min)后为诱导培养物;将诱导培养物经灭菌400 目的滤袋过滤后,分别置于50℃、真空度为586.16 Pa 的真空干燥箱和-40 ℃、真空度为206.88 Pa 的真空冷冻干燥箱中干燥约24 h,干燥后水分含量低于5%(质量分数),再经破碎后为β-Ffase 粗酶粉.
1.2.3.2 A.niger 6640 的β-Ffase 反应体系的制备
在50mL 的离心管中,将2g 蔗糖溶解于3mL 的缓冲液中,加入β-Ffase 粗酶粉0.004 g,搅拌均匀后在33 ℃、转速125 r/min 的条件下反应24 h 后,灭菌后置于4 ℃下备用.
1.2.3.3 A.niger 6640 的β-Ffase 反应的最佳pH 值优选
配制缓冲液A、缓冲液B 的pH 值分别为6.0、6.5、7.0、7.5,加入β-Ffase 粗酶粉0.004g,其他条件不变,进行酶转化反应.
1.2.3.4 A.niger 6640 的β-Ffase 反应的最佳反应时间优选
在pH=7.0 的缓冲液A 中,分别加入经过真空干燥后粗酶和冷冻干燥后粗酶用量均为0.004 g,其他条件不变,在反应时间分别为2、6、10、16、24 h 的条件下进行酶转化反应.
1.2.3.5 A.niger 6640 的β-Ffase 的最适酶用量优选
在pH=7.0 的缓冲液A 中,分别加入经过真空干燥的β-Ffase 粗酶粉0.04、0.09、0.14、0.19、0.24 g,其他条件不变,进行酶转化反应.
1.2.3.6 A.niger 6640 的β-Ffase 的分离纯化和初步鉴定
取400 mL 发酵后的黑曲霉菌液,经已灭菌的400 目滤袋过滤,用pH =7.0 的50 mmol/L 的Tris-HCL 缓冲液洗涤两次,在30 MPa 压力下破碎细胞后,离心10 min(10 ℃、8000 r/min),取上清液300 mL,在上清液中加入-20 ℃冷冻丙酮250 mL 进行沉淀,离心10 min(10 ℃、8 000 r/min),回收丙酮,迅速用10 mL 的50mmol/L 的Tris-HCL 缓冲液溶解沉淀,离心10 min(10 ℃、8 000 r/min)后,取上清液9 mL 上样.用蒸馏水将阴离子层析柱DEAE Sepharose CL-6B中的乙醇冲洗干净,再用pH =7.0 的50 mmol/L 的Tris-HCl 缓冲液冲洗柱子至平衡,将上样液装入柱子中,用50 mmol/L 的Tris-HCL 缓冲液和0.7 g/mL 的NaCl 的Tris-HCl 缓冲液进行1 ∶1 混合洗脱,在280 nm波长下,测定收集管中吸光值,以A280nm值为纵坐标,洗脱管数为横坐标,作洗脱曲线,测定每个收集管的酶活,合并有酶活的洗脱液后进行真空浓缩后进行SDS-PAGE 电泳.
2 结果与讨论
2.1 黑曲霉A.niger 6640 发酵产物中的FOS含量
黑曲霉A.niger 6640 发酵后样品中的蔗果三糖、蔗果四糖、蔗果五糖、蔗糖、葡萄糖和果糖的HPLC 图谱如图1所示.由图1可知,蔗果四糖和蔗果五糖难以分开,出峰时间同为8.410 min,蔗果三糖、蔗糖、葡萄糖和果糖的出峰时间分别为8.855 、9.725 、11.504 和14.610 min.根据蔗果低聚糖标准品质量浓度和出峰面积,计算得蔗果四糖和蔗果五糖标准曲线方程为Y =108 871.67X,回归系数r2=0.999;蔗果三糖的标准曲线Y =145 858.95X,回归系数r2=0.999,式中X 为糖组分的质量浓度,单位为g/L,所使用的色谱柱为钙离子色谱柱Rezex RCM-Monosaccharife Cat,该色谱柱的特点是使用寿命长,流动相为蒸馏水,容易保存.在GB/T23528—2009 中,规定测定低聚果糖的总含量,对蔗果三糖、四糖及五糖等单体低聚糖的含量没有明确的要求,因此使用钙离子色谱柱Rezex RCM-Monosaccharife Cat 完全能达到分析的要求.
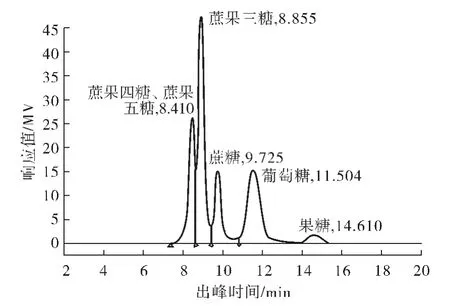
图1 A.niger 6640 发酵后样品中的蔗果三糖、蔗果四糖、蔗果五糖、蔗糖、葡萄糖和果糖的HPLC 图Fig.1 HPLC profile of 1-kestose,nystose,1F-fructofuranosylnystose,sucrose,glucose and fructose production by A.niger 6640
2.2 黑曲霉A.niger 6640 发酵制备FOS 的条件
2.2.1 pH 值对A.niger 6640 制备FOS 的影响
不同pH 值对黑曲霉A.niger 6640 发酵制备FOS 的影响如图2所示.从图2可知,随着pH 值增加,FOS 含量先增高后降低,在pH =7.6 时达到最高,为361.24 g/L;FOS 相对百分比的变化情况与FOS 含量一致,在pH =7.6 时,FOS 相对百分比也达到最高,为67.5 %.pH 值过高或过低都会对发酵产生影响,在其最佳pH 值(7.6)条件下,蔗糖的转化率最大.该pH 值与Xanthophyllomyces dendrorhous最适pH 值(7.0)类似[12],但高于A.niger 的pH =5.0 ~5.5[13],可能是由于微生物种类的不同而导致β-Ffase 的最适pH 值不同,后续的β-Ffase 的初步鉴定也表明菌株来源不同,该酶的分子质量和分子结构也会不同.

图2 p H 值对FOS 产量的影响Fig.2 Effect of pH on the yield of FOS
2.2.2 发酵时间对A.niger 6640 制备FOS 的影响
发酵时间对黑曲霉A.niger 6640 发酵制备FOS的影响如图3所示.从图3可知,随着发酵时间的延长,FOS 含量先升高,在发酵时间为40 h 时达到最大,为252.24 g/L,此后FOS 含量下降,可能是营养物质不足及有害物质积累,FOS 可能发生水解反应而使含量下降,在Aspergillus sp pullulans 27H 中也有类似的结果[14].FOS 相对百分比与含量变化趋势一致,在40 h 时,最大为65.7%.

图3 发酵时间对FOS 产量的影响Fig.3 Effect of fermentation time on the yield of FOS
2.2.3 发酵温度对A.niger 6640 制备FOS 的影响
发酵温度对黑曲霉A.niger 6640 发酵制备FOS的影响如图4所示.从图4可知,最佳发酵温度为33 ℃,FOS 含量为327.89 g/L,FOS 相对百分比也达到最高,为62.7%.该温度同Aspergillus oryzae KB 发酵制备FOS 的温度相同,低于40 ℃,当发酵温度低于40 ℃时,β-Ffase 的热稳定性不高,反应液易被污染,建议通过交联等方式修饰酶的结构,增强其热稳定性[15].

图4 发酵温度对FOS 产量的影响Fig.4 Effect of fermentation temperature on the yield of FOS
2.2.4 蔗糖质量分数对A.niger 6640 发酵制备FOS 的影响
底物质量分数对黑曲霉A.niger 6640 发酵制备FOS 的影响如图5所示.从图5可知,随着底物质量分数的增加,FOS 含量先升后降,在底物质量分数为50%时达到最高,为306.42 g/L;FOS 相对百分比的变化趋势与产量变化趋势相差较大,随着底物质量分数增加,在不断降低,在底物质量分数为40%时最高,为63.5%,此时FOS 含量为284.31 g/L,FOS含量最高时,其FOS 相对百分比为57.1%.底物质量分数可以影响菌种的渗透压从而影响酶活性,因此,选择最佳的底物质量分数可以使酶达到最佳反应效果且不会造成原料的浪费.为了获得较高的FOS 相对百分比,选择蔗糖质量分数为40%,且FOS 含量也较高,因此,最适蔗糖质量分数为40 %.该值同X.dendrorhous 的最适质量分数一致,随着蔗糖质量分数的提高,蔗糖水解酶活性逐渐下降,但β-Ffase 活性不断提高,形成较多的低聚糖[12].
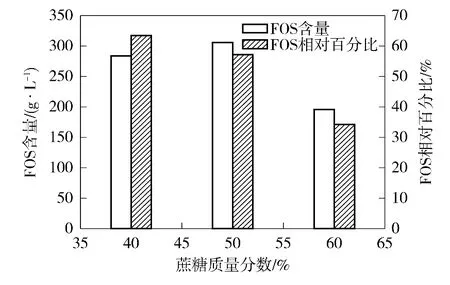
图5 蔗糖质量分数对FOS 产量的影响Fig.5 Effect of sucrose mass fraction on the yield of FOS
2.3 黑曲霉A.niger 6640 中β-Ffase 粗酶的酶学性质表征
对1.2.3.1 节中真空冷冻干燥和真空干燥两种方法制备的β-Ffase 粗酶粉的性质进行了初步研究.
2.3.1 A.niger 6640 的β-Ffase 催化反应的最佳反应pH 值
选择合适缓冲液和pH 值可节省酶的用量,在缓冲液A 和B 中,用两种方法制备的β-Ffase 粗酶在不同pH 值中进行反应,结果如图6所示.

图6 pH 值对β-Ffase 粗酶催化制备FOS 的影响Fig.6 Effect of pH on the yield of FOS biotransformed by β-Ffase
从图6可知,在缓冲液A 中,随pH 值增加,经真空干燥的粗酶催化产生的FOS 的相对百分比先升后降,在pH=6.5 达到最大,为11.8%;随pH 增加,经真空冷冻干燥的粗酶催化产生的FOS 的相对百分比也是先升后降,在pH 值6.5 ~7.0 之间,FOS相对百分比稳定为11.4 %;而在缓冲液B 中,随着pH 值增加,经两种方法制备的β-Ffase 粗酶催化产生的FOS 的相对百分比都逐渐降低,经真空干燥制备的β-Ffase 粗酶催化产生的FOS 相对百分比略高,但是最大值都小于缓冲液A 的最大值.综上所述,经过两种干燥工艺制备的β-Ffase 粗酶,在缓冲液A 中的催化效果都比在缓冲液B 中好;在缓冲液A 中,两种干燥工艺制备的β-Ffase 粗酶的催化结果(FOS 含量和FOS 相对百分比)相差很小,但真空冷冻干燥能耗远高于真空干燥,因此,在后续的研究中选择真空干燥工艺制备β-Ffase;从结果还可推测本研究中β-Ffase 可耐受50 ℃的高温;另外,β-Ffase 最适pH 值为6.5,与菌株A.niger 6640 直接发酵的最适pH 值不同,可能因为菌株中复杂的酶系会影响β-Ffase 的催化效果.
2.3.2 A.niger 6640 的β-Ffase 催化反应的最佳反应时间
经两种干燥方法制备β-Ffase 在缓冲液A 中经不同反应时间后结果如图7所示.从图7可知,随着反应时间延长,两种干燥方法制得的粗酶催化产生的FOS 的相对百分比都是先升后降,在反应16 h 时达到最大,分别是10.6%和8.1%.真空干燥与真空冷冻干燥工艺相比,其FOS 相对百分比均高于后者,因此,真空干燥工艺更适合于β-Ffase 粗酶,最佳反应时间为16 h.

图7 反应时间对β-Ffase 粗酶催化制备FOS 的影响Fig.7 Effect of reactive time on the yield of FOS biotransformed by β-Ffase
2.3.3 A.niger 6640 的β-Ffase 催化反应的最适酶用量
在缓冲液A 中,经真空干燥制得的β-Ffase 粗酶在不同酶用量下进行反应,结果如图8所示.

图8 酶用量对β-Ffase 粗酶催化制备FOS 的影响Fig.8 Effect of enzyme concentration on the yield of FOS biotransformed by β-Ffase
从图8可知,随着酶用量增加,催化产生的FOS的相对百分比先升后降,在酶用量为0.19 g 时达到最大,为50.4%.酶用量是催化反应的一个关键因素,酶用量太少则使反应时间过长而使转化率低,若酶用量太多会造成浪费,因此选择合理的酶用量非常重要,本研究中最佳酶用量为0.19 g.
2.3.4 A.niger 6640 的β-Ffase 的分离纯化和初步鉴定结果
β-Ffase 分离纯化后的洗脱曲线如图9所示.从图9可知,当洗脱液NaCl 的质量浓度为0.1 ~0.2 g/mL时,14-18 管有较强酶活,19-23 管也有少量酶活,将这些洗脱液分别合并进行旋转蒸发浓缩后进行SDS-PAGE 电泳,结果如图10所示.从图10中可知,从上往下,蛋白质标准品分子量大小分别为97、66、53、36 ku,有较强β-Ffase 酶活的14 -18 管有3 条明显蛋白质条带,第1 条的分子质量约为75ku,在19 -23 管也有一条与此接近的条带,该条带最可能是目标β-Ffase 蛋白,这与Guimarães 等[16]从A.ochraceus 中分离出的β-Ffase 的分子质量79 ku 相似,Álvaro-Benito 等[17]研究发现,酵母中β-Ffase 的平均分子质量为60 ~65 ku ,Chen 等[18]从X.dendrorhous分离出的β-Ffase 的分子质量为33 ku .

图9 β-Ffase 的洗脱曲线Fig.9 The elution curve of β-fructofuranosidase
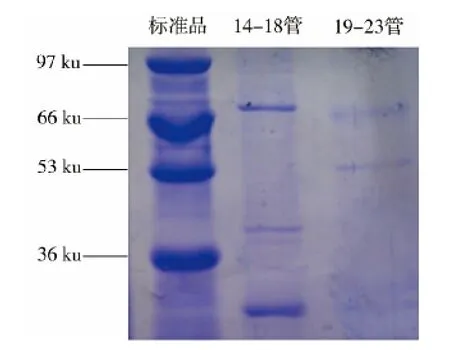
图10 β-Ffase 的电泳图Fig.10 Gel electrophoresis photo of β-fructofuranosidase
3 结论
对自主筛选的耐高温菌株黑曲霉A.niger 6640发酵制备FOS 的条件进行了优化,研究了通过不同工艺从黑曲霉A.niger 6640 中制得的β-Ffase 粗酶的酶学性质,并对A.niger 6640 中的β-Ffase 粗酶进行了初步的分离纯化和鉴定,得出以下主要结论:
(1)A.niger 6640 发酵制备FOS 的最佳pH 值为7.6、最佳发酵时间为40h、最佳发酵温度为33℃、最佳蔗糖质量分数为40%;
(2)真空干燥工艺较为合适A.niger 6640 中的β-Ffase 粗酶的制备;
(3)在磷酸氢二钠-柠檬酸缓冲液中,从A.niger 6640 中制得的β-Ffase 的催化反应的最佳pH 值为6.5、最佳反应时间为16 h、最适酶用量为0.19 g;
(4)SDS-PAGE 电泳分离出一条分子质量约为75 ku 的蛋白质条带,很可能为β-Ffase.
[1]刘冬梅,于淑娟,李国基,等.一种新型的功能性低聚糖——蔗果低聚糖及其生产方法[J].食品工业,1998,10(3):14-16.Liu Dong-mei,Yu Shu-juan,Li Guo-ji,et al.Fructooligosaccharide:a novel functional oligosaccharide and a method for producing it[J].The Food Industry,1998,10(3):14-16.
[2]彭志英,曹劲松,王若峰,等.蔗果糖酶生产菌株的筛选及生产特性研究[J].华南理工大学学报:自然科学版,1996,24(10):128-133.Peng Zhi-ying,Cao Jin-song,Wang Ruo-feng,et al.Study on selection and properties of a high fructooligosaccharide-producing U-fructofruanoside activity Aspergillus niger[J].Journal of South China University of Technology:Natural Science Edition,1996,24(10):128-133.
[3]Valdivieso-Ugarte M,Ronchel C,Bauelos O,et al.Expression of an Aspergillus niger glucose oxidase in saccharomyces cerevisiae and its use to optimize fructooligosaccharides synthesis[J].Biotechnology Progress,2006,22(4):1096-1101.
[4]单黎然,龚月桦,贾建光,等.4 种重要功能性低聚糖的研究进展[J].西北农林科技大学学报:自然科学版,2006,34(7):96-100.Shan Li-ran,Gong Yue-hua,Jia Jian-guang,et al.Research progress in 4 key functional oligosaccharides[J].Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition,2006,34(7):96-100.
[5]Michaela S,David H G C.Purification of β-galactosidase from Aspergillus niger for application in the synthesis of complex oligosaccharides[J].Journal of Molecular Catalysis.B:Enzymatic,2000,8(4/5/6):175-181.
[6]苏加坤,王机,姚评佳,等.β-呋喃果糖苷酶的抑制及其在低聚果糖生产中的应用[J].化学与生物工程,2007,24(5):64-66.Su Jia-kun,Wang Ji,Yao Ping-jia,et al.Inhibition on β-Fructofuranosidase and its application in fructooligosaccharides production [J].Chemistry & Bioengineering,2007,24(5):64-66.
[7]Dolores L,Barbara R,Marta E,et al.Analysis of neofructooligosaccharides production mediated by the extracellular β-fructofuranosidase from Xanthophyllomyces dendrorhous[J].Biotechnology Progress,2012,109(4):123-130.
[8]马歌丽,张学军,靳丽.黑曲霉产β-呋喃果糖苷酶酶学性质研究[J].中国酿造,2009,207(6):22-24.Ma Ge-li,Zhang Xue-jun,Jin Li.Properties of β-fructofurnosidase from Aspergillus niger [J].China Brewing,2009,207(6):22-24.
[9]Solange I M,Lina F B,Dulce A F,et al.Maximization of Fructooligosaccharides and β-fructofuranosidase production by Aspergillus japonicas under solid-state fermentation conditions[J].Food and Bioprocess Technology,2013,6(8):2128-2134.
[10]Guimarães L H S,Somera A F,Terenzi H F,et al.Production of β-fructofuranosidases by Aspergillus niveus using agroindustrial residues as carbon sources:characterization of an intracellular enzyme accumulated in the presence of glucose[J].Process Biochemistry,2009,44(2):237-241.
[11]Wang L M,Zhou H M.Isolation and identification of a novel Aspergillus japonicas JN19 producing β-fructofuranosidase and characterization of the enzyme [J].Journal of Food Biochemistry,2006,30(6):641-658.
[12]Ning Y W,Wang J P,Chen J,et al.Production of neofructooligosaccharides using free-whole-cell biotransformation by Xanthophyllomyces dendrorhous [J].Bioresource Technology,2010,101(19):7472-7478.
[13]Nguyen Q D,Reaessy-Szabo J M,Bhat M K,et al.Purification and some properties of beta-fructofuranosidase from Aspergillus niger IMI303386[J].Process Biochemistry,2005,40(2):2461-2466.
[14]Shin H T,Baig S Y,Lee S W,et al.Production of fructooligosaccharides from molasses by Aureobasidium pullulans cell[J].Bioresource technology,2004,93(1):59-62.
[15]Kurakake M,Masumoto R,Maguma K,et al.Production of fructooligosaccharides by β-fructofuranosidase from Aspergillus oryzae KB [J].Journal of Agricultural and Food Chemistry,2009,58(1):488-492.
[16]Guimarães L H S,Terenzi H F,Polizeli M L,et al.Production and characterization of a thermostable extracellular β-d-fructofuranosidase produced by Aspergillus ochraceus with agroindstrial residues as carbon sources[J].Enzyme and Microbial Technology,2007,42(1):52-57.
[17 ]Álvaro-Benito M,de Abreu M,Fernández-Arrojo L,et al.Characterization of a β-fructofuranosidase from Schwanniomyces occidentalis with transfructosylating activity yielding the prebiotic 6-kestose[J].Journal of Biotechnology,2007,132(1):75-81.
[18]Chen J,Chen X,Xu X,et al.Biochemical characterization of an intracellular 6G-fructofuranosidase from Xanthophyllomyces dendrorhous and its use in production of neo-fructooligosaccharides (neo-FOSs)[J].Bioresource Technology,2011,102(2):1715-1721.
