生长抑素类似物奥曲肽治疗胃癌的效果分析
2015-12-18尹福根陈火国
尹福根 陈火国

[摘要] 目的 探讨生长抑素类似物奥曲肽治疗胃癌的效果。 方法 选取2010年1月~2013年1月我院收治的86例Ⅱ~Ⅲ期胃癌患者,随机分为观察组与对照组,各43例。对照组予以手术后化疗,观察组在术后化疗期间配合奥曲肽治疗,对比两组的临床预后。 结果 观察组的近期疗效总有效率为53.49%,显著高于对照组的32.56%(P<0.05);观察组的无病生存期显著长于对照组(P<0.05);观察组的KPS评分改善率为51.16%,显著高于对照组的30.23%(P<0.05);观察组的2年、3年复发率显著低于对照组,生存率显著高于对照组(P<0.05);两组不良反应差异无统计学意义(P>0.05)。 结论 奥曲肽辅助治疗胃癌能够降低复发率,提高近期疗效,延长患者的生存时间,提高生存质量及生存率,值得推广应用。
[关键词] 奥曲肽;胃癌;生长抑素类似物;生存质量;副反应
[中图分类号] R735.2 [文献标识码] B [文章编号] 1673-9701(2015)31-0084-03
Research on the effect of somatostatin analogues octreotide in treatment of gastric cancer
YIN Fugen CHEN Huoguo
The 4th Medical Department, Jiangxi Provincial Tumor Hospital, Nanchang 330029, China
[Abstract] Objective To investigate the effect of somatostatin analogues octreotide in treatment of gastric. Methods A total of 86 patients ofⅡ-Ⅲ gastric cancer in our hospital from January 2010 to January 2013 were collected and randomly divided into observation group and control group, 43 cases in each group. Control group received chemotherapy after surgery, observation group received octreotide treatment during the postoperative chemotherapy, the clinical prognosis of the two groups were compared. Results The total effective rate of short-term effect in the observation group was 53.49%, significantly higher than the 32.56% in the control group(P<0.05); The disease-free survival time in observation group was significantly longer than the control group (P<0.05); The improvement rate of KPS score in observation group was 51.16%, significantly higher than 30.23% in the control group(P<0.05); The recurrence rate at 2 years and 3 years after surgery of observation group were significantly lower than the control group, while the survival rates were significantly higher than the control group(P<0.05); The adverse events between the two groups had no significant difference(P>0.05). Conclusion Octreotide adjuvant treatment of gastric cancer can reduce the recurrence rate and improve short-term effect, prolong survival time and improve quality of life and survival rate, should be widely applied.
[Key words] Octreotide; Gastric cancer; Somatostatin analogs; Quality of life; Side effects\
胃癌是临床常见消化道恶性肿瘤之一,占消化道恶性肿瘤的50%,死亡率达23%,占各类恶性肿瘤的首位[1]。化疗是延长胃癌患者生存期、提高其生存质量的主要疗法,但其副反应较多,且存在多重耐药等缺陷,对于进展期胃癌的疗效并不满意。近年来,随着手术联合术后放化疗等综合治疗方案的应用,胃癌治疗效果获得了显著提高,但5年生存率仍处于较低水平,仅为20%~30%[2]。因此,寻找一种新的胃癌治疗以及改善临床预后的方法具有重要的现实意义。奥曲肽是一种生长抑素(SST)类似物,既往常用于消化系统出血以及胰腺炎的治疗[3],近年来,诸多研究证实其对于多种肿瘤细胞的生长、增殖具有抑制作用,被逐渐应用于肿瘤的辅助治疗。我院对胃癌患者在术后化疗中配合奥曲肽(octreotide,OCT)治疗,获得了良好疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2010年1月~2013年1月间我院收治的胃癌患者86例,均接受胃癌根治术或胃大部分切除术治疗,术前均经内镜活检,均经细胞学或组织病理学检查确诊,临床分期Ⅱ~Ⅲ期;入院时Karnofsky(KPS)评分≥60分,预计生存期>3个月,入院时的血常规、心电图及肝肾功能检查均无异常。患者及其家属均知情同意,研究经过医院伦理委员会的审核批准,患者均能够配合化疗及观察评估。排除化疗禁忌证及OCT用药禁忌证者,排除合并胃意外重要脏器损害者。将患者随机分为观察组与对照组,每组43例。观察组中,男29例,女14例,年龄33~72岁,平均(55.47±3.72)岁;KPS评分60~91分,平均(76.12±3.24)分;TNM分期:Ⅱ期32例,Ⅲ期11例;病理分型:低分化癌25例,中分化癌11例,高分化癌4例,印戎细胞癌2例,黏液细胞癌1例。对照组中,男32例,女11例,年龄37~75岁,平均(56.63±3.84)岁;KPS评分60~88分,平均(77.24±3.39)分;TNM临床分期:Ⅱ期34例,Ⅲ期9例;病理分型:低分化癌26例,中分化癌10例,高分化癌5例,印戎细胞癌1例,黏液细胞癌1例。两组患者的性别等一般资料差异均无统计学意义(P>0.05)。
1.2 方法
两组均在胃癌根治术或胃大部分切除术后接受化疗。化疗方案为奥沙利铂联合卡培他滨(XELOX)方案:奥沙利铂[齐鲁制药(海南)有限公司,规格:50 mg,国药准字H20093167]130 mg/m2+500 mL 5%葡萄糖注射液静脉滴注2 h,d1;卡培他滨(上海罗氏制药有限公司,规格:0.5 g,国药准字H20073024)1000 mg/m2口服,d1~14,每隔2周重复1次。观察组在化疗期间加用0.2 mg醋酸奥曲肽注射液(北京百奥药液有限责任公司,规格:1 mL∶0.1 mg,国药准字H20061309)皮下注射,3次/d,用药5 d后停用2 d,再进行下一疗程治疗。两组化疗方案均化疗3周为1个疗程,连续治疗至少2个疗程。
1.3 评价指标
1.3.1 生存质量 分别于治疗前后,参照KPS评分标准[3]评价患者的生活质量,并以治疗前后KPS评分差值评价改善情况。KPS提高≥10分为改善,增加或减少<10分为稳定,减少≥10分为降低。
1.3.2 生存情况 统计两组的无病生存期,并统计两组术后1~3年复发率与生存率,转移情况根据CT及B超检查评估。
1.3.3 不良反应 统计两组的化疗副反应发生情况,副反应分级参照抗癌药物急性和亚急性毒性分级标准3.0版(CTCA3.0)[4]评价,分为0~Ⅳ级。统计奥曲肽相关不良反应。
1.4 疗效标准
根据消化道钡餐造影及胃镜检查评估病灶大小,并根据临床症状及病灶大小,参照RECIST实体瘤疗效评价标准[5]进行疗效评价,分为完全缓解(CR):没有明显的肿瘤残余,且病理学检查发现癌细胞已完全坏死,形成瘢痕或者出现纤维增生,至少维持4周;部分缓解(PR):肿瘤最大径之和减少了30%以上,且至少维持4周;稳定(SD):肿瘤最大径之和减少了30%以下,或者出现增大,但未达20%;进展(PD):肿瘤最大径之和增加了20%以上,或者出现了新的病灶。以(CR+PR)/总例数×100%计算治疗有效率。
1.5 统计学分析
数据以SPSS18.0统计学软件分析,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
观察组的总有效率显著高于对照组(P<0.05),见表1。
表1 两组近期疗效比较[n(%)]
2.2 两组无病生存期比较
观察组的无病生存期平均为(11.43±2.26)个月,对照组平均为(8.12±2.15)个月。观察组显著长于对照组(t=8.941,P<0.05)。
2.3 两组生存质量比较
治疗后观察组的KPS评分改善率显著高于对照组(P<0.05),见表2。
表2 两组治疗后生存质量改善情况比较[n(%)]
2.4 两组术后1~3年复发率比较
两组1年复发率差异无统计学意义(P>0.05),但观察组2年及3年复发率显著低于对照组(P<0.05),见表3。
表3 两组1~3年复发率比较[n(%)]
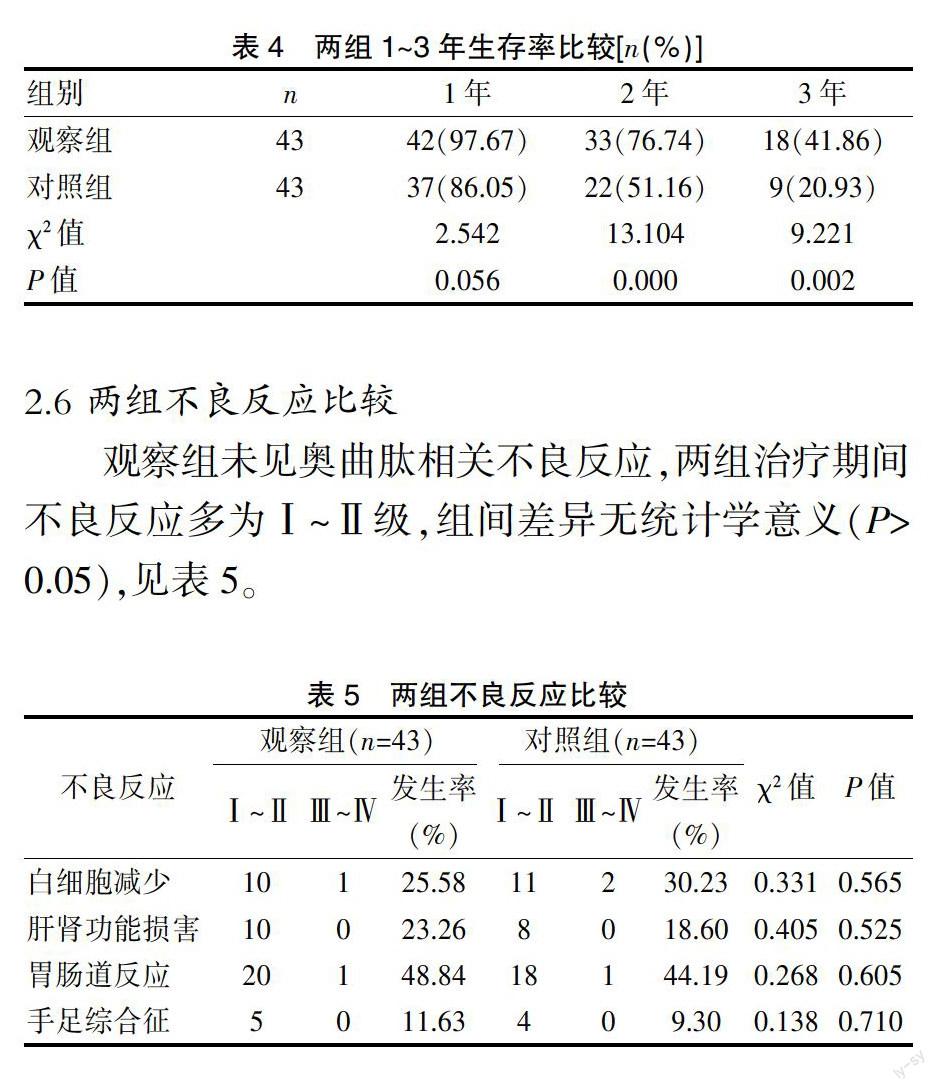
2.5 两组术后1~3年生存率比较
两组1年生存率差异无统计学意义(P>0.05),但观察组2年及3年生存率显著高于对照组(P<0.05),见表4。
表4 两组1~3年生存率比较[n(%)]
2.6 两组不良反应比较
观察组未见奥曲肽相关不良反应,两组治疗期间不良反应多为Ⅰ~Ⅱ级,组间差异无统计学意义(P>0.05),见表5。
表5 两组不良反应比较
3 讨论
SST是一种由D细胞分泌的环状多肽类激素,具有抑制生长激素、促性腺激素以及胃肠激素等物质的释放,从而抑制胃肠蠕动以及胆囊收缩。临床研究表明,SST类似物对于肿瘤细胞的增殖具有抑制作用,对于细胞凋亡具有促进作用,并可抑制肿瘤血管新生,故SST类似物逐渐被应用于肿瘤的辅助治疗[6]。人工合成SST类似物奥曲肽相比于天然SST具有更长的半衰期和更为持久的作用,体外研究及动物研究表明,奥曲肽能够通过与肿瘤表面受体结合,抑制肿瘤外靶器官或者靶细胞表面分布的受体而发挥抑制肿瘤生长的作用,对于恶性肿瘤特别是消化道肿瘤的治疗具有重要意义[7,8]。
奥曲肽对于胃癌等恶性肿瘤的作用机制主要体现在诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖以及抑制肿瘤血管新生方面。因细胞增殖主要经过分裂间期(G1期、S期和G2期)至分裂期(M期),如果细胞周期发生异常,则可导致细胞增殖过度以及肿瘤发生[9]。OCT具有细胞周期组织作用,能够提高DNA合成前期(G1)细胞数,减少S期细胞,使细胞阻滞在G1/S期,从而阻断细胞生长、增殖、分化和迁移,具有良好的抗细胞增殖以及诱导细胞凋亡的作用,从而抑制肿瘤的增长[10]。田蕾等[11]研究表明,奥曲肽能够降低胃癌组织中凋亡相关性基因p53蛋白及增殖细胞核抗原(PCNA)的阳性表达率,对于胃癌细胞生长具有抑制作用,能够促进胃癌细胞凋亡。
血管生长是肿瘤生长、浸润以及转移的基础,而血管内皮生长因子(VEGF)是促进血管生长的重要物质。SST及其类似物奥曲肽能够直接与肿瘤细胞表面上的SST因子相互结合,从而抑制VEGF的分泌与释放,抑制血管新生以及肿瘤生长。郭雯珲等[12]体外研究表明,奥曲肽对于人SGC-7901胃癌细胞中VEGF的分泌具有明显抑制作用,认为奥曲肽辅助治疗胃癌能够抑制肿瘤的发生以及发展,改善临床预后。江卓和[13]对晚期胃癌患者在应用XELOX方案化疗的基础上加用奥曲肽治疗,KPS改善率达63.3%,较单纯XELOX化疗对照组的36.7%显著提高,治疗后6个月、1年及2年生存率达83.3%、56.7%、26.7%,均较对照组的60.0%、30.0%、3.3%显著提高,提示奥曲肽辅助化疗治疗胃癌能够提高患者的生存率,并改善患者的生活质量。本研究中,对照组在术后常规应用XELOX方案化疗,观察组则在化疗期间加用奥曲肽治疗,结果显示,观察组的总有效率及KPS评分改善率分别达53.49%、51.16%,较对照组的32.56%、30.23%显著提高,术后2年、3年复发率仅为18.60%、27.91%,显著低于对照组的51.16%、65.12%,而术后2年、3年生存率达76.74%、41.86%,显著高于对照组的51.16%、20.93%,且无病生存期较对照组显著延长,与任庆涛[14]报道接近,证实奥曲肽辅助治疗胃癌能够延长患者的生存期,提高生存率,抑制肿瘤转移复发。奥曲肽的不良反应较少,主要为消化道不适症状或注射局部疼痛,长期应用可能引起胃炎、胆石症等,偶可见肝肾功能损害、血糖升高及糖耐量异常等[15]。本研究中,观察组治疗期间未见奥曲肽相关不良反应,化疗副反应与对照组无明显差异,患者的耐受性较好。
综上所述,奥曲肽辅助术后化疗能够有效抑制胃癌细胞增殖,提高临床疗效,降低复发率,改善患者的生存质量并延长生存时间,有望成为治疗恶性肿瘤的新型候选方法。
[参考文献]
[1] 王小平,时开网,杨士勇,等. 奥曲肽诱导胃癌术前腹腔化疗淋巴结内肿瘤细胞凋亡[J]. 江苏医药,2010,36(24):2885-2887.
[2] 苏海燕,刘文天,王邦茂,等. 奥曲肽联合长春新碱对胃癌细胞的抑制作用[J]. 天津医科大学学报,2010,16(3):485-487.
[3] Schag CC,Heinrich RL,Ganz PA. Karnofsky performance status revisited:Reliability,validity,and guidelines[J]. J Clin Oncol,1984,2(3):187-193.
[4] 孙燕,周际昌. 临床肿瘤内科手册[M]. 第2版. 北京:人民卫生出版社,2003:102-107.
[5] The European Cancer Organization. Response evaluation criteria in solid tumors[J]. Eur J Cancer,2009,45(2):225-310.
[6] Fenske WK,Bueter M,Miras AD,et al. Exogenous peptide YY3-36 and Exendin-4 further decrease food intake,whereas octreotide increases food intake in rats after Roux-en-Y gastric bypass[J]. Intern Jobesity,2012,36(3):379-384.
[7] 邵国庆,张南征,江兴松,等. 生长抑素对人胃癌裸鼠种植瘤生长的影响[J]. 徐州医学院学报,2014,34(6):360-363.
[8] 王思颖,赵和平,王书敏,等. 消癌平注射液联合奥曲肽对H22荷瘤小鼠细胞凋亡的影响[J]. 中国药物与临床,2013,13(2):151-154.
[9] 惠起源,魏晓萍. 奥曲肽与胃癌治疗的研究现状[J]. 现代肿瘤医学,2011,19(7):1452-1454.
[10] Murugesan SV,Steele IA,Dimaline R,et al. Correlation between a short-term intravenous octreotide suppression test and response to antrectomy in patients with type-1 gastric neuroendocrine tumours[J]. Eur J Gastroenterol Hepatol,2013,25(4):474-481.
[11] 田蕾,李舒. 生长抑素类似物奥曲肽对人胃癌p53和Ras蛋白表达的影响[J]. 南方医科大学学报,2011,31(7):1245-1248.
[12] 郭雯珲,王川,洪天姿,等. 生长抑素受体亚型2、5在胃癌细胞株中的表达及奥曲肽对胃癌细胞分泌VEGF的抑制作用[J]. 临床和实验医学杂志,2010,9(5):321-323.
[13] 江卓和. 奥曲肽治疗晚期胃癌的疗效分析[J]. 医学信息,2014,27(4):432.
[14] 任庆涛. 生长抑素类似物奥曲肽在胃癌治疗中的应用效果观察[J]. 中国实用医药,2015,10(15):164-165.
[15] 付蔷,李光学. 奥曲肽所致不良反应的一般规律及特点回顾性分析[J]. 中国医药指南,2012,10(35):273-274.
(收稿日期:2015-08-19)
