元素周期律(表)考题研究及知识梳理
2015-12-18张楚玲,衷明华
元素周期律(表)考题研究及知识梳理
张楚玲衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:元素周期律(表)是中学化学最基本、最重要的知识点之一,也是广东省近年来高考必考的。本文结合2010—2014年广东高考化学试卷试题分析广东高考中元素周期律(表)的热门考点,并梳理了相关高考必备基础知识,以供复习参考。
关键词:广东高考元素周期律(表)考题研究知识梳理
前言
元素周期律(表)内容丰富,规律性强,命题空间广泛。就广东省近5年来高考的试题来看:考查的热点是元素周期表中位、构、性三者关系的考查、元素性质的递变规律(原子半径、元素化合价、金属性与非金属性的强弱、元素最高价氧化物水化物的酸碱性强弱、气态氢化物稳定性等)、原子核外电子排布的递变规律、元素周期表的结构以及元素性质与原子结构;题型以选择题为主,基本模式为“推断元素种类、推断元素性质递变规律”;难度中等。
1.考题研究
1.1例(2010广东化学10)短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是()。

表 短周期金属元素甲~戊在元素周期表中的相对位置
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
分析:结合题意,由“短周期元素”可得甲~戊位于第二、第三周期。根据元素周期律相关知识,通过排除法可得答案为C。
小结:这类题目的突破口是熟练掌握元素周期律(详见本文知识梳理2.2)。
1.2例(2011广东化学22)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA 族,甲和丙同主族,丁的最外层电子数和电子层数相等,则()。
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
分析:结合题意,由“短周期元素”可得甲乙丙丁可能位于第一、二、三周期,且“原子序数依次增大”。由“甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA 族”可得乙为N,甲为H,丙为Na,丁为Al。再根据元素周期律不难推断出A对,B错。Na2O2为离子化合物,故C错。硝酸、氢氧化钠和氢氧化铝(两性化合物)可两两发生反应,故D对。
小结:这类题型的突破口是通过题目给出的信息达到确定元素种类的目的,再根据元素性质的规律选出正确答案。
1.3 例(2012广东化学22)下图是部分周期元素化合价与原子序数的关系图,下列说法正确的是()。

图 部分周期元素化合价与原子序数的关系
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
分析:由图可知:X 为O,Y为Na,Z为Al,W为S,R为Cl。根据元素性质的规律,可得正确答案为BD。
小结:这类题型的突破口是通过元素的最高正价或最低负价确定元素的主族序数,再通过同主族元素的半径大小判断元素所处的周期,达到确定元素种类的目的,再推断性质的规律。
1.4 例(2013广东化学22)元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是()。
表元素R、X、T、Z、Q在元素周期表中的相对位置

A.非金属性:Z B.R与Q的电子数相差26 C.气态氢化物稳定性:R D.最高价氧化物的水化物的酸性:T>Q 分析:由“R单质在暗处与H2剧烈化合并发生爆炸。”可知R为F。再结合元素周期表元素的位置。可知R、X、T、Z、Q各为F、S、Cl、Ar、Br。进而结合“同周期、同主族元素性质递变规律”(详见本文知识梳理2.2),可得出正确答案为B、D。 小结:这类题目的突破口是记住一些元素的特殊性质(详见本文知识梳理2.3)。有时这些性质就是成功解题的关键。 1.5 例(2014广东化学23)甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是()。 表甲~辛等元素在周期表中的相对位置 A、金属性:甲>乙>丁 B、原子半径:辛>己>戊 C、丙和庚的原子核外电子数相差13 D、乙的单质在空气中燃烧生成只含离子键的化合物 分析:由元素周期律“同主族元素从上到下,元素金属性增大。”可排除A。“同主族元素从上到下,元素原子半径增大。同周期元素从左到右,元素原子半径减小”可得B是对的。“戊的一种单质是自然界硬度最大的物质”可知戊为C。“甲和戊的原子序数相差3”可知甲为Li。丙为Na。氧化钠为共价化合物,故D错,C对。 小结:对元素周期律和一些元素性质的考查。 1.6考题总结:在答题时,要仔细观题,发掘题目隐藏的信息。如:“短周期”“原子序数依次增大”“同周期”“同主族”等。从往年广东高考真题,不难发现,主要考查短周期元素的性质规律,因此,备考时要熟记元素周期表1—20号元素的位置及相关性质。熟练掌握元素周期率及某些元素的性质,这有利于我们更快、更准的找到正确的答案。平时要多做练习,善于举一反三。历年来广东对该知识点的考查难度不会很高,只要认真总结规律、记住性质,一般都能把该题的分数轻松收入囊中。 2.1位置、结构、性质之间的关系 图 位置、结构、性质之间的关系 2.2同周期、同主族元素性质递变规律 表 同周期、同主族元素性质递变规律 2.3常见元素的性质 (1)自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素:C。 (2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。 (3)地壳中含量最多的元素或氢化物在通常情况下呈液态的元素:O;地壳中含量第二的元素:Si;地壳中含量最多的金属元素:Al。 (4)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的中学常见的元素:Al。 (5)元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素:N。 (6)单质最轻的元素:H;组成最轻的金属单质的元素:Li。 (7)单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。 (8)位置的特殊性:周期数=主族序数的元素有H、Be、Al。 (9)化合价的特殊性:O、F没有最高正价;短周期中只有铝能形成+3价简单离子;H、C、Si最高正价和最低负价之和为0。 (10)半径的特殊性:短周期主族元素中,H半径最小,Na半径最大。 (11)颜色特殊性:Cl2为短周期元素中唯一黄绿色气体单质,S为短周期元素中唯一淡黄色固体单质。 (12)性质及应用的特殊性:短周期中Na、F分别为最强的金属和非金属,CO2是温室气体、氮硫的氧化物能形成酸雨、NH3是常见碱性氢化物,铵盐是常见的由非金属形成的离子化合物,Al、Al2O3、Al(OH)3具有两性,硅是重要半导体材料,氯能用于作为漂白剂,HClO是最强无机酸。 (13)单质在暗处与H2剧烈化合并发生爆炸的元素:F。 笔者认为今后的命题会稳中有变。一方面仍以元素及其化合物知识为载体,运用物质结构理论进行现象的解释、性质的判断与比较等;另一方面会跟随新课标,用图表形式给予信息渗透新知识,与其他知识相结合(氧化还原性的判断、电化学正负极判断等)考查学生对基础知识理解与掌握的情况和运用能力。
2.知识梳理
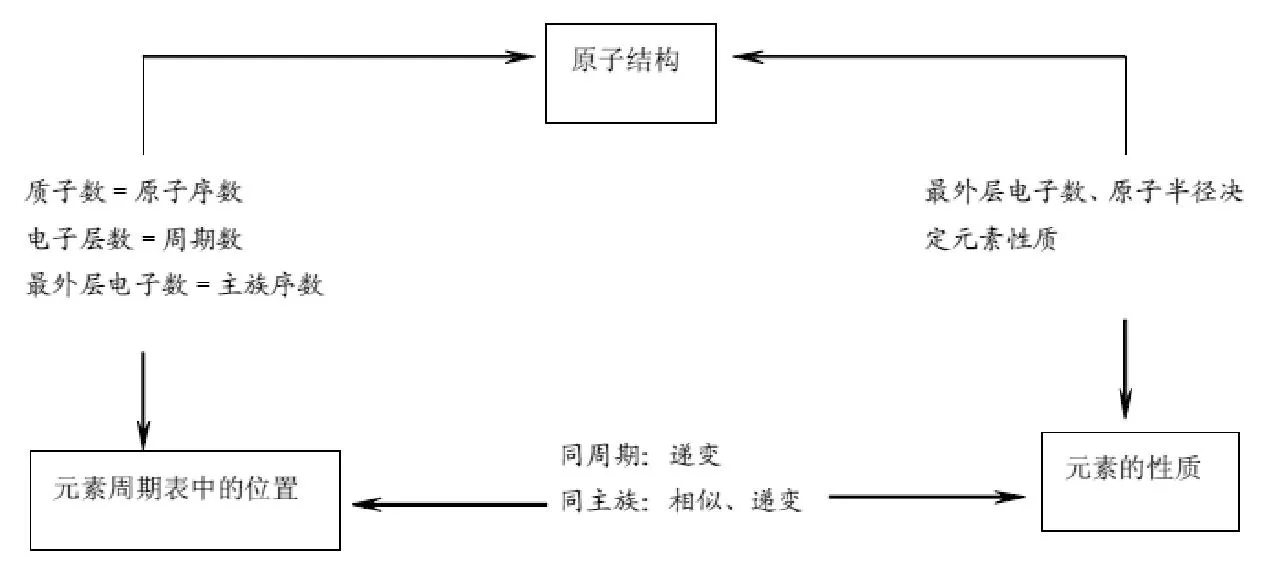

3.高考命题趋势预测
