高效液相色谱法测定发芽麦粒中γ-氨基丁酸(GABA)含量
2015-12-18张志清
张志清 徐 杰 丛 军 任 飞
(四川农业大学食品学院,雅安 625014)
高效液相色谱法测定发芽麦粒中γ-氨基丁酸(GABA)含量
张志清 徐 杰 丛 军 任 飞
(四川农业大学食品学院,雅安 625014)
建立了一种测定发芽麦粒中γ-氨基丁酸(GABA)含量的HPLC方法,并对四川10个小麦品种中GABA含量差异及其发芽培养期间变化规律进行了分析。采用FDNB(2,4-二硝基氟苯)为柱前衍生剂,色谱条件为:色谱柱 Luna C18(2)(150 mm×4.60 mm,5μm),乙腈 -0.02 mmol/L乙酸铵混合溶液为流动相(V∶V=15∶85),柱温30℃,流速1.0 mL/min,测定波长320 nm。结果表明,在0.025 5~0.127 6μg范围内,呈良好的线性关系,最低检出限1.081×10-5μg/mL,方法的平均加标回收率为97%。采用建立的方法测定不同小麦品种在萌发12 h后的GABA含量在0.238~5.26 mg/100 g之间,不同品种间GABA的含量差异显著,在萌发的0~12 h内,GABA含量呈现先上升后下降的趋势,在8 h时含量达到最高。
发芽麦粒 γ-氨基丁酸(GABA) 高效液相色谱法
γ-氨基丁酸(GABA)是一种非蛋白质氨基酸和重要的神经递质[1],广泛存在于植物和动物体内,具有抗焦虑[2],抗氧化[3]和生殖生理作用[4]。GABA的制备主要有化学法、微生物法和植物富集法。然而前2种方法各有欠缺,化学法条件苛刻,耗能大,且有化学物质的残留;微生物法效率较高,但高产菌株难以获得。有学者报道可通过基因工程的办法来重组高产的大肠埃希氏菌富集GABA,但其能力仍不及通过植物富集的方法[6]。相比而言,植物富集方法优势在于成本低,条件也容易控制,得率较高,比较容易实施[7]。谷物类粮食中的蛋白质被其内在的蛋白酶水解后生成大量谷氨酸,在一定条件下可被谷氨酸脱羧酶催化转化生成GABA,同时可以通过补充谷氨酸钠等方法使谷物中GABA的含量大大提高[8]。麦粒在萌发的过程中,各种酶被活化,谷氨酸在谷氨酸脱羧酶的作用下不断转化为GABA,加之麦粒本身就含有一定的GABA,通过发芽富集能显著提高 GABA的含量[9-10]。
目前,国内外检测GABA含量的方法主要有氨基酸自动分析仪法、酶法、毛细管电泳法、比色法等。近年来随着高效液相色谱仪的普及和其分辨率高、灵敏、精确的优点,该法得到了广泛应用。由于GABA不能直接被检测器捕获,必须对其进行衍生化处理,生成稳定的化合物。常用柱前衍生剂有邻苯二甲醛(OPA)、丹酰氯(DNS)、氯甲酸芴甲酯(FMOC)、咔唑 -9-己基氯甲酸酯(CEOC)、2,4二硝基氟苯(FDNB)、异硫氰酸苯酯(PITC)[5]和 AQC(6-氨基喹啉基-N-羟基琥珀酰亚氨基氨基甲酸酯),但往往会因样品类型不同而有所差异。本研究拟采用2,4二硝基氟苯(FDNB)作为柱前衍生剂,在高效液相色谱方法的基础上建立一种稳定、方便、准确的方法,并以该法分析不同小麦品种在萌发时期GABA含量的变化,为利用小麦富集GABA积累参考依据和技术支撑。
1 材料与方法
1.1 材料与试剂
小麦材料由四川农业大学小麦研究所提供的良麦2号、川农16号、川麦10号、绵阳26号、川麦20号、川育6号、良麦4号、川麦22号、川育8号、川育16号共10个品种。
γ-氨基丁酸标准品(纯度≥99%)、2,4-二硝基氟苯(FDNB):美国Sigma公司;乙腈(色谱级):美国Supelco公司;水为超纯水。
1.2 主要仪器与设备
Shimadzu10A高效液相色谱仪(配N2000色谱工作站):日本Shimadzu公司;Mill-Q超纯水仪:德国密理博公司;JY 92-IID型超声波细胞粉碎机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 色谱条件
色谱 柱:Luna C18(2)(150 mm × 4.6 mm,5μm);流动相:乙腈:乙酸铵溶液(0.02 mmol/L)(V∶V)=15∶85;流速:1.0 mL/min;检测波长:320 nm;柱温:30℃;进样量:10μL。
1.3.2 样品制备
准确称取精选后的小麦种子约3 g,用蒸馏水冲洗,然后用75%的酒精溶液浸泡5 min,最后用去离子水清洗,转移入培养皿中,并于30℃的培养箱中进行发芽培养12 h。培养结束后,将麦粒放入研钵研磨,加入 50 mL乙醇 -水溶液(V∶V=60∶40),在40℃下,超声波提取2次,每次15 min,提取功率为300W。用旋转蒸发仪将提取液浓缩,衍生化处理,流动相定容至25 mL,12 000 r/min离心10min,用孔径为0.22μm的有机滤膜过滤,待测。
1.3.3 衍生化处理
在浓缩后的样品处理液中添加0.5 mol/L NaHCO3(pH 9.0)溶液1 mL和1%FDNB的乙腈溶液1 mL,混匀,置于60℃水浴中1 h,注意避光,冷却至室温后用流动相调至刻度,摇匀,12 000 r/min,离心10 min,取上清,滤膜过滤后备用。
1.3.4 标准曲线的绘制
取5 mg GABA标样,溶解于5 mL超纯水,配制成100μg/mL的溶液,备用。取1 mL样品衍生化处理,过滤。准确吸取上述衍生化处理过的标准品溶液,分别取体积为 1、2.5、5、7.5、10、15μL注入高效液相色谱仪中,进行色谱分析,以峰面积为纵坐标(Y),以进样量(μg)为横坐标(X)绘制标准曲线。
2 结果与分析
2.1 系统适应性评价
精确吸取处理过的10μL标准品和小麦样品(良麦2号)在1.3.1的色谱条件下检测。结果如图1所示。标准品保留时间为18.723 min,理论塔板数n=12 000,且峰型正常,无拖尾现象。样品保留时间为18.818 min,峰底宽为0.417,样品色谱分离中GABA色谱峰与最难分离组分的分离度为R=1.54。说明该色谱条件下能够有效的分离发芽麦粒中GABA。
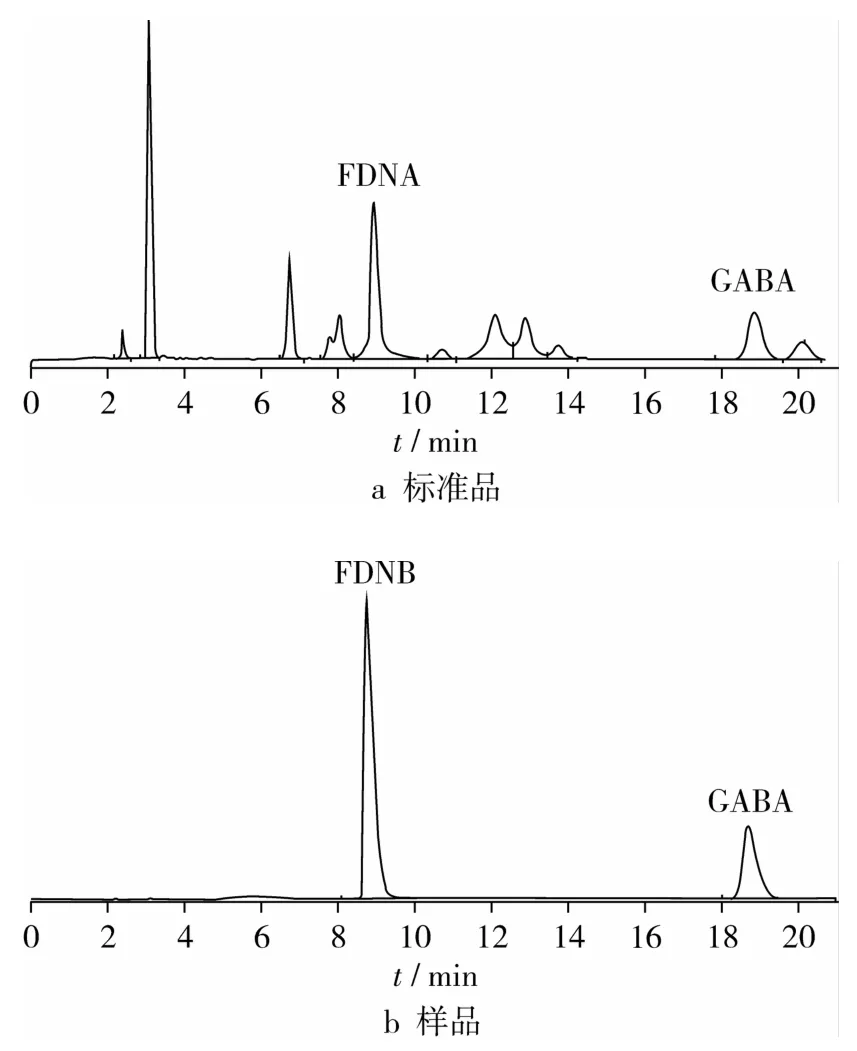
图1 GABA测定标准品和样品色谱图
2.2 线性关系与检测限
准确吸取衍生化处理过的标准样品,体积分别为 1、2.5、5、7.5、10、15μL,注入高效液相色谱仪中。以峰面积为纵坐标(Y),以标准品进样量(μg)为横坐标(X)绘制标准曲线。得GABA的回归方程Y=107X-693 98(r=0.999 9)。结果表明 GABA进样量0.025 5~0.127 6μg范围内呈良好的线性关系,以基线噪声的3倍计算最低检出限为1.081×10-5μg/mL。
2.3 精密度试验
将处理后的0.10 mg/mL的标准样品10μL,连续反复进样5次,以峰面积考察其精密度,结果显示GABA的相对标准偏差为小于1.2%。

表1 精密度试验测定结果
2.4 重复性试验
取良麦2号小麦品种,按照样品处理方法同时分别制备5份样品溶液进行测定,以GABA含量考察重复性,相对标准偏差小于2%。证明该方法具有良好的重现性。
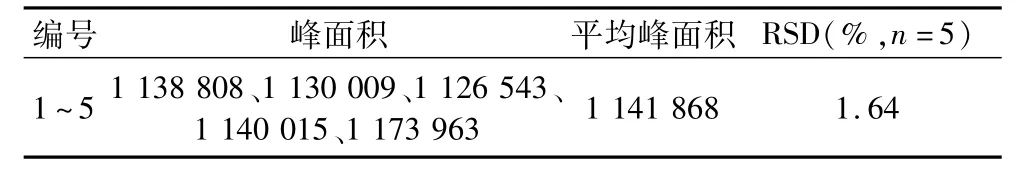
表2 重复性试验测定结果
2.5 稳定性试验
取处理过的标准液,分别于 0、2、4、6、8 h进样,进行GABA含量测定。由表3可知,GABA峰面积的RSD值为1.24%,表明GABA在8 h内相当稳定。

表3 8 h内稳定性试验测定结果
2.6 回收率试验
称取良麦2号小麦29.90、30.01和30.16 g麦粒,在30℃培养箱中培养12 h,分别加入1.1、2.2和3.3 mg的GABA标准品(重复3次),按1.3.2制备样品液,分别测定它们的平均回收率为110%、95%和86%,RSD分别为6.78%、5.46%和12.17%。其平均加标回收率为97%。
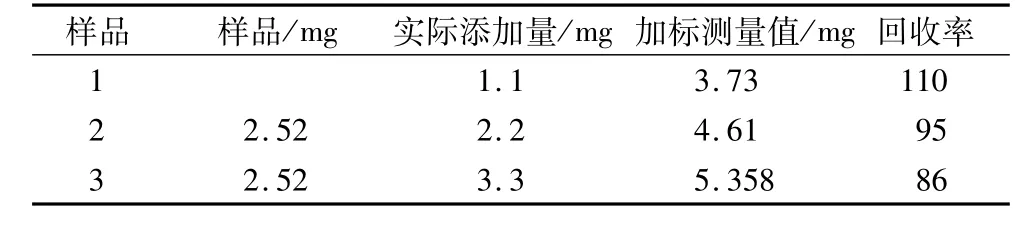
表4 加标回收率试验测定结果
2.7 样品含量测定
按照本研究方法和色谱条件测定10个小麦品种中GABA的含量测定。将精选后的小麦种子用蒸馏水冲洗,当小麦从烧杯中取出,75%的酒精溶液浸泡5 min,用去离子水清洗,转移入培养皿中,发芽期间种子湿润状态并防止种子部分接触水面积时间较久而腐烂发臭,30℃培养箱中培养12 h,检测结果如表5所示。结果表明,这些小麦材料中GABA含量在0.238~5.26 mg/100 g之间,并且不同的小麦品种间GABA的含量差异显著。
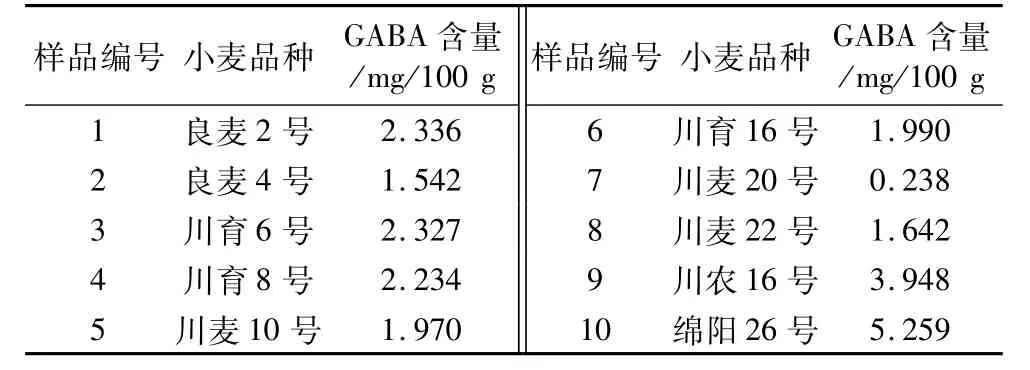
表5 不同小麦品种GABA含量的测定结果
2.8 5种发芽麦粒中GABA含量变化分析
选取良麦2号,川农16号,川麦10号,绵阳26号,川麦20号作为代表,利用所建立的方法分析5个小麦品种在萌发(0~12 h)的GABA含量变化规律。结果如图2所示,良麦2号、绵阳26、川农16、川麦10号等4个品种在萌发培养8 h时,GABA含量达到最高值。在麦粒萌发的过程中GABA含量的大体趋势是先升高后降低,不同的小麦品种间,γ-氨基丁酸含量有较大差异。这可能是由于小麦在萌发初期,麦粒中内源性蛋白酶和谷氨酸脱羧酶将蛋白质水解并将其中的谷氨酸在脱羧积累产生γ-氨基丁酸,同时生成的γ-氨基丁酸在转氨酶的催化下形成琥珀酸半醛不断被消耗,在8 h后其中的谷氨酸基本消耗,而转氨酶继续水解γ-氨基丁酸,导致γ-氨基丁酸在8~12 h内含量迅速下降。但川麦20号则是不断降低的。这种不同品种类型间GABA含量的差异可能由于川麦20号发芽麦粒的组织中GAD活性的太低所致。根据上述规律可以对小麦等粮食作物进行γ-氨基丁酸的富集,并对富集条件和富集时间进行优化,做到对γ-氨基丁酸的最大化富集,我国小麦品种多,因此,筛选出高γ-氨基丁酸合成能力的小麦品种也有助于采用小麦萌发来富集γ-氨基丁酸。
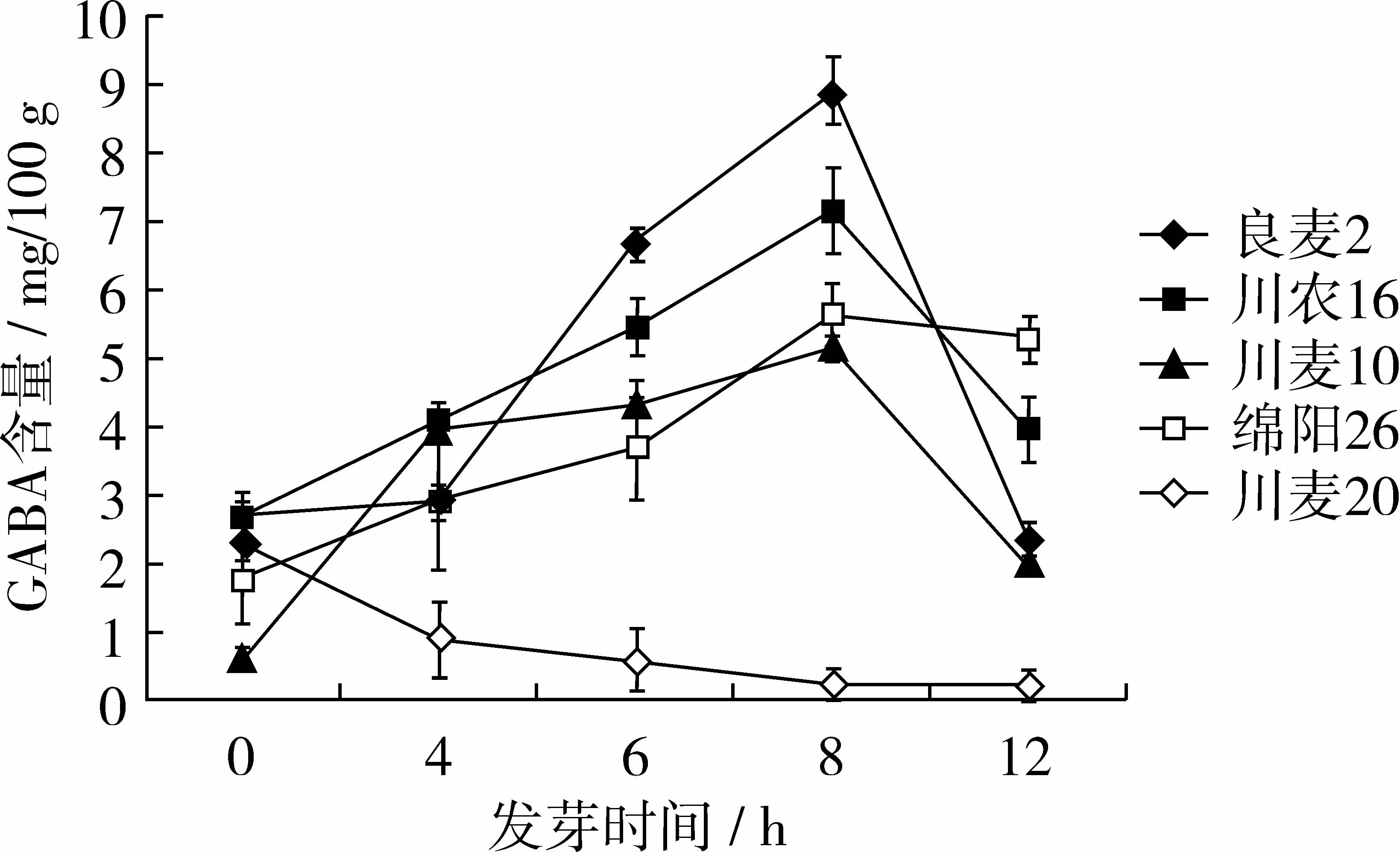
图2 5种发芽麦粒中发芽过程中GABA的变化
3 讨论
3.1 检测方法的确定
文献中GABA含量测定的报道中,主要有比色法、紫外分光光度法、氨基酸分析法和高效液相测定法。在前2种方法中,由于被检测物质的成分比较复杂,容易受到其他物质的干扰,影响GABA的检测,使检测结果不够精确。目前所采用的氨基酸分析法,在柱前或柱后衍生化后,大多数都用价格昂贵的荧光检测器进行测定。由于GABA不能直接用高效液相的方法进行检测,因此根据各个衍生剂的不同,检测方法也有所差异。常用的方法有PITC法、DNS法、CEOC法、FDNB法和 OPA法[12]。前3种方法存在速度慢,反应试剂容易干扰等问题,而OPA法因其衍生物稳定性较差,试验效果不够理想。FDNB能与GABA反应生成稳定的衍生物。该反应速度快,不但能获得较高检测灵敏度还能较少其他物质的干扰[13]。方法简单易行等优点,因此是一种理想的检测方法。
3.2 色谱条件的优化
本研究在色谱条件优化中比较了不同的流动相组合和色谱柱类型对分离效果的影响。首先选用了Hyperelone BDSC18柱(150 mm×4.6 mm,5μm色谱柱,甲醇-磷酸盐作流动相。流速在0.8~1.0 mL/min时。当甲醇∶磷酸盐≤83∶17时,保留时间虽短,但其理论塔板数不高,样品中GABA的分离度达不到。采用同比例的甲醇和乙酸铵做流动相.乙酸铵的比例越大,分离效果越好。但随着相对保留时间延长,峰高下降,峰展宽加剧灵敏度降低[14]。选用乙腈∶乙酸铵 =15∶85,选用流速为1.0mL/min时,柱温为30℃时,柱效(理论塔板数)可达4 400,明显好于甲醇 -乙酸铵。当选用Phenomenex LunaC18(2)(150 mm×4.60 mm,5μm)色谱柱时,理论塔板数达到12 000,分离效果明显提高(图1)。综合考虑,选用乙腈-乙酸铵(15∶85)做检测流动相,流速为1.0 mL/min,柱温为30℃,此时GABA留时间为18.723 min,因此,试验确定此流动相为最佳流动相配比。
3.3 样品处理方法的优化
GABA测定样品处理的方法主要有索氏抽提法[15],回流提取和震荡提取3种方法,但3种方法都存在一定的不足。索氏抽提法在这3种方法中提取率最高,但其实际操作麻烦,且回流次数多,耗时长;回流提取法虽然操作起来较索氏抽提法方便,但其提取率要相对低一些,震荡提取虽然简单,但提取率在这3种方法中最低,且耗时更长,一般是12 h以上,本研究采取超声波细胞破碎进行提取,操作简单,时间短,且提取次数少,提取率高。提取率随提取温度和提取功率的提高而上升,在满足本试验的基础上,提取温度为30℃,提取功率为300 W,提取2次,每次15 min,此时提取率可达97%以上。
3.4 不同小麦品种GABA含量的差异
用本方法测定良麦2号、川农16号、川麦10号、绵阳26号、川麦20号5种小麦粒在萌发的过程中GABA含量的变化结果可知:不同小麦品种中GABA含量不同;发芽麦粒中GABA含量的动态变化趋势呈先增高后降低。这是由于小麦在发芽过程中,谷氨酸在内源性蛋白酶和谷氨酸脱羧酶的共同作用下产生了GABA,同时生成的GABA在转氨酶的催化下形成琥珀酸半醛而被不断被消耗,导致GABA含量下降。根据这一规律可以对小麦等粮食作物进行GABA的富集,并对富集工艺进行优化,做到对GABA的最大化富集,我国小麦品种多、类型丰富,因此,筛选出高GABA含量的小麦品种也是亟需要解决的课题。
4 结论
本研究建立了一种检测麦粒中GABA含量的HPLC方法,采用 FDNB进行柱前衍生,Luna C18(2)(150 mm×4.60 mm,5μm)色谱柱,乙腈 -0.02 mmol/L乙酸铵(15∶85)混合溶液为流动相,作为最优色谱条件,结果表明在0.025 5~0.127 6μg范围内,呈良好线性关系,最低检出限1.081×10-5μg/mL,平均加标回收率为97%。采用此方法测定小麦品种在萌发12 h后的GABA含量在0.238~5.26 mg/100 g之间,品种间GABA的含量差异显著,0~12 h期间,GABA含量呈现先上升后下降的趋势,在8 h时含量达到最高。
[1]Deewatthanawong R,Rowell P,Watkins C B.γ-Aminobutyric acid(GABA)metabolism in CO2treated tomatoes[J].Postharvest Biology and Technology,2010,57(2):97-105
[2]Kiersten SS,Uwe R.Anxiety and depression:mouse genetics and pharmacological approaches to the role of GABAAreceptor subtypes[J].Neuropharmacology,2012,62(1):54-62
[3]Sogawa N,Hazehara Y,Kunitomo M,et al.Age-dependent changes in the susceptibility to thiopental anesthesia in mice:analysis of the relationship to the functional expression of GABA transporter[J].Pharmacology,Biochemistry and Behavior,2012,103(2):267-272
[4]Chen W Y,Ni Y,Pan Y M et al.GABA,progesterone and zona pellucida activation of PLA2and regulation by MEKERK1/2 during acrosomal exocytosis in guinea pig spermatozoa[J].FEBSLetters 2005,579(21):4692-4700
[5]Lamberts L,Joye IJ,Belien T,et al.Dynamics of gammaaminobutyric acid in wheat flour bread making[J].Food Chemistry,2012,130(4):896-901
[6]Le Vo T D,Kim TW,Hong SH.Effects of glutamate decarboxylase and gamma-aminobutyric acid(GABA)transporter on the bioconversion of GABA in engineered Escherichia coli[J].Bioprocess and Biosystems Engineering,2012,35(4):645-650
[7]孟祥勇.糙米、大豆发芽富集γ-氨基丁酸及复合谷物饮料的研究[D].无锡:江南大学,2009
[8]Iimure T,Kihara M,Hirota N,et al.A method for production ofγ-aminobutyric acid(GABA)using barley bran supplemented with glutamate[J].Food Research International,2009,42(3):319-323
[9]Youn Y S,Park JK,Jang H D,et al.Sequential hydration with anaerobic and heat treatment increases GABA(γ-aminobutyric acid)content in wheat[J].Food Chemistry,2011,129(4):1631-1635
[10]Guo Y X,Chen H,Song Y,et al.Effects of soaking and aeration treatment onγ-aminobutyric acid accumulation in germinated soybean(Glycinemax L.)[J].European Food Research and Technology A,2011,232(5):787-795
[11]Fish W W.A reliable methodology for quantitative extraction of fruit and vegetable physiological amino acids and their subsequent analysis with commonly available HPLC systems[J].Food and Nutrition Sciences,2012,3(6),863-871
[12]郑洪健,叶立斌,励建荣,等.2,4-二硝基氟苯柱前衍生RT-HPLC法测定γ-氨基丁酸[J].中国粮油学报,2011,26(4):104-106
[13]马艳凤,李琼,武晓剑,等.化妆品中2种限用呫吨染料的高效液相色谱检测[J].分析实验室,2012,31(3):70-72
[14]刘忠珍,曾芳,黄玉芬,等.丁草胺高效液相色谱检测法[J].广东农业科学,2010,17(9):48-50
[15]房克敏,李再贵,袁汉成,等.HPLC法测定发芽糙米中γ-氨基丁酸含量[J].食品科学,2006,27(4):208-211.
Determination ofγ-Aminobutyric Acid(GABA)in Germinated Wheat Seed by HPLC
Zhang Zhiqing Xu Jie Cong Jun Ren Fei
(College of Food Science,Sichuan Agricultural University,Ya′an 625014)
The HPLC determination method forγ-aminobutyric acid(GABA)in germinated wheat seed has been improved in the paper.Meanwhile,the GABA content in 10 different kinds ofwheat cultivars from Sichuan area have been investigated by HPLC method.Isocratic elution was used for separation and quantification of GABA derivateswith FDNB.GABA was determined on Luna C18(2)(150 mm×4.6 mm,5μm)with mobile phase of acetate ammonium(0.02 mmol/L)and acetonitrile(V∶V=85∶15).The flow rate was 1.0 mL/min;column temperature 30℃,and the detection wave length was 320 nm respectively.The results indicated that a good linearity was observed within a range from 0.025 5~0.127 6μg.The limitof detection is1.081×10-5μg/mL.The average recoveries are 97%for GABA determination.GABA content ranged 0.238~5.26mg/100 g in differentwheat varieties after germination 12 h was determined by the established method.The significant difference of content in GABA among different varietieswas also observed.During germination of 0~12 h,GABA content has shown a trend of first increased and then decreased,with content peak at8 h.
germinated wheat seed,γ-aminobutyric acid(GABA),HPLC
TS210
A
1003-0174(2015)11-0135-05
四川省教育厅重点项目(09ZA081)
2014-04-22
张志清,男,1976年出生,教授,粮油副产物开发利用
