水飞蓟寡肽对小鼠肝线粒体损伤的保护作用
2015-12-18朱淑云秦云云
朱淑云 沙 莎 秦云云 董 英
(江苏大学食品与生物工程学院,镇江 212013)
水飞蓟寡肽对小鼠肝线粒体损伤的保护作用
朱淑云 沙 莎 秦云云 董 英
(江苏大学食品与生物工程学院,镇江 212013)
研究水飞蓟寡肽对羟自由基(·OH)致小鼠肝细胞线粒体氧化损伤的保护作用。采用·OH诱导小鼠肝细胞线粒体氧化损伤,通过测定线粒体肿胀度、丙二醛含量、琥珀酸脱氢酶及ATP酶活性、线粒体膜电位和膜流动性等指标,研究水飞蓟寡肽对·OH引起的体外氧化损伤的保护作用。结果表明水飞蓟寡肽可显著抑制小鼠肝细胞线粒体的肿胀,降低丙二醛的含量,可显著增强琥珀酸脱氢酶和ATP酶活性,维持线粒体膜电位和膜流动性,在试验剂量范围内,以高浓度组效果最好。研究证明水飞蓟寡肽可以抑制·OH所致的小鼠肝细胞线粒体氧化损伤,其机制可能与清除自由基、抑制脂质过氧化有关。
水飞蓟寡肽 线粒体 羟基自由基 抗氧化
正常情况下,机体内的自由基维持在一个正常的生理水平上,在某些病理情况或机体衰老的情况下,自由基的产生和消除失去平衡,就会导致氧化损伤,从而引发疾病。机体可以通过补充抗氧化剂来减缓自由基引起的氧化损伤。近年来,生物活性肽作为一种新型的天然抗氧化剂的研究正在兴起,这些抗氧化肽类能在一定程度上减轻机体的氧化损伤,减少疾病的发生,正逐渐显示出他们在医药和食品等领域的优势[1-2]。
水飞蓟(Silybum Marianum L.Gaertn)作为一种传统的药用植物,其药用有效成分水飞蓟素主要存在于水飞蓟籽壳中[3],籽仁中蛋白质含量较高,氨基酸种类齐全,而有关水飞蓟蛋白的研究报道较少,作者前期研究发现以水飞蓟蛋白为原料制得的酶解物具有较强的抗氧化活性[4-5],但蛋白酶解物是一个比较复杂的混和物,其中存在着分子质量大小不同的多种物质,研究表明多肽的分子质量大小与其抗氧化活性密切相关[6],作者的前期研究也发现,水飞蓟多肽分子质量的大小会影响其抗氧化活性,其中以分子质量<1 ku的寡肽清除自由基的活性最强。因此,本试验以分子质量<1 ku的水飞蓟寡肽为原料,研究其对·OH所致的小鼠肝线粒体氧化损伤的保护作用,以期为水飞蓟蛋白资源的开发利用提供理论基础和依据。
1 材料与方法
1.1 材料和试剂
水飞蓟寡肽(SMO):按照文献[5]方法制得蛋白酶解物,再用截留分子质量为10、3、1 ku的超滤膜进行分级制备,将透过1 ku超滤膜的酶解液浓缩后冷冻干燥即得<1 ku的水飞蓟寡肽。
昆明种小鼠,8周龄,体重(25±2)g:江苏大学实验动物中心。
罗丹明123(Rhodamine123):碧云天生物技术研究所;Na+-K+-ATPase试剂盒、Ca2+-Mg2+-ATPase试剂盒、琥珀酸脱氢酶(SDH)试剂盒:南京建成生物工程研究所;DPH(1,6-Diphenylhexa-1,3,5-triene):Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
超滤系统:美国Millipore仪器公司;ALPHAI-4/2-4型冷冻干燥机:德国 CHRIST公司;Agilent 1100液相色谱:美国安捷伦公司;Multiskan GO全波长酶标仪:美国Thermo公司;CARY ECLIPSE荧光分光光度计:美国VARIAN公司。
1.3 方法
1.3.1 小鼠肝细胞线粒体的提取
参照 Bao等[7]的方法制备小鼠肝细胞线粒体悬液,用考马斯亮蓝法测定悬液中的蛋白质含量,-20℃保存待用。
1.3.2 试验动物分组
试验分为空白组、模型对照组、各浓度水飞蓟寡肽(SMO)组。每组做6个平行。
1.3.3 肝细胞线粒体肿胀度的测定
[8]并略作修改。3.0 mL反应液中含有1.0 mg线粒体蛋白质,各加入不同浓度水飞蓟寡肽,以 1 mL FeSO4(15μmol/L)和 0.8 mL Vc(0.375 mmol/L)溶液诱导线粒体肿胀,37℃恒温水浴缓慢振荡,不同时间取出测A520nm。线粒体膜受氧化损伤而发生肿胀,吸光值会下降。
1.3.4 肝细胞线粒体丙二醛(MDA)含量的测定[9]
取1 mL蛋白质量分数为0.5%的肝线粒体悬液,加入不同浓度的寡肽,再加入6 mmol/L FeSO4100μL,最后加50μmol/L Vc 50μL。在37℃下,水浴1 h,加入15%TCA 1 mL结束反应,再加入0.67%TBA 1 mL,于沸水浴中显色15 min,冷却后离心,测A532nm,以吸光度表示MDA含量多少,吸光值越大,MDA含量越高。

式中:A1为模型对照组的吸光度;A2为样品组的吸光度。
1.3.5 肝细胞线粒体ATPase和SDH活性的测定
配制蛋白质量分数为0.1%的肝线粒体悬液,分别加入不同浓度的寡肽,100 mmol/L FeSO4和 50 μmol/L VC诱导线粒体氧化损伤,各组在37℃下水浴30 min,加入1 mmol/L EDTA终止反应,具体测定按试剂盒说明书的操作步骤进行。
1.3.6 肝细胞线粒体膜电位(ΔΨm)的测定
参考文献[10]并略作修改。将肝线粒体悬液于8 800 r/min离心10 min,弃上清,沉淀用已加入Rh123(30 nmol/L)的膜电位测试液(pH7.2,225 mmo1/L甘 露 醇,70 mmol/L蔗 糖,5 mmo1/L HEPES)重悬,调整其蛋白质含量至 0.5 mg/mL。取线粒体悬液3 mL,加入0.2 mL不同浓度的寡肽,空白组和模型对照组加等体积的去离子水。混匀后在37℃孵育3 min,然后加入终浓度30μmol/L的 FeSO4和终浓度500μmol/L的VC,混匀后37℃避光孵育20 min,然后离心去除未吸收的Rh123。加入膜电位测试液重悬均匀后,测定线粒体悬液的荧光强度(激发波长505 nm,发射波长534 nm),以荧光强度值反映线粒体膜电位(ΔΨm)的变化。
1.3.7 肝细胞线粒体膜流动性的测定[11]
总体积3 mL反应液中含线粒体蛋白0.5 mg和不同浓度寡肽,加入3 mmol/L FeSO4和50 mmol/LVC启动反应,37℃反应30min,加入1mmol/L EDTA终止反应,加入 20 umol/L的 DPH 50μL,37℃反应40 min,离心,用磷酸缓冲液洗1次,再用相同体积缓冲液重悬。以激发波长361 nm,发射波长431 nm测荧光强度 Ivv、Ivh、Ihv、Ihh,其中 v表示偏振光为垂直方向,h为水平方向,前脚注是发射光,后脚注是激发光。按下式计算,式中G=Ihv/Ihh:

1.3.8 水飞蓟寡肽的氨基酸组成分析
采用酸水解法[12]。
1.4 数据处理
采用平均值±标准差表示。采用SPSS 17.0数据分析软件进行统计分析,P<0.05代表差异显著。
2 结果与分析
2.1 水飞蓟寡肽对肝线粒体肿胀度的影响
Fe2+-VC体系可发生Fenton反应产生·OH,·OH可与线粒体膜上多不饱和脂肪酸发生过氧化损伤反应。脂质过氧化作用是一种连锁反应,它可以连续产生自由基,而自由基又可进一步推动过氧化反应,这种链式反应放大了活性氧的作用,改变了膜的流动性和通透性,进而加剧了线粒体的肿胀,而线粒体的肿胀会引起外膜破裂,从而使线粒体体积增大,光密度下降,所以通过测定吸光度值的变化可以反映线粒体的肿胀程度。水飞蓟寡肽对线粒体肿胀度的影响见图1。
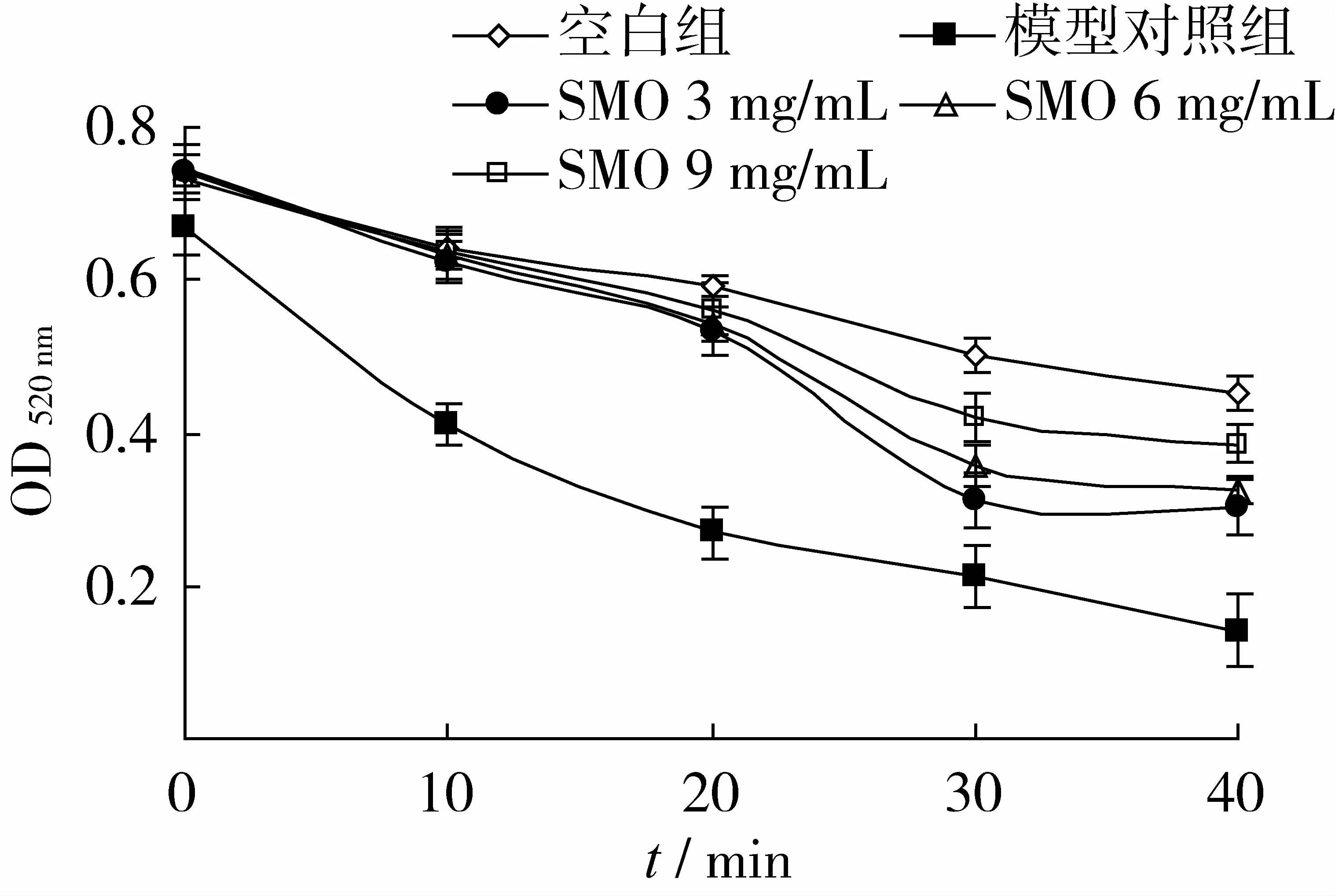
图1 水飞蓟寡肽对小鼠肝线粒体肿胀的影响
由图1可见,随着时间的延长,各组A520nm均有下降,模型对照组下降的幅度最大,说明·OH诱导加速了线粒体的氧化损伤,使其肿胀加重。在考察的时间范围内,水飞蓟寡肽对线粒体氧应激肿胀具有明显的干预作用,且具有量效关系。表明水飞蓟寡肽可通过清除·OH而减轻其对线粒体的氧化损伤,使损伤程度降低,肿胀减轻。
2.2 水飞蓟寡肽对肝线粒体脂质过氧化的影响
丙二醛(MDA)是自由基对不饱和脂肪酸引发的脂质过氧化作用的产物,其可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm处有最大吸收峰,所以通过测定532 nm处的吸光度可以反映MDA的相对含量,并间接地反映出机体氧化损伤程度的高低。水飞蓟寡肽对MDA生成的影响见表1。

表1 水飞蓟寡肽对小鼠肝线粒体MDA的影响(n=6,¯x±SD)
由表1可见,模型对照组小鼠肝线粒体MDA含量较空白组明显升高,差异显著(P<0.01),水飞蓟寡肽组均较模型组有明显降低(P<0.01),表明Fe2+-VC体系激发的活性氧通过攻击线粒体膜中的多不饱和脂肪酸,产生了大量的脂质过氧化反应产物MDA,通过添加水飞蓟寡肽,能够显著抑制MDA的产生,减轻线粒体膜氧化损伤的程度。另外,多肽对MDA生成的抑制作用还具有明显的剂量-效应关系,9 mg/mL寡肽对MDA生成的抑制率达到了43.07%,略优于油菜花粉酶解物[13]。
2.3 水飞蓟寡肽对肝线粒体Na+-K+-ATPase、Ca2+-Mg2+-ATPase和SDH的影响
细胞膜上的Na+-K+-ATPase和Ca2+-Mg2+-ATPase可以维持细胞内Na+、Ca2+等内环境的稳定,维持细胞内外的渗透压平衡和跨膜电化学梯度,在细胞的物质转运和能量代谢等方面起重要作用。当Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性降低时,会导致细胞内能量生成和离子转运障碍,从而破坏膜电位,引起线粒体损伤[14]。琥珀酸脱氢酶(SDH)是参与三羧酸循环的关键酶,是连接氧化磷酸化与电子传递的枢纽之一,可以为线粒体呼吸链提供电子,是线粒体的标志酶,其活性对于评价线粒体功能具有重要意义[15]。水飞蓟寡肽对小鼠肝线粒体 Na+-K+-ATPase、Ca2+-Mg2+-ATPase和 SDH的影响见表2。

表2 水飞蓟寡肽对小鼠肝线粒体ATPase和SDH活性的影响(n=6,¯x±SD)
氧化应激引发的脂质过氧化反应可使膜上的磷脂发生交联,使膜上的脂质分子排列的有序性及分子运动改变,从而引发膜的流动性下降,导致膜酶活性下降。由表2可以看出,模型对照组小鼠的Na+-K+-ATPase、Ca2+-Mg2+-ATPase和 SDH活性与空白组相比显著下降(P<0.01),水飞蓟寡肽可显著提高 Na+-K+-ATPase、Ca2+-Mg2+-ATPase和SDH活性,且呈剂量效应关系。水飞蓟寡肽能有效抑制氧化应激所致的3种酶的活性下降,说明其具有维持线粒体结构完整性和保护线粒体的功能。
2.4 水飞蓟寡肽对肝线粒体膜电位的影响
罗丹明123(Rh123)是一种脂溶性的、阳离子荧光探针,容易被有活性的线粒体摄取,能选择性地被带负电荷的线粒体膜所吸收而发出绿色荧光,当线粒体跨膜电位下降时,线粒体膜的转运能力下降,电负性降低,线粒体积聚Rh123的能力也下降,荧光强度降低。所以可用Rh123作为线粒体跨膜电位的指示剂,用荧光分光光度计测定 ΔΨm的变化[16]。水飞蓟寡肽对肝线粒体膜电位的影响见图2。

图2 水飞蓟寡肽对小鼠肝线粒体膜电位(ΔΨm)的影响
由图2可知,模型对照组线粒体膜电位较空白组明显下降,差异显著(P<0.01),说明 Fe2+-VC作用于线粒体,引起了线粒体跨膜电位的显著降低;水飞蓟寡肽组与模型对照组相比,膜电位有显著的提高,中剂量组和高剂量组的效果相近。表明水飞蓟寡肽能减缓氧化损伤引起的线粒体膜电位的下降,具有保护线粒体、减轻氧化应激损伤的作用。
2.5 水飞蓟寡肽对肝线粒体膜流动性的影响
细胞膜的流动性通常是指细胞膜上膜脂质的运动特性。适宜的膜流动性是维持细胞膜正常功能的必要条件,它与细胞的信息传递、物质和能量交换等功能具有密切的关系。因此,膜流动性是反映细胞功能状态的一项重要而敏感的指标。研究表明,细胞膜流动性的降低与许多疾病的发生和发展有关,如肝硬化、冠心病、肾脏疾病等[17]。水飞蓟寡肽对肝线粒体膜流动性的影响见表3。

表3 水飞蓟寡肽对小鼠肝线粒体膜流动性的影响(n=6,¯x±SD)
荧光偏振度(P)和微黏度(η)是膜流动性大小的指标,P和η越大,膜的流动性越小。由表3可见,空白组的 P为0.22,η为2.04,模型对照组 P为0.33,η为5.01,与空白组相比有显著升高(P<0.01),由此可知,·OH可使线粒体膜氧化损伤而导致膜的流动性降低。而水飞蓟寡肽可显著提高线粒体膜的流动性(P<0.01),表明水飞蓟寡肽能够抑制·OH的产生,从而减轻肝线粒体的氧化应激损伤,起到保护线粒体的作用。
2.6 水飞蓟寡肽的氨基酸组成分析
样品前处理采用酸水解法,因此色氨酸的含量未进行检测,其他氨基酸的含量测定结果见表4。

表4 水飞蓟寡肽中氨基酸的组成与含量/g/100 g肽
由表4可知,水飞蓟寡肽中氨基酸含量丰富,种类齐全,其中支链氨基酸质量分数达16.96%,支链氨基酸不仅是合成机体蛋白质的基本原料,还具有多种重要的生物功能,可影响蛋白质的合成和分解代谢、增强机体免疫力,是一种重要的运动营养补剂,近来研究其还具有抗氧化、抗衰老的功能[18]。水飞蓟寡肽中几种主要抗氧化氨基酸(His、Tyr、Met、Cys)质量分数达11.72%,它们是水飞蓟寡肽具有抗氧化活性的重要物质基础。
3 结论
水飞蓟寡肽可显著抑制氧化应激诱导的小鼠肝线粒体肿胀和MDA的生成,提高由氧化应激引起的Na+-K+-ATPase、Ca2+-Mg2+-ATPase和 SDH活性的降低,对线粒体膜电位和膜流动性的降低也有显著的抑制作用,表明其具有保护线粒体氧化损伤的功能。水飞蓟寡肽中富含酸性氨基酸Glu和Asp,支链氨基酸和抗氧化氨基酸的含量较高,是其具有抗氧化活性的重要物质基础。
参考文献
[1]Urista C M,Fernandez R A,Rodriguez F R,et al.Review:Production and functionality of active peptides from milk[J].Food Science and Technology International,2011,17(4):293-317
[2]Sun Y Y,Pan D D,Guo Y X,et al.Purification of chicken breast protein hydrolysate and analysis of its antioxidantactivity[J].Food and Chemical Toxicology,2012,50:3397-3404
[3]袁丹,张国峰,王瑞杰.水飞蓟果实、果皮及其提取物质量评价法的研究[J].沈阳药科大学学报,2003,20(2):120-123
[4]朱淑云,董英,陈晓东,等.水飞蓟粕蛋白氨基酸组成及加工功能特性研究[J].中国粮油学报,2011,26(8):71-74
[5]朱淑云,董英,张海晖,等.水飞蓟粕蛋白的酶解及其酶解物抗氧化活性研究[J].中国粮油学报,2011,26(2):68-72
[6]Liu JH,Huang Y S,Tian Y G,et al.Purification and identification of novel antioxidative peptide released from Blackbone silky fowl(Gallus gallus domesticus Brisson)[J].European Food Research and Technology,2013,237(2):253-263
[7]Bao L,Abe K,Tsang P,et al.Bilberry extract protect restraint stress-induced liver damage through attenuatingmitochondrial dysfunction[J].Fitoterapia,2010,81:1094-1101
[8]路雪雅.抗坏血酸和硫酸亚铁诱导鼠肝线粒体损伤的实验研究[J].生物化学与生物物理进展,1989,16(5):372-374
[9]Ohkawa H,Ohishi N,Yagi K.Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J].Analytical Biochemistry,1979,95(2):351-358
[10]郭红英.麦胚蛋白酶解物的制备及其抗氧化功能研究[D].镇江:江苏大学,2009
[11]王建华,张民,甘璐,等.枸杞多糖-2的抗羟基自由基氧化作用[J].食品科学,2001,22(1):11-13
[12]Zhu K X,Zhou H M,Qian H F.Proteins extracted from defatted wheat germ:nutritional and structural properties[J].Cereal Chemistry,2006,83(1):69-75
[13]胡筱波,陈建国,刘志伟,等.油菜花粉酶解物的体外抗氧化活性研究[J].中国粮油学报,2008,23(3):120-123
[14]Acharya M M,Katyare SS.Structural and functional alterations inmitochondrialmembrane in picrotoxin-induced epileptic rat brain[J].Experimental Neurology,2005,192:79-88
[15]赵云涛,陈绍红,廖艳,等.迷迭香酸对羟自由基所致小鼠肝线粒体损伤的保护作用[J].氨基酸和生物资源,2008,30(4):26-28
[16]Emaus R K,Grunwald R,Lemasters JJ.Rhodamine123 as a probe of transmembrane potential in isolated rat-livermitochondria:spectral and metabolic properties[J].Biochimica et Biophysica Acta,1986,850(3):436-448
[17]Cormier A,Morin C,Zini R.Nicotine protects rat brain mitochondria againstexperimental injuries[J].Neuropharmacology,2003,44:642-652
[18]Antona G D,RagniM,Cardile A,et al.Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletalmusclemitochondrial biogenesis inmiddle-agedmice[J].CellMetabolism,2010,12:362-372.
Protective Effect of Silybum marianum Oligopeptides on Mice Liver Mitochondrial Damage
Zhu Shuyun Sha Sha Qin Yunyun Dong Ying
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013)
To study the protective effect of Silybum marianum oligopeptides(SMO)on themice livermitochondria damage by hydroxyl radicals(·OH).The swelling degree,the contentofmalondialdehyde(MDA),the activities of Succinate dehydrogenase(SDH)and ATPase,membrane potential and membrane fluidity ofmice livermitochondria were measured.The protective effect of Silibum marianum oligopeptides on oxidative damage in vitro is caused by OH.The results indicated that,SMO could inhibit the swelling of livermitochondria and reduce the MDA content in mice.It also could improve the activities of SDH and ATPase,and maintain livermitochondriamembrane potential and membrane fluidity.Within the test dose range,the high dose group of SMO had the best effect.This study proved that SMO had the effects of inhibiting themice livermitochondria injury induced by·OH.Themechanism may be related to free radical scavenging and the inhibition of lipid peroxidation.
Silibum marianum oligopeptides,mitochondria,hydroxyl radical,anti-oxidation
TS201
A
1003-0174(2015)01-0097-05
江苏省镇江市农业科技支撑(NY2012031)
2013-10-29
朱淑云,女,1975年出生,副教授,食品科学与工程
董英,女,1954年出生,教授,食品生物技术、农产品深加工与综合利用
