正压面罩产品技术审评要求分析
2015-12-16孙志刚
孙志刚 杨 亮
(广东省食品药品监督管理局 审评认证中心,广州510080)
正压面罩为无创正压通气治疗机的患者界面连接装置,适用于慢性呼吸功能不全、改善通气和睡眠治疗等无创通气支持,包括压力恒定式单水平持续正压通气(CPAP)、压力可自动调节式单水平持续正压通气(Auto-CPAP)、双水平持续正压通气(Bi-PAP)。本产品也可与其它医疗器械结合适用,本身比较成熟、技术并不复杂,风险也不高。但在国家食品药品监督管理总局实施新版《医疗器械注册管理办法》[1]和新的医疗器械注册申报资料要求[2],行业标准 YY0671.2-2011[3]对某些技术指标未完全涵盖、明晰的情况下,笔者结合目前已有的注册技术审评经验、临床使用要求和企业研发生产经验,对正压面罩的技术要求、风险分析、临床要求和常见不良事件等方面进行分析、讨论和总结,旨在对该产品有兴趣的读者提供参考信息。
1 预期用途
本产品为无创通气治疗机和其它辅助治疗设备的患者连接口,在本产品和呼吸管路之间可连接其它附件,主要用于上述慢性呼吸功能不全、改善通气和睡眠治疗等无创通气支持[4],可同时提供其它辅助治疗或监控的接口,如湿化、雾化、氧供等[5]。
本产品适用于鼾症、睡眠呼吸暂停低通气综合征、睡眠呼吸暂停合并慢阻肺(COPD)、各种系统疾病导致的轻中度慢性或急性呼吸衰竭患者的治疗,适用于有自主呼吸的患者,不可用于生命支持。本产品可用于医疗机构和患者在家庭适用,虽然风险较低,但无创通气本身来讲,也有禁忌症和慎用情况[5,6]。按不同角度,本产品有多种分类。如:按使用类型,可分为多患者重复使用、单一患者重复使用、一次性使用;按适用人群,可分为成人、儿童、幼儿面罩;按是否无菌,可分为以无菌形式提供的产品和用前清洗的非无菌产品;按适用机型,可分为单管路正压通气治疗机面罩(鼻罩、含防窒息阀的口罩和口鼻罩),和具有主动呼气阀、安全活瓣系统、警报装置的双回路医用呼吸机面罩(不含防窒息阀和排气口的口罩和口鼻罩)。
2 结构组成
本产品可由面罩罩体、固定头带、管路、气路接口、排气口、防窒息阀等组成,可以分为:鼻罩、口罩和口鼻罩(又名全(脸)面罩)。
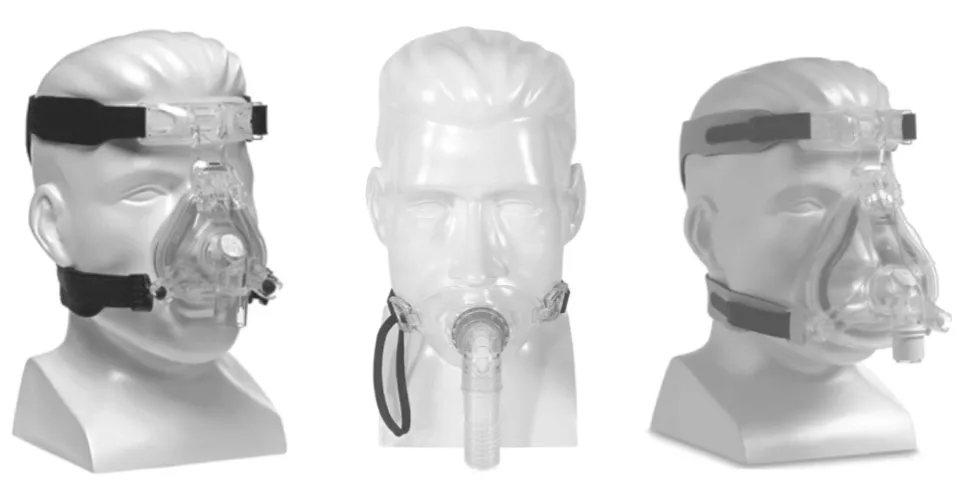
图1 鼻罩、口罩和口鼻罩示例
3 作用机理
正压面罩通过呼吸管路连接正压通气呼吸机,罩体固定于使用者鼻部,口部或面部,使正压气流经鼻和/或口输入气道,以此作为使用者接受治疗压力的接口。
4 主要技术性能要求
产品性能参数可根据产品自身的技术特点制定要求,但不得低于强制性国家标准、行业标准的要求。
4.1 外观
各组成部件齐全,表面无脏污、变形、损伤。面罩上的印字清晰,包装封口处牢固,无任何位置开裂。
4.2 面罩接头
圆锥接头:满足 YY 1040.1或 YY 1040.2的15mm或22mm的外锥(或内锥)接头。在YY0671.2中要求仅为外锥接头,但在面罩实际应用过程中,可能会与其它附件连接;如果是内锥接头,也可以通过相应的转换接头连接。比如,彭渤、王东等[7]医疗专家倾向于使用平台呼气阀,而非面罩自带的排气孔,而这种平台呼气阀为外锥接头,需要与面罩的内锥接头连接。所以,面罩接头外锥和内锥皆可。
非圆锥接头:满足与管路或附件连接的功能测试要求。YY0671.2标准未作详细规定,补充有“通过对随机文件的检查来检验其符合性。”然而,根据其对应国际标准ISO17510-2:2007 ,认为可进行功能测试来检验符合性。笔者也认为这个更具有操作性,要求更充分。
4.3 气阻(压力降)
企业自定。参照YY0671.2附录C测试值。
4.4 排出气流
企业自定。参照YY0671.2附录B测试所得曲线。
4.5 防窒息阀压力
仅适用于含防窒息阀的口罩和口鼻罩。企业自定,但防窒息阀开启压力和关闭压力均应小于面罩最小额定压力,以保证正常使用过程中能正常关闭和始终保持关闭状态。
参照YY0671.2附录D进行测试。
4.6 单一故障状态下的呼吸--吸气和呼气阻力
仅适用于含防窒息阀的口罩和口鼻罩。流量为-50L/min或+50L/min时,气阻不应超过10 hPa(10cm H2O)/(L/s)。检测时需要注意,压力计读数不要超过8.3cmH2O(10hPa(10cm H2O)/(L/s)*50L/min=8.3cmH2O)。
参照YY0671.2附录E进行测试。
4.7 CO2重复呼吸
正常状态,在最小额定压力、5hPa(5cmH2O)和10hPa(10cmH2O),CO2相对浓度增加不超过20%;单一故障状态,CO2相对浓度增加不超过60%。
对于含防窒息阀的口罩和口鼻罩,正常状态和单一故障状态均需要测试;
对于鼻罩,仅需测试正常状态;根据钟南山、张秀华等[9]的译著《睡眠医学理论与实践》,在单一故障状态下,病人会觉醒,然后用口呼吸。且临床经验证明鼻罩是正压面罩中最安全的类型;
对于不含防窒息阀的口罩和口鼻罩,正常状态和单一故障状态均不作要求;因为CO2重复呼吸是因单管路正压通气设备产生的[10],此类型面罩仅使用于具有主动呼气阀、安全活瓣系统、警报装置的双回路医用呼吸机面罩。
参照YY0671.2附录F进行测试。
4.8 振动和噪声
1m处A计权声压水平不超过50dB(A)。参考《医用雾化器产品注册技术审查指导原则》[16]和《声环境质量标准》[11]中对居住环境的噪声要求,设定此要求。YY0671.1鼓励生产商将产品使用过程中的噪音控制在30dB(A)以下。
参照YY0671.2附录G进行测试。检测时需要注意密封面罩的患者端,使气流从排气口排出。
4.9 死腔容量(如适用)
测量同型号面罩各规格空间相对大小(mL)。
4.10 呼吸系统过滤(如有)
应遵循 YY/T 0753.1-2009和 YY/T 0753.2-2009要求。
4.11 与其他医疗器械联用时的性能变化(如有)
可检测气阻(压力降)、排出气流、振动和噪声等性能是否有变化。
4.12 微生物试验(若适用)
应按照 GB 15979-2002或 GB 15980-1995要求,a)细菌菌落总数≤20cfu/g;b)大肠菌群、致病性化脓菌不得检出;c)真菌菌落总数:不得检出。
4.13 无菌(若适用)
按照GB/T14233.2规定方法进行,应无菌。
4.14 环氧乙烷残留(若适用)
按照GB/T14233.1规定方法进行,每只面罩的环氧乙烷残留量应不大于10μg/g。
4.15 化学性能(如适用)
根据材料特性和生产工艺,企业自定。按照GBT 14233.1规定方法进行,还原物质、金属离子、酸碱度应符合要求。
4.16 生物性能
见注册资料《5.2生物相容性评价研究》。对与使用者接触部分材料,应按照GB/T 16886.1-2011的要求,进行至少如下评价:细胞毒性、皮肤刺激、迟发型超敏反应。
(1)对于用于插入鼻腔的鼻罩附件或用于插入口腔的面罩的部分,鼻腔插入部分或面罩插入部分的表面材料应按粘膜接触进行评价(30天以内一次、多次或长期使用或接触的按长期接触(B),30天以上的按持久接触(C));
(2)对预期接触使用者头部的材料,包括头带,应按皮肤接触进行评价;
(3)对于具有多种接触性质材料(如接触气路、皮肤、粘膜中的两者或三者),应按最高接触性质评价。
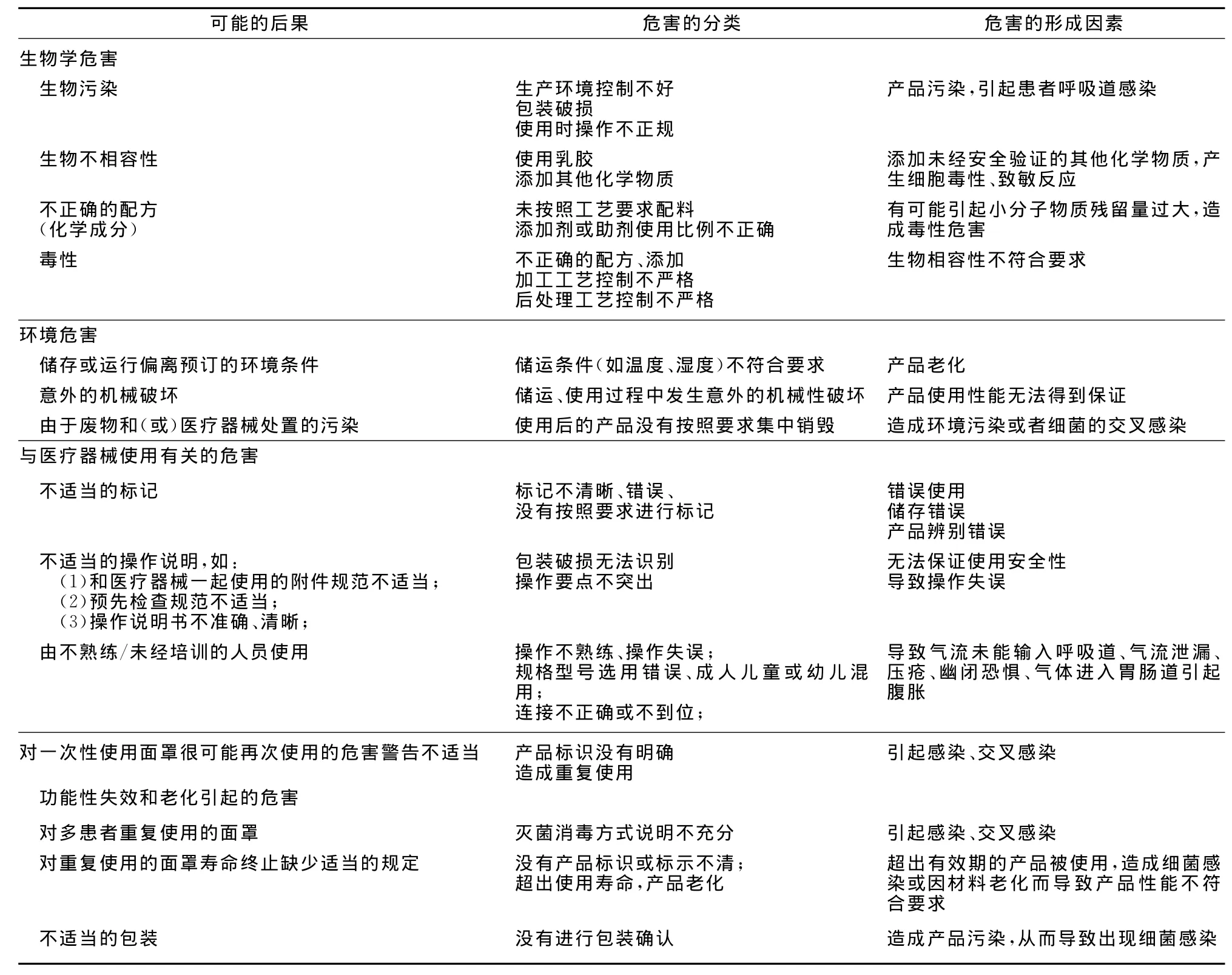
表1 产品主要危害
4.17 消毒和灭菌(如有)
适用于无菌产品和重复使用产品。
见注册资料《4.4包装说明》、《5.4灭菌和消毒工艺研究》、《5.5有效期和包装研究》。
5 产品的风险管理
根据YY/T 0316-2008《医疗器械风险管理对医疗器械的应用》附录D对该产品已知或可预见的风险进行判定,面罩产品在进行风险分析时至少应包括以下的主要危害,企业还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。
6 临床要求
根据国家食品药品监督管理总局《关于发布免于进行临床试验的第二类医疗器械目录的通告》[14],本产品中的呼吸暂停治疗用面罩免于临床试验。申请人应提交申报产品的相关信息与《目录》所述内容的对比说明。当二者的差异性对产品的安全有效性不产生影响时,即认为二者具有等同性。
当二者的差异性对产品的安全有效性产生其它影响时,应按照《医疗器械临床评价技术指导原则》[15]通过同品种临床数据或临床试验进行临床评价。
7 常见不良事件

图2 正压面罩不良事件报告类型分布图
通过美国FDA公布的MAUDE数据库为检索依据,采用“MASK”为产品检索关键词,以“BZD”为产品分类代码,检索2005/01/01至2014/12/31正压面罩发生的可疑不良事件报告。本次检索共检索到98条不良事件报告数据(按照研究相关性,剔除13个非正常使用的记录、4个原因不明、9个原因无关的投诉、6个跟进记录),本研究共纳入66条有效不良事件报告数据。
分析显示,可疑不良事件中过敏发炎最多为16例(占24.2%)、其次为零部件断裂共15例(占22.7%)、划伤12例(占18.2%)、影响骨质生长(含牙齿、鼻骨)9例(占13.6%)和眼角处气体泄漏8例(占12.1%),其余还有4种不良事件比例占9.1%,分别为:面部痕印或压疮、头带有摩擦感、防窒息阀不能打开、潮湿海绵滋生细菌,见表2、图2所示。

表2 正压面罩不良事件报告检索统计N(%)
8 讨论
8.1 儿童或幼儿用正压面罩测试
由于儿童或幼儿的呼吸功能、身体发育和承受力与成人有不同,在以后临床应用、产品测试经验成熟的情况下,可能需要对某些测试要求或试验设置参数进行调整,比如单一故障期间的呼吸阻力、CO2重复呼吸试验中的潮气量、吸呼比参数等。例如,YY0600.4-2013[12]、YY0600.5-2011[13]标准中对适用不同体重患者的人工复苏器、气动急救复苏器有不同的试验参数设置或判定要求。
8.2 生物相容性评价
对于不插入口腔或鼻腔的气路部件或气路材料,YY0671.2要求为“应按不与组织接触评价”,生产商会不清楚应该以何种方式评价气路材料。
国内目前对气路材料一般未进行生物学评价,某些材料只会进行细胞毒性、皮肤刺激、迟发型超敏反应生物学评价。
据ISO 17510-2:2007原文,应按照与组织外部接触进行评价,则除上述细胞毒性、皮肤刺激、迟发型超敏反应三种评价外,还需要进行全身毒性、亚慢性毒性、遗传毒性、植入四种评价;目前国内无需要提高到这种高水平的相关不良反应或不良事件报告发生,此要求则偏高。
9 结论
本文所列正压面罩技术审评要求中所适用的项目,企业在进行产品设计时应列入产品设计输入,在后续的设计输出、验证、确认阶段应按该要求规范相关资料,如此整理提交的注册申报资料有助于提高技术审评的效率,加快注册进程。
[1] 国家食品药品监督管理总局.医疗器械注册管理办法[M].国家食品药品监督管理总局令第4号,2014.
[2] 国家食品药品监督管理总局.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告[M].国家食品药品监督管理总局公告2014年第43号,2014.
[3] 国家食品药品监督管理总局.YY0671.2-2011睡眠呼吸暂停治疗第2部分:面罩和应用附件[M].2011.
[4] 国家食品药品监督管理总局.医疗器械分类目录[M].2015.
[5] 中华人民共和国卫生部.WS 392-2012呼吸机临床应用[M].2012.
[6] 中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[7] 彭渤,高和,王东,等.无创正压通气治疗时不同呼气阀对二氧化碳重复呼吸的影响[J].中华结核和呼吸杂志,2005,28(12):875-876.
[8] ISO.ISO17510-2:2007Sleep apnoea breathing therapy Part 2:Masks and application accessories[M].2007.
[9] 钟南山,张秀华,韩芳,等.睡眠医学理论与实践[M].北京:人民卫生出版社,,2010.
[10] ISO.ISO17510-1:2007Sleep apnoea breathing therapy Part 1:Sleep apnoea breathing therapy equipment[M].2007.
[11] 环境保护部,国家质量监督检验检疫总局.GB 3096-2008声环境质量标准[M].2008.
[12] 国家食品药品监督管理总局.YY0600.4-2013医用呼吸机基本安全和主要性能专用要求第4部分人工复苏器[M].2013.
[13] 国家食品药品监督管理总局.YY0600.5-2011医用呼吸机基本安全和主要性能专用要求第5部分气动急救复苏器[M].2011.
[14] 国家食品药品监督管理总局.关于发布免于进行临床试验的第二类医疗器械目录的通告[M].国家食品药品监督管理总局通告2014年第12号,2014.
[15] 国家食品药品监督管理总局.医疗器械临床评价技术指导原则[M].2015.
[16] 国家食品药品监督管理局.医用雾化器产品注册技术审查指导原则[M].2014.