糖基化终末产物对人牙周膜干细胞骨向分化过程中的Wnt经典信号通路研究
2015-12-16伍燕邓超杨琨崔晓霞刘琪金岩
伍燕 邓超 杨琨 崔晓霞 刘琪 金岩
1.遵义医学院附属口腔医院,遵义 563003;2.贵阳市口腔医院牙周科,贵阳 550002;3.第四军医大学组织工程中心,西安 710032
糖基化终末产物(advanced glycation end products,AGEs)与糖尿病多种并发症的发生密切相关[1]。近年来,有研究[2]表明糖尿病患者晚期AGEs的大量积聚可促进糖尿病的发展,并且可诱导牙周病的发生和发展。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)具有自我更新和多向分化潜能,在维持牙周结构稳态方面起着重要的作用,其功能数量的变化会导致牙周膜的破坏[3]。研究[4]表明AGEs能使hPDLSCs增殖过程中的Wnt经典通路受到抑制,最终导致该细胞增殖能力有所减弱,AGEs又可以抑制该细胞的成骨分化能力,并在一定范围内呈浓度依赖性[5]。但AGEs是否影响了hPDLSCs骨向分化过程中的Wnt经典信号通路,目前尚无定论,故本实验旨在研究AGEs介导下的hPDLSCs骨向分化过程中的Wnt经典通路,并与正常细胞进行比较,从而探讨糖尿病牙周炎的发病机制。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养基、胰蛋白酶(Gibco公司,美国),胶原酶、胎牛血清(杭州四季青生物工程材料有限公司),AGEs-BSA(Bio Vision公司,美国),细胞总RNA提取试剂盒、一步法逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RTPCR)试剂盒(Takara公司,日本),茜素红(上海化学试剂采购供应站),β-链蛋白(β-catenin)兔抗人单克隆抗体(Abcam公司,美国),体式显微镜、倒置相差显微镜以及照相系统(Olympus公司,日本),流式细胞仪(Beckmen Coulter公司,美国),实时聚合酶链反应(real time polymerase chain reaction,real time PCR)仪器(Applied biosystems公司,美国)。
1.2 取材和细胞培养
收集12~18岁因正畸需要而拔除的牙周健康、无龋坏的年轻前磨牙,PBS冲洗后刮取根中1/3牙周膜组织,移入无菌培养皿内,加入少许α-MEN培养液,将牙周膜组织锐性分离,离心后弃上清,加入胶原酶至37 ℃、CO2孵箱中消化15 min,加入正常培养液终止其消化作用,离心后取上清,将分离的组织块均匀平铺于6孔板中,以无菌盖玻片覆盖组织块,加入含10%胎牛血清的α-MEM培养液,置37 ℃、5%CO2孵箱中培养,待组织块周围有细胞爬出时去除盖玻片,每3 d换液,待细胞生长达80%时进行传代。
1.3 有限稀释法克隆化培养纯化hPDLSCs
参照以往文献报道采用有限稀释法对hPDLSCs进行克隆分离。首先获取第一代牙周膜细胞,将第一代牙周膜细胞悬液有限稀释至密度为每毫升10个,用加样器向96孔培养板每孔内加0.15 mL,使每孔细胞悬液中约1个细胞,经过37 ℃、5%CO2培养箱中培养,细胞贴壁后在倒置显微镜下检查,挑选含单细胞孔,做标记并补加0.1 mL培养基,待孔中细胞增至占孔底面积l/3~l/2时,常规培养传代。
1.4 hPDLSCs初步鉴定
取克隆纯化的hPDLSCs,弃培养液,PBS洗2次,胰蛋白酶消化3 min,α-MEM培养基终止,800 r·min-1离心5 min,弃上清;再以含3%胎牛血清的PBS重悬细胞,使细胞密度达到每升3.0×109个,分装到Eppendof管中,每管200 μL的细胞悬液,室温下每个管加入2 μL的STRO-1、CD14、CD105、CD29小鼠抗人单克隆抗体,避光4 ℃冰箱孵育1 h;再用含3%胎牛血清的PBS清洗3次,1 000 r·min-1离心5 min,最后再以含3%胎牛血清的PBS重悬。使用同型对照单克隆抗体确定背景标记,用流式细胞仪分析荧光细胞,专用的配套软件计算细胞表面抗原阳性表达率,单位用百分比表示。
1.5 分组成骨诱导后碱性磷酸酶(alkaline phosphatase,ALP)和茜素红染色
实验分为正常hPDLSCs组(N-hPDLSCs组)和AGEs刺激的正常hPDLSCs组(A-hPDLSCs组)。N-hPDLSCs组用含10%血清的正常α-MEM培养基培养;A-hPDLSCs组加入含10 μg·mL-1AGEs,10%血清的α-MEM培养基培养。分别取第3代克隆形成细胞以每毫升5×104个的密度接种于6孔板中,待细胞增殖到70%时,按以上分组加成骨诱导液(10 mmol·L-1β-甘油磷酸钠、10-8mol·L-1地塞米松、50 μg·mL-1维生素C)分别诱导7 d和21 d,每3 d换液一次;对照组细胞不加诱导液,常规培养,7 d后行ALP染色,21 d后行茜素红染色。
1.6 real time PCR检测
分别取第3代克隆形成细胞以每毫升5×104个的密度接种于小瓶中,待细胞增殖到70%时,分4组:N-hPDLSCs组(用含10%血清的正常α-MEM培养基培养);Os N-hPDLSCs组(用含有成骨诱导液的10%血清的α-MEM培养基培养);A-hPDLSCs组(用含10 μg·mL-1AGEs,10%血清的α-MEM培养基培养);Os A-hPDLSCs组(用含10 μg·mL-1AGEs,且含成骨诱导液的10%血清的α-MEM培养基培养)。每3 d换液一次,7 d后分别提取RNA,RT-PCR检测成骨相关基因骨涎蛋白(bone sialoprotein,BSP)、ALP、runt相关转录因子2(runt related transcription factor 2,Runx-2)及Dickkopf-1蛋白(DKK-1)、β-catenin表达。用细胞总RNA提取试剂盒一步法提取培养细胞总RNA,β-actin为内参照。参照GenBank数据库,采用Primer primer 5.0计算机软件设计引物,由Takara公司(日本)合成,反应条件参考产品说明书,引物序列如下。β-actin上游引物序列:5'-TGGCACCCAGCACAATGAA-3',下游引物序列:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3';Runx-2上游引物序列:5'-CACTGGCGCTGCAACAAGA-3',下游引物序列:5'-CATTCCGGAGCTCAGCAGAATAA-3';ALP上游引物序列:5'-GGACCATTCCCACGTCTTCAC-3',下游引物序列:5'-CCTTGTAGCCAGGCCCATTG-3';BSP上游引物序列:5'-CTGGCACAGGGTATACAGGGTTAG-3',下游引物序列:5'-ACTGGTGCCGTTTATGCCTTG-3';β-catenin上游引物序列:5'-AGGAAGCTTCCAGACACGC-3',下游引物序列:5'-CGCACTGCCATTTTAGCTCC-3';DKK-1上游引物序列:5'-CACTGCATTTGGATAGCTGGTT-3',下游引物序列:5'-GAAGGTCTGTCTTGCCGGATAC-3'。
1.7 Western blot检测
采用Western blot检测各组总蛋白中成骨蛋白BSP、Runx-2的表达及核蛋白中β-catenin的表达,采用细胞核蛋白与细胞浆蛋白抽提试剂盒进行核蛋白提取,蛋白含量测定采用Bradeford蛋白浓度测定试剂盒。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)电泳,转膜,封闭,免疫反应,最后进行化学发光反应,对2组间相关蛋白表达进行分析。
1.8 统计学分析
采用SPSS 17.0软件进行统计分析,两独立样本均数比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 hPDLSCs的分离与培养
本实验采用酶解组织块法培养原代细胞,一般3~10 d组织块周围有细胞爬出(图1),再通过有限稀释法得到正常的hPDLSCs,该细胞形态呈长梭形,胞核聚集在中心,胞体丰满,2周左右可达80%汇合。

图1 原代细胞(左)和第一代牙周膜细胞(右)的形态观察倒置显微镜 × 20Fig 1 Morphology of primary cells (left) and the first generation of periodontal ligament cells (right) inverted microscope × 20
2.2 流式细胞仪对干细胞初步鉴定
采用流式细胞仪对表型分子进行鉴定,表面抗原STRO-1、CD14、CD105、CD29阳性率分别为10.4%、0.6%、96.0%、98.4%。
2.3 分组成骨诱导后ALP和茜素红染色比较
诱导7 d后,进行ALP染色,A-hPDLSCs组明显浅于N-hPDLSCs组(图2)。诱导21 d后,比较2组成骨诱导形成的钙化结节:发现在相同视野下,A-hPDLSCs组形成的钙化结节明显少于N-hPDLSCs组(图3)。
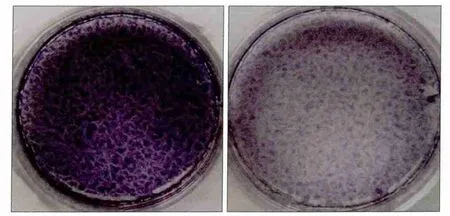
图2 ALP染色结果Fig 2 ALP staining
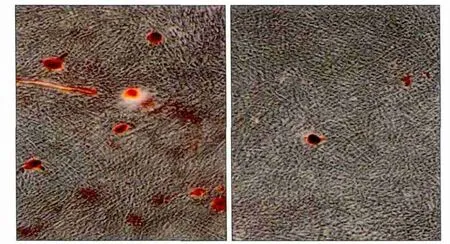
图3 成骨诱导21 d后,钙化结节形成 茜素红染色 × 10Fig 3 After 21 days, the formation of calcified nodules alizarin red staining × 10
定量分析得到,A-hPDLSCs组和N-hPDLSCs组OD值分别为0.145 75±0.036 29、0.538 50±0.033 04,二者间差异有统计学意义(P<0.05)。
2.4 RT-PCR检测成骨相关基因及Wnt经典通路相关基因表达
通过RT-PCR检测诱导7 d后的成骨基因,发现A-hPDLSCs组ALP、BSP、Runx-2基因表达均低于N-hPDLSCs组(P<0.05),差异有统计学意义(图4)。诱导7 d后Wnt经典通路相关基因:N-hPDLSCs组DKK-1明显上调,β-catenin表达下调,而A-hPDLSCs组DKK-1表达低于N-hPDLSCs组,β-catenin表达高于N-PDLSCs组(P<0.05),差异具有统计学意义(图4)。

图4 成骨诱导前后N-hPDLSCs组和A-hPDLSCs组ALP、BSP、Runx-2、DKK-1、β-catenin基因的比较Fig 4 The expression levels of ALP, BSP, Runx-2, β-catenin and DKK-1 between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
2.5 Western blot比较成骨相关蛋白以及细胞核中βcatenin蛋白表达
成骨诱导前后N-hPDLSCs组和A-hPDLSCs组BSP、Runx-2和β-catenin的表达见图5。
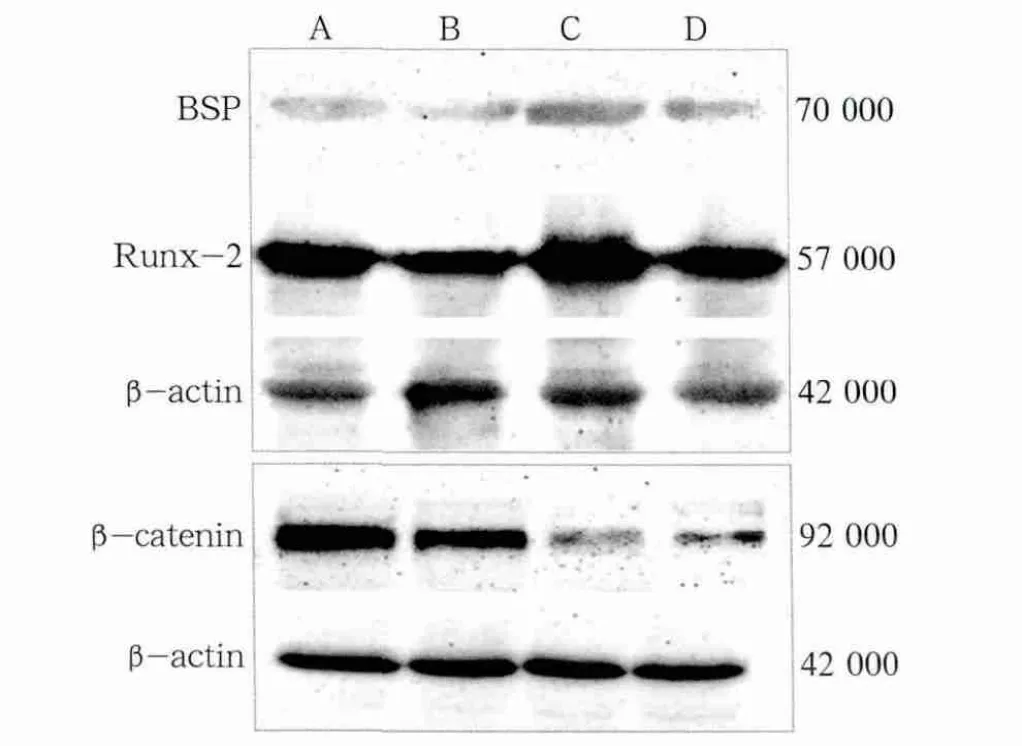
图5 成骨诱导前后N-hPDLSCs组和A-hPDLSCs组BSP、Runx-2和β-catenin的表达Fig 5 Expression of BSP, Runx-2, β-catenin between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
图5结果显示,A-hPDLSCs组骨相关蛋白表达都弱于N-hPDLSCs组,N-hPDLSCs组在成骨诱导后细胞核中的β-catenin表达明显地减弱,成骨诱导后A-hPDLSCs组β-catenin的表达明显高于N-hPDLSCs组。
3 讨论
hPDLSCs是具有自我更新和多向分化潜能,在维持牙周结构稳态方面起着重要的作用,牙周组织再生中最直接、最可靠、最不可缺少的干细胞,具备向其他类型组织细胞分化的潜能,当牙周组织受到损伤后,牙槽骨缺失,hPDLSCs会迁移并且分化为成骨细胞修复牙槽骨的缺损[6]。研究[7-9]显示,在体外成骨诱导培养的条件下,hPDLSCs能分化为成骨样细胞,形成钙化结节,表达一些成骨相关蛋白:骨钙素、骨桥素、胶原等。
对于糖尿病患者,其AGEs是不断积累的,在前期的研究结果中表明AGEs能够在一定浓度上抑制hPDLSCs的成骨分化,并且100 μg·mL-1AGEs刺激该细胞能使该细胞增殖过程中的Wnt经典信号通路受到抑制,为了研究骨分化过程中的信号通路不受到细胞增殖方面的干扰,本实验选择10 μg·mL-1AGEs浓度刺激该细胞,首先确认10 μg·mL-1AGEs对该细胞成骨能力的影响,实验结果显示体外成骨诱导1周后的ALP染色,A-hPDLSCs组的染色明显浅于N-hPDLSCs组,并且在诱导3周后,对细胞进行矿化结节染色,镜下观察可见,矿化结节在同一个视野下,N-hPDLSCs组矿化结节形成较多且很明显,而A-hPDLSCs组形成的结节偏少。最后进行定量分析,得到的结果也是A-hPDLSCs组形成的矿化结节少于N-hPDLSCs组细胞;其次,本实验在成骨诱导7 d后检测成骨基因ALP、Runx-2、BSP结果显示,2组细胞在加了成骨诱导液后,成骨基因表达都有所上升,但A-hPDLSCs组成骨基因表达上调不明显,与N-hPDLSCs组相比较明显偏低,差异有统计学意义。这种趋势与成骨能力表象的比较相一致。故在10 μg·mL-1AGEs刺激下,hPDLSCs成骨的能力下调。
各信号通路之间的相互作用决定着干细胞的命运和组织再生,其中的Wnt经典信号通路研究较成熟,该通路由分泌型的Wnt蛋白与卷轴受体结合而起始,最终导致β-catenin在胞浆中稳定积累并大量进入细胞核内激活淋巴增强因子(lymphoidenchancer factor,LEF)/ T细胞因子(T-cell factor,TCF)转录因子,激活了该通路,启动靶基因转录[10]。故本实验主要检查该通路里细胞核中的β-catenin以确定该信号通路的状态。
Wnt信号通路在不同类型、不同分化阶段中的干细胞作用是不相同的,该信号通路中相关因子的相互作用调控着该条通路的开启和关闭,最终以达到调节干细胞中相关的基因,从而调控细胞的形态及决定其分化的能力。有研究发现Wnt经典信号通路的激活可以促进成骨:LRP5(是Wnt经典通路通路中主要相关因子)的功能丧失性突变,造成Wnt经典信号通路的抑制,最终导致骨质密度降低,而功能获得性突变使得Wnt经典信号通路激活则会导致骨质密度增高症[11];sFRP1基因缺陷的小鼠表现为Wnt信号通路的激活和骨量增多,在其骨骼中,TCF1、Runx-2和骨钙素表达明显增多[12]。相反也有研究[13]表明Wnt经典通路的激活也可以抑制成骨:通过在含有Wnt3a无血清条件培养基中培养或表达Wnt1的慢病毒载体转染,激活了通路,最终人骨髓间充质细胞(human mesenchymal stem cells,hMSCs)的骨向分化受到抑制、细胞增殖能力增强;Derfoul等[14]通过基因转染使鼠胚胎间充质系C3HIOTl/2表达Wnt3a,结果发现Wnt3a能显著抑制其他成骨的标志基因如BSP、骨桥蛋白基因的表达。本实验主要检测该通路中的主要抑制因子DKK-1基因表达和βcatenin(其中包括β-catenin基因表达及单独提取细胞核中的β-catenin蛋白的表达),通过比较该2个因子在正常hPDLSCs成骨诱导前后的变化以及诱导后N-hPDLSCs组与A-hPDLSCs组的区别,来探讨AGEs刺激下,hPDLSCs骨分化过程中的Wnt经典通路是否受到影响。本实验研究结果显示对于正常hPDLSCs而言,成骨诱导后DKK-1基因表达明显上调,βcatenin基因表达下调,并且核蛋白里的β-catenin蛋白表达下调,可以确定Wnt通路处于抑制状态,故可以推断正常牙周膜干细胞在向成骨分化的过程中Wnt经典通路是受到了一定程度的抑制。通过对诱导后的正常组与AGEs刺激组比较,由于AGEs的刺激,抑制因子DKK-1基因表达降低,β-catenin基因表达明显升高,并且细胞核中的β-catenin蛋白表达升高,得到AGEs激活了的Wnt经典通路,这与正常的hPDLSCs骨分化过程中Wnt经典通路的抑制状态相反。
综上所述,AGEs能改变正常hPDLSCs骨分化过程中的Wnt经典通路,使该通路处于激活状态;AGEs抑制了hPDLSCs成骨分化。而AGEs是否通过激活Wnt经典通路影响hPDLSCs的骨分化能力,还需要大量的实验研究。
[1]Stitt AW, Jenkins AJ, Cooper ME. Advanced glycation end products and diabetic complications[J]. Expert Opin Investig Drugs, 2002, 11(9):1205-1223.
[2]Tan KC, Chow WS, Ai VH, et al. Advanced glycation end products and endothelial dysfunction in type 2 diabetes[J].Diabetes Care, 2002, 25(6):1055-1059.
[3]Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[4]伍燕, 邓超, 杨琨, 等. 糖基化终末产物对牙周膜干细胞增殖及其wnt经典通路相关基因表达的影响[J]. 牙体牙髓牙周病学杂志, 2012, 22(5):255-259.
[5]邓超, 伍燕, 杨琨, 等. 糖基化终末产物对人牙周膜干细胞骨向分化能力影响的研究[J]. 牙体牙髓牙周病学杂志,2012, 22(5):249-254.
[6]Ohta S, Yamada S, Matuzaka K, et al. The behavior of stem cells and progenitor cells in the periodontal ligament during wound healing as observed using immunohistochemical methods[J]. J Periodont Res, 2008, 43(6):595-603.
[7]Seo BM, Miura M, Gronthos S, et al. Investigation of mul-tipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[8]Techawattanawisal W, Nakahama K, Komaki M, et al. Isolation of multipotent stem cells from adult rat periodontal ligament by neurosphere-forming culture system[J]. Biochem Biophys Res Commun, 2007, 357(4):917-923.
[9]贺慧霞, 刘洪臣, 王东胜, 等. 矿化液促进犬牙周膜细胞异位成骨实验[J]. 中华老年口腔医学杂志, 2008, 6(3):203-207.
[10]Mulholland DJ, Dedhar S, Coetzee GA, et al. Interaction of nuclear receptors with the Wnt/beta-catenin/Tcf signaling axis: Wnt you like to know[J]. Endocr Rev, 2005, 26(7):898-915.
[11]Little RD, Carulli JP, Del Mastro RG, et al. A mutation in the LDL receptor-related protein 5 gene results in the autosomal dominant high-bone-mass trait[J]. Am J Hum Genet,2002, 70(1):11-19.
[12]Gaur T, Lengner CJ, Hovhannisyan H, et al. Canonical WNT signaling promotes osteogenesis by directly stimulating Runx2 gene expression[J]. J Biol Chem, 2005, 280(39):33132-33140.
[13]Liu G, Vijayakumar S, Grumolato L, et al. Canonical Wnts function as potent regulators of osteogenesis by human mesenchymal stem cells[J]. J Cell Biol, 2009, 185(1):67-75.
[14]Derfoul A, Carlberg AL, Tuan RS, et al. Differential regulation of osteogenic marker gene expression by Wnt-3a in embryonic mesenchymal multipotential progenitor cells[J].Differentiation, 2004, 72(5):209-223.
