乳制品及婴幼儿配方食品中蜡样芽孢杆菌的快速检测
2015-12-16刘新梅程逸宇张弛方昕高翔朱荣杨军
刘新梅,程逸宇,张弛,方昕,高翔,朱荣,杨军
(国家加工食品及食品添加剂质量监督检验中心(南京),南京市产品质量监督检验院,南京210028)
0 引言
蜡样芽孢杆菌(Bacillus cereus)是一种可形成芽孢的好氧革兰氏阳性菌,极易污染食品[1]引起心内膜炎、脑膜炎和菌血症等疾病[2]。蜡样芽孢杆菌在乳品行业中原料乳的污染较为严重。G riffiths在原乳中分离的83株菌中有85%是致腹泻毒素阳性菌株[3]。
目前传统的检测方法主要是采用选择性培养基分离培养,生化反应鉴定等方法,耗时费力,难以适应现代食品生产的检验需要[4]。近年来,国内外对于蜡样芽孢杆菌的快速检测开发出多种检验方法,如PCR检验[5]、蛋白印迹技术(Colony Blot Immunoassay CBI)检验[6]、VITEK自动生化鉴定仪检验[7]。本研究针对蜡样芽孢杆菌的特异性卵磷脂-水解磷脂酶C基因(pc-plc)[8]设计引物和探针,应用Taqman实时荧光PCR技术对乳制品及婴幼儿配方食品中的蜡样芽孢杆菌进行快速检测。
1 材料与方法
1.1 菌种
蜡样芽孢杆菌标准菌株3株CMCC(B)63301、63302、63303,短小芽孢杆菌CMCC(B)63202,枯草芽孢杆菌2株ATCC6633、CMCC(B)63501。金黄色葡萄球、沙门氏菌、单增李斯特菌、副溶血弧菌为本实验室自行分离保存。
1.2 引物和探针
根据蜡样芽孢杆菌pc-plc基因序列,利用Primer Express 3.0软件分析,优化设计出引物和探针,并使用BLAST程序进行同源性比对,保证引物和探针与靶基因结合的高度特异性。引物和探针由南京金斯瑞生物公司合成。上游引物:5’-AAAGATTGGTTCGTGAGAGC-3’;下游引物:5’-CGCTTACCTGTCATTGGTG-3’;探针:5’FAM-ACAAGAATATGCAGATAAATGGCGCGCTG-3’TAMRA,扩增条带大小163 bp。
1.3 实验试剂
细菌DNA提取试剂盒,Premix Ex TaqTM(Probe qPCR),营养肉汤,MYP培养基。
1.4 食品样本
巴氏杀菌奶、酸奶、婴儿奶粉、婴儿米粉,均从本地市场购入。
1.5 仪器设备
ABI 7500FAST实时荧光PCR仪、ABI普通PCR仪、电泳仪、生物安全柜、离心机
1.6 实时荧光PCR反应体系的建立
蜡样芽孢杆菌标准菌株活化后,加入10 mL营养肉汤,37℃培养16 h,取1mL菌液使用细菌DNA提取试剂盒提取DNA,作为PCR反应模板DNA。PCR反应体系:Premix Ex TaqTM(Probe qPCR)12.5 μL,引物各0.5 μL,探针1 μL,模板DNA5 μL,无菌水补足25 μL。PCR反应条件:95℃预变性3 min,95℃变性5 s,58 ℃退火40 s,进行40个循环,检测Ct值。
1.7 实时荧光PCR检测特异性
选取与蜡样芽孢杆菌亲缘关系较近的短小芽孢杆菌、枯草芽孢杆菌以及常见致病菌金黄色葡萄球、沙门氏菌、单增李斯特菌、副溶血弧菌,活化菌种,37℃营养肉汤培养16 h,分别提取DNA,进行实时荧光PCR检测,测定该检测方法的特异性。
1.8 实时荧光PCR检测灵敏度
将蜡样芽孢杆菌接种在营养肉汤中37℃培养16 h,菌液梯度稀释,接种到MYP培养基测定菌落数,提取各稀释度菌液DNA为模板,测定实时荧光PCR灵敏度。再以上述菌液DNA为模板,进行普通PCR,引物与实时荧光PCR相同,反应条件为:95℃预变性3 min,95 ℃ 变性5 s,53 ℃退火40 s,72 ℃延伸30 s,40个循环。PCR结果通过0.8%琼脂糖电泳检测,与实时荧光PCR结果相比较。
1.9 人工污染食品检测
取1 mL,37℃营养肉汤培养16 h的蜡样芽孢杆菌菌液,加到10 g巴氏杀菌奶、酸奶、婴儿奶粉、婴儿米粉(婴儿奶粉、婴儿米粉为1∶10水溶解液)中37℃孵育10 min,梯度稀释,分别提取DNA,进行实时荧光PCR检测。
2 结果与分析
2.1 实时荧光PCR反应体系的建立和特异性
分别用蜡样芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌、金黄色葡萄球、沙门氏菌、单增李斯特菌和副溶血弧菌对所设计pc-plc基因引物和探针进行特异性检测。结果表明,该探针和引物对蜡样芽孢杆菌具有较好的特异性,只有蜡样芽孢杆菌能产生特异扩增曲线(图1)。本研究检测了3株蜡样芽孢杆菌标准菌株,均能作为PCR反应模板,平均Ct值为22.67,24.33,23.63。
2.2 引物和探针的灵敏度
以1 mL计数过的不同浓度蜡样芽孢杆菌菌液为模板,提取DNA,进行实时荧光PCR检测,以测定其灵敏度。实验结果如图2所示。图2中,从左往右依次为1.5×107,1.5× 106,1.5×105,1.5× 104,1.5× 103,150 g-1菌液所得扩增曲线。高于150 g-1的菌液浓度均能被实时荧光PCR所扩增,Ct值随着模板DNA浓度的下降而上升,Ct值最低为24.79(1.5×107g-1),Ct值最高为36.88(150 g-1)。根据实验结果绘制标准曲线(图3),可以看出Ct值和菌液浓度之间具有明显的线性关系,R2=0.9852。实验表明,利用pc-plc基因引物和探针对蜡样芽孢杆菌的检测灵敏度可以达到1.5×102g-1。普通PCR结果如图4所示,1.5×103mL-1浓度以上的菌液作为模板均能扩增出100~200 bp之间条带,且条带的亮度由亮到暗,与实时荧光PCR实验结果Ct值变化趋势相吻合;150 g-1浓度则没有条带显示,表明实时荧光PCR的灵敏度要比普通PCR高一个数量级。
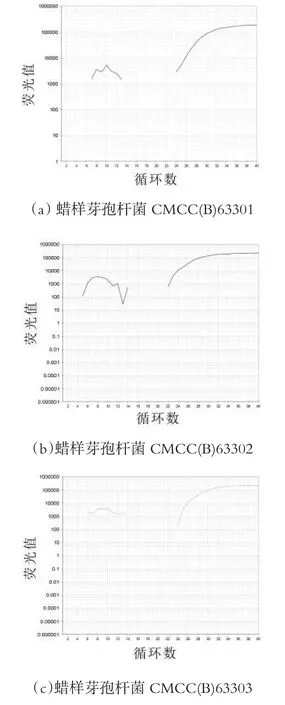
图1 蜡样芽孢杆菌实时荧光PCR曲线

图2 不同浓度蜡样芽孢杆菌实时荧光PCR反应曲线
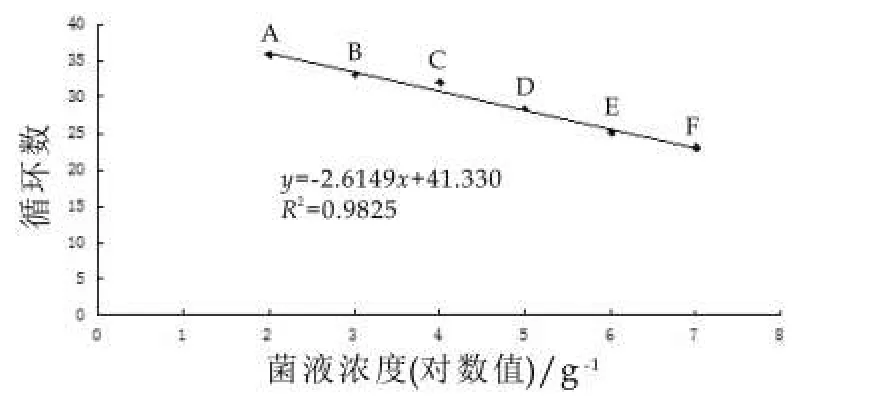
图3 蜡样芽孢杆菌实时荧光PCR反应标准曲线
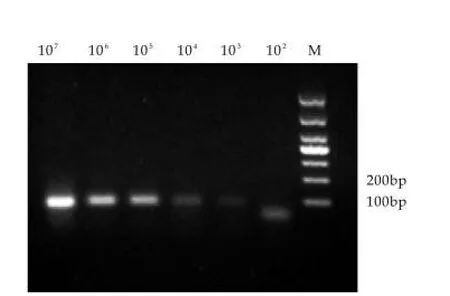
图4 不同浓度蜡样芽孢杆菌普通PCR反应
2.3 人工污染实验结果
实验结果如表1所示。表1中,在巴氏杀菌奶、酸奶、婴儿奶粉、婴儿米粉等4种人工污染食品中,婴儿米粉中含有200 g-1的蜡样芽孢杆菌就能被检测出来,Ct值为34.22±0.27,与灵敏度实验结果相似。而在3种乳制品中蜡样芽孢杆菌含量达到103CFU/g以上才能被检测到,Ct值分别为31.87±0.82,33.49±0.74,33.12±0.43,这可能是因为乳制品成分比较复杂,干扰了DNA提取或PCR反应,从而使得检验灵敏度偏低。
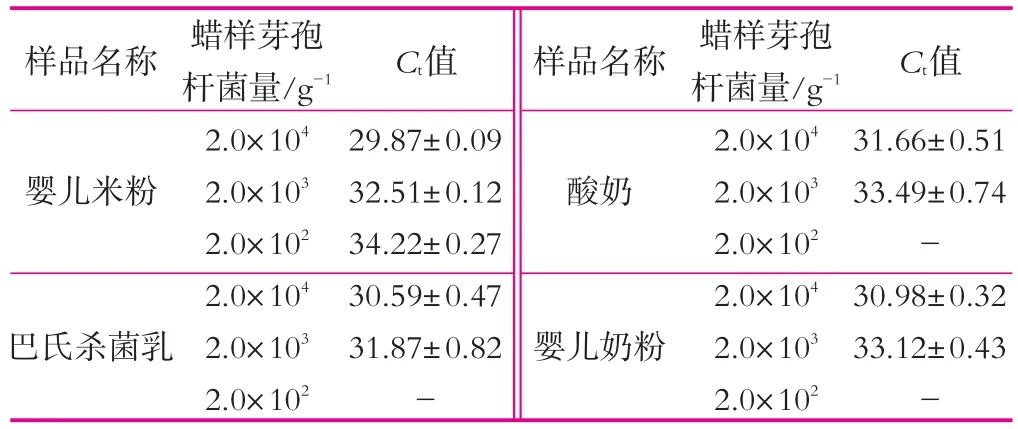
表1 人工污染实验
3 结论
由于蜡样芽孢杆菌及其芽孢广泛存在于周围的环境中,极易污染食物而引起食物中毒,因此需要发展一种快速的检测方法,对食品加工过程进行质量控制,以提高食品的安全性。目前对蜡样芽孢杆菌的检测主要采用传统的细菌分离及生化鉴定方法,费时、费力,需要较长时间进行选择性增菌过程[9]。本研究结果表明,以特异性卵磷脂-水解磷脂酶C基因(pc-plc)为目的基因设计引物建立的Taqman实时荧光PCR检测方法能特异性扩增蜡样芽孢杆菌,且与其他的芽胞杆菌及其他常见致病菌株均无交叉反应,可特异地检测蜡样芽孢杆菌,检测敏感性可达150 g-1。荧光PCR反应得到的Ct值与菌液浓度之间呈很好的线性关系,可以通过建立标准曲线来进行定量测定。人工污染实验也表明,该方法可以用来快速测定乳制品及婴幼儿配方食品中的蜡样芽孢杆菌,在婴幼儿米粉中检测灵敏度为200 g-1,而在乳制品中检验灵敏度要低于婴儿米粉,检出限只能达到103g-1。这可能是由于乳制品成分复杂,其中含有的某些物质对DNA的提取及PCR反应产生了一定干扰造成的。我们希望能在以后的实验中对此问题展开进一步的研究,通过滤膜富集等方法降低乳制品对检测的干扰,提高本方法对乳制品中蜡样芽孢杆菌的检出限。
[1]HIROSHI F,YOSHIE T,RYOTARO S.Duplex Real-time SYBR Green PCR assays for detection of 17 species of food or waterborne pathogens in stools.J Clinical Microbial[J],2003,41(11):5134.
[2]FINLAY W J J,LOGAN N A,SUTHERLAND A D.Bacillus cereus produces most emetic toxin at lower temperatures[J].Lett Appl Microbiol,2000(31):385-389.
[3]GRIFFTHS M W.Toxin production by psychrotrophic Bacillus spp.present in milky[J].Food Protect,1990,53(9):790-792.
[4]赵宁,吕琦,姚丽燕,等.原料乳中蜡样芽孢杆菌的快速检测[J].中国乳品工业,2009,37(9):43-45.
[5]MANTYNEN V,LINDSTROM K.A rapid PCR一Based DNA test for enterotoxic Bacillus cereus[J].Appl Environ Microb,1998,64(5):1634-1639.
[6]CHIHUA C,HWIACHENG D.A colony blot immunoassay for the rapid identification of Bacillus cereus[J].J Food Protect,2004,67(2):387-390.
[7]黄训端,潘见,余晓峰.草毒中蜡样芽抱杆菌的VITEK快速检测[J].微生物学杂志,2006.26(4):99-102.
[8]MANINEZ-BLANCH J F,SANCHEZ G,GARAY E,et al.Detection and quantification of viable Bacillus cereus in food by RT-qPCR[J].European Food Research and Technology,2011,232(6):951-955.
[9]中国疾病预防控制中心营养与食品安全所.GB/T 4789.14-2003蜡样芽抱杆菌检验[S].
