Suzuki反应的国内外研究进展
2015-12-15朱丽萍左治钧秦莹颖
朱丽萍,左治钧,秦莹颖
(西北大学 化学与材料科学学院/合成与天然功能分子化学教育部重点实验室,陕西 西安710069)
Pd催化下的C-C键交叉偶联反应是一类极其重要且应用很广的有机催化反应,它是从易得的原料合成复杂天然产物的必要方法[1]。其核心内容是 Suzuki偶联反应[2],即通过Pd的金属催化,将卤代芳香烃与有机硼试剂作用,成功实现C(aryl)-C(aryl)键的偶联(见图1)。

图1 C(Aryl)-C(Aryl)键的偶联
近年来,钯催化的交叉偶联反应已广泛应用于制药、电子工业和先进材料等领域。例如借助Suzuki反应,科学家们人工合成了水螅毒素这个巨型分子[3]。在2010年,科学家们又将Suzuki和Negishi的偶联反应联合应用,合成了聚酮类天然产物似蛇霉素。
目前对于Suzuki反应机理尚存在争论,其中近年来提出的钯催化循环机理是最被广为接受的,但其中碱的加入作用仍不明确。在其配体合成方面,杂环配体的发现使得催化效率大大提高。
1 SUZUKI反应机理
虽然Suzuki交叉偶联反应已被广泛使用,但因其反应很难从单纯的化学实验中得出,且反应过程中伴随着大量的中间体和化学平衡,使得对其机理的探索仍主要依赖于大量的反复试错实验。随着计算机技术应用以及计算化学飞速发展,针对Suzuki反应,多种假设机理被提出。其中最被广泛接受的是催化循环机理[4](见图2):
该反应通常会经历三个过程:氧化加成、芳基阴离子 向金属中心迁移和还原消除。首先,卤代芳烃R1-X与Pd(0)发生氧化加成,得到R1PdX中间体。之后,该中间体与一分子碱作用,得到中间体R1PdOH。同时,另一分子的碱与硼酸作用生成硼酸盐,使得芳基具有更强的富电性,有利于芳基向R1PdOH中间体的金属原子迁移,从而得到配合物中间体R1PdR2。该中间体再经过还原消除,得到芳基偶联产物R1-R2和零价钯,完成整个循环过程。
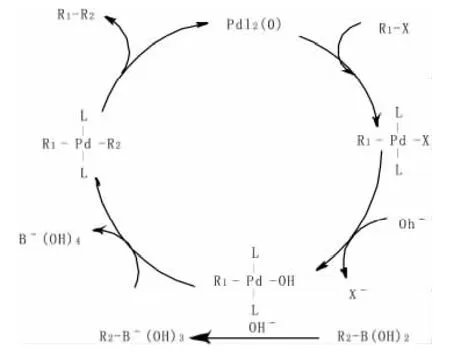
图2 Suzuki反应假设机理图
起初,碱在 Suzuki反应中的作用尚不明确。2005年,Braga,A.等人证实了碱的缺乏会造成Suzuki反应无法顺利进行[5]。发现若不在反应中添加碱,反应位垒将高达44kcal.mol-1。针对碱在 Suzuki反应中具体的作用,Braga.A.等人提出了两种主要的假设:一种是碱先进攻硼酸R2-B(OH)2,生成硼酸盐R2-B-(OH)3;另一种是碱进攻R1PdX中间体,使得X-基团离开,生成R1-PdOH(见图3)。
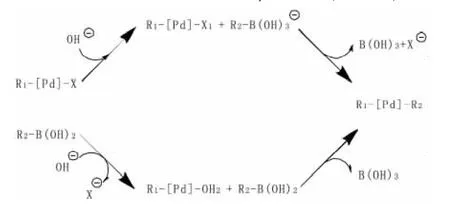
图3 Suzuki反应中碱的反应机理
针对这两种假设,Braga.A.等人又设计了相关实验来证实,即使用[Pd(CH2=CH-)(Br)(Ph3)2],CH2=CH-B(OH)2和OH_作为反应物来进行偶联。对于第一种假设,其过渡态[Pd(CH2=CH)2(Ph3)2],B(OH)3和游离的 Br-被观测到,其计算得出的能量差在224kcal.mol-1左右,很好的解释了碱在反应中的作用。而第二种假设无法定位到中间体R1-PdOH,因此得出结论,碱的作用是使硼酸变为硼酸盐,从而推动了催化循环。
但在随后的研究中发现,当配体是PPh3或将乙烯基换为苯基时[6],假设1的合理性遭到了质疑,在这些情况下,假设2被认为是更加合适的解释。目前认为这两种假设的机理存在竞争关系,其机理仍需进一步的研究。
2 SUZUKI反应配体
因P是很好的给电子体,所以Suzuki反应常用的催化剂是含膦的络合物,如Pd(PPh3)4。催化剂(前体)Pd(PPh3)4在进入催化循环前还需进行两次连续的配体解离,从而变成含14个电子的催化络合物Pd0(PPh3)2。这种络合物,由于其价位和配位数低,往往很不稳定,且生成时存在较大的能量壁垒,使其形成不易。于是人们希望设计出一种“聪明的催化剂”,它们在进入催化循环时,不需克服巨大的能量壁垒,化学性质稳定,同时仍具有高的催化活性。
近年来,越来越多杂环配体[7]和其他的一些低价位金属的使用,很好的解决了这一问题。杂环配体的价位和配位数可变,使其可以灵活地调节变化,从而满足催化循环中各个不同的阶段。更为值得肯定的是,这种配体不仅维持了催化的高效率,它还保护了催化中间体。
2.1 无膦配体
早期的无膦催化剂,如[N,N]-二茂铁配体[8],其富含电子,与传统的有机膦配体相似,是一种很好的σ-电子供体,但[N,N]-二茂铁配体给电子能力强,可与过渡金属形成稳定性更高的化合物。这些配合物在空气和水中稳定性好,表现出更优越的催化性能。其它的一些相关研究也随之出现,如N-卡宾配体、咪唑、钯粉、N配位的钯体系、无金属体系、无配位体体系。
配体Fe(η-C5H4N=CHPh)2(1)在室温下易与PdCl2(MeCN)2生成稳定的螯合物PdCl2Fe(η-C5H4N=CHPh)2(2)[9](图 4)。该螯合物 PdCl2Fe(η-C5H4N=CHPh)2在芳香碘代物和芳香溴代物与芳香硼试剂的Suzuki偶联反应中,易于从水相中分离,且分离后仍可重复使用4-5次左右。

图4 无膦配体Fe(η-C5H4N=CHPh)2
2.2 N杂环卡宾配体(NHCs)
1991年,Arduengo研究小组分离出首个稳定的游离态N-杂环卡宾(NHCs)[10]。NHCs一般以单线态形式存在,C原子采用sp2杂化形式,卡宾C原子周围只有六个电子,是一个缺电子体系。从诱导效应考虑,两个电负性较大的氮原子与卡宾碳相连,氮原子的吸电子作用使卡宾碳原子上的孤对电子趋于稳定。从共轭效应考虑,两个氮原子p轨道上的孤对电子和卡宾碳原子上的空p轨道发生给电子共轭效应,从而降低了卡宾碳原子的缺电子性。
独特的电子结构特征使得它几乎能够与周期表中的所有元素进行反应。作为一类过渡金属配体,NHCs的化学稳定性和配位多样性是其迅速发展的最主要的两个原因。鉴于NHCs的多样性及 NHC—M键的特殊稳定性,以多NHC为配体可以制备得到许多具有独特结构的NHC金属配合物,从而产生新的性质。咪唑盐与强碱作用脱质子后与金属离子反应,或咪唑盐与金属氧化物直接反应是制备NHC金属配合物的最常用和有效的方法[11]。
2.3 P,O 与 P,N 杂环配体
目前卡宾配体在Suzuki偶联反应中使用的越来越广泛。这些配体具有强的给电子能力,且能生成稳定的催化剂,但在配位灵活性上仍存在不足。
Buchwald等人于是合成了 P,O与 P,N的杂环配体(5)[12]。这种钯复合物的新配体,它有效地催化了芳香硼酸化合物和芳香卤代物。Milstein等人则使用了多电子,大位阻的苄基膦配体(6)去稳定不饱和的 Pd(0)、Pd(I)、Pd(II)。其苯环上所连的两个对称临近的甲基基团,则体现了这类配体它的半不稳效应[13]。其它在Suzuki反应中所使用的P-O和P-N类杂环配体还有(7)、(8)、(9)、(10)等化合物(见图5)。
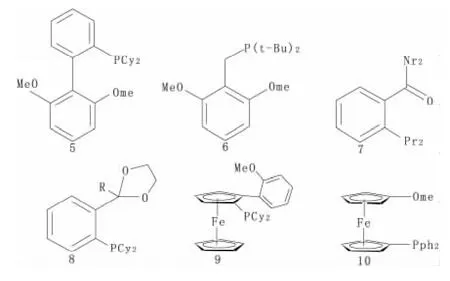
图5 P,O与P,N的杂环配体
3 结语
Suzuki偶联反应具有很多优点:其反应底物易得,反应条件温和,在水和空气条件下稳定,可允许多种活性官能团的存在,副产物毒性小且后处理容易,是实现C(aryl)-C(aryl)键偶联的理想方法。
对于钯的催化反应,它们的应用相对还十分有限,因而还需要进一步的发展来扩大偶联反应在工业上的应用。
在未来的发展上,将有以下几个方面仍需探究::(1)寻找更好的催化剂来实现偶联反应的绿色性和原子经济性;(2)如何获得更多可以应用钯催化的偶联反应的卤代烃和烯烃;(3)将C-C键偶联反应的概念应用于更多的其他原子间的偶联。
[1]Rouhi,A.M.Fine chemicals.Chem.Eng.News 2004.82:49-58.
[2]Suzuki,A.Recent Advances in the Cross-Coupling Reactions of Organoboron Derivatives with Organic Electrophiles.1995-1998.J.Organomet.Chem.1999,576:147-168
[3]Suhem,Kishly.Synthesis of palytoxin from palytoxin carboxylic acid.J.Am.Chem.Soc.1994,116:11205-11206.
[4]Miyaura,N.;Suzuki,A.Palladium-catalyzed cross- coupling reactions of organoboron compounds.Chem.Rev.1995,95:2457-2483.
[5]Braga,A.A.C.;Morgon,N.H.;Ujaque,G.;Maseras,F.Computational characterization of the role of the base in the Suzuki_Miyaura cross-coupling reaction.J.Am.Chem.Soc.2005,127:928-930
[6]Braga,A.A.C.;Morgon,N.H.;Ujaque,G.;Lled_os,A.;Maseras,F.Computational study of the transmetalation process in the Suzuki_Miyaura cross-coupling of aryls.J.Organomet.Chem.2006,691:4459-4466.
[7]Braunstein,P.;Nand,F.Hemilability of Hybrid Ligands and the Coordination Chemistry of Oxazoline-Based Systems.Angew.Chem.Int.Ed.2001,40:680-699.
[8]Gan,K.- S.;Hor,T.S.A.Ferrocenes:Homogeneous Catalysis,Organic Synthesis,Materials Science;Togni,A.,Hayashi,T.,Eds.;VCH:Weinheim,Germany,1995,Chapter 1,p 3.
[9]Weng,Z.;Koh,L.L.;Hor,T.S.A.Suzuki Cross- Coupling in Aqueous Media Catalyzed by a 1,1'-N-Substituted Ferrocenediyl Pd(II)Complex.J.Organomet.Chem.2004,689:18-24.
[10]Herrmann,W.A.Angew.Chem.,Int.Ed.2002,41:1290.
[11]Liu,Q.- X.;Li,Z.- M.Chem.Res.Appl.2005,17:147(in Chinese).
[12]Barder,T.E.;Walker,S.D.;Martinelli,J.R.;Buchwald,S.L.Catalysts for Suzuki-Miyaura Coupling Processes:Scope and Studies of the Effect of Ligand Structure.J.Am.Chem.Soc.2005,127:4685-4696.
[13]Weissman,H.;Shimon,L.J.W.;Milstein,D.Unsaturated Pd(0),Pd(I),and Pd(II)Complexes of a New Methoxy-Substituted Benzyl Phosphine.Aryl- X Oxidative Addition,C-O Cleavage,and Suzuki- Miyaura Coupling of Aryl Chlorides.Organometallics.2004,23:3931-3940.
