小鼠肾发育中胶质细胞系源性神经营养因子家族受体α1和受体酪氨酸激酶的表达*
2015-12-15郭芳田娟赵越超
郭芳,田娟,赵越超
(辽宁医学院组织学与胚胎学教研室,辽宁 锦州 121001)
·论著·
小鼠肾发育中胶质细胞系源性神经营养因子家族受体α1和受体酪氨酸激酶的表达*
郭芳,田娟,赵越超
(辽宁医学院组织学与胚胎学教研室,辽宁 锦州 121001)
目的研究小鼠肾发育过程中胶质细胞系源性神经营养因子家族受体α1(GFRα1)和受体酪氨酸激酶(RET)的表达及意义。方法应用免疫荧光和蛋白印迹技术检测各胚龄小鼠肾组织中GFRα1和RET的时空定位表达及蛋白含量变化。结果在肾发育早期,GFRα1和RET在输尿管芽上皮细胞开始表达,生后肾组织内仅见GFRα1表达。随着肾小体的发育,GFRα1在肾小体发育早期即小泡体、逗号小体和S小体均有表达,而在肾小体发育后期即毛细血管袢期肾小体和未成熟期肾小体表达减弱,在成熟肾小体未见表达。RET在各期肾小体均未见表达。随着早期髓质的出现,GFRα1在近端小管、远端小管和集合管有明显表达;RET在集合管表达。在成熟肾脏,GFRα1定位表达于近端小管、远端小管和集合管;RET定位表达于集合管。GFRα1和RET在肾脏的蛋白表达量随胚龄的增加而增加,生后1 d达峰值,随后两者的蛋白表达量随日龄的增加而逐渐减少。结论在肾发育中,GFRα1参与肾小体发生、早期发育过程及肾小管和集合管的发生、发育过程,并维持其正常生理功能。RET参与集合管的发生、发育过程,并维持其正常生理功能。
胶质细胞源性神经营养因子家族受体α1;受体酪氨酸激酶;肾;发育;
胶质细胞系源性神经营养因子(glial cell linederived neurotrophic factor,GDNF)受体包括GDNF家族受体α1(GDNF family receptor α1,GFRα1)和受体酪氨酸激酶(receptor tyrosine kinase,RET)两种。其中,GFRα1为糖基化磷脂酰肌醇锚定受体,缺乏跨膜区和膜内区;RET则有膜外、跨膜和膜内成分,起信号传导作用[1-2]。GFRα1和RET通过与GDNF结合,调控体内多个器官系统的发育及维持其生理功能[3-4]。国外学者研究发现,GFRα1和RET参与肾脏输尿管芽发生及形态学分支[5],并提出两者通过与GDNF结合调控肾脏的发生、发育过程,但具体的调控机制国内尚无文献报道。另有研究表明,GFRα1和RET的异常表达与某些肾发育畸变疾病如肾母细胞瘤有关[6]。因此在前期研究的基础上[7],本实验观察GFRα1和RET在小鼠肾脏发育过程中的表达变化,为进一步阐明其在肾脏发育中的调控机制奠定形态学基础。
1 材料与方法
1.1 实验动物
成年健康昆明小鼠(体重25~30 g),购自中国医科大学实验动物中心,生产许可证:SCXK(辽)2008-0005。
1.2 实验试剂
GFRα1兔多克隆抗体(sc-10716)、RET兔多克隆抗体(sc-167)购自美国Santa公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔免疫球蛋白IgG购自武汉博士德生物工程有限公司,3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogease,GAPDH)鼠单克隆抗体购自上海康成生物公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、蛋白Marker购自NEB公司,ECL(enhanced chemiluminescence,ECL)试剂盒购自美国Pierce公司。
1.3 实验方法
1.3.1 标本制备小鼠按雌雄比例1∶1同窝饲养,以观察到阴道栓脱落的最早时间计为胚龄(embryonic days,E)0 d[7]。孕鼠分笼饲养,每天上午8∶00、下午5∶00观察生产,以观察到仔鼠出生的最早时间计为生后(neonatal days,N)0 d。分别取胚龄12、14、16、18 d胎鼠和生后1、7、14、21和40 d仔鼠肾脏,每组8只,每只孕鼠最多取2只胎鼠或仔鼠。孕鼠经10%水合氯醛麻醉后剖腹取出胎鼠,胚龄12 d全胚固定,胚龄14、16、18 d取其左肾固定。仔鼠经10%水合氯醛麻醉后,于腹后壁取出左肾,用排刀法沿横轴将肾脏切开,置于4%多聚甲醛固定,梯度酒精脱水,二甲苯透明,石蜡定向包埋,5μm连续切片。各组小鼠取右肾,入液氮迅速冷冻,置入-80℃冰箱冷冻保存待用。
1.3.2 免疫荧光技术切片常规脱蜡、水化,滴加5%驴血清(normal donkey serum,NDS)室温孵育1 h,甩去多余液体,不洗;滴加GFRα1或RET兔多克隆抗体(工作液浓度1∶100)置入4℃孵化箱过夜,滴加FITC标记的荧光二抗室温孵育2 h,用防淬灭封片剂封片,共聚焦激光扫描显微镜(激发波长为488 nm)观察并采集图像[7]。以磷酸缓冲盐溶液(phosphate buffer saline,PBS)代替一抗作阴性对照组。上述各步骤用0.01 mol/L PBS冲洗。
1.3.3 蛋白印迹检测取冷冻待用右肾分别称质量,用小剪刀将组织块尽量剪碎(冰上操作),加入4倍体积的蛋白裂解液,超声粉碎,4℃过夜,冷冻离心机4℃、12 000 r/min离心30 min,去除细胞碎片,取上清液,考马斯亮蓝法进行蛋白定量[7]。样品取50μg与6×十二烷基硫酸钠上样缓冲液混合,100℃煮沸5 min,聚丙烯酰胺凝胶电泳,转硝酸纤维素膜。5%脱脂奶粉室温封闭1 h,一抗(GFRα1和RET工作液浓度为1∶700)置入4℃孵育过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(工作液浓度1∶5 000)室温孵育2 h,HRP-ECL蛋白检测发光鉴定,凝胶电泳图像分析仪进行采图。
1.4 统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,用单因素方差分析,P<0.05有差异统计学意义。
2 结果
2.1 免疫荧光检测
胚龄12 d,GFRα1在输尿管芽上皮细胞及生后肾组织微弱表达;而RET在输尿管芽上皮细胞微弱表达,生后肾组织未见表达。随着肾小体发育,GFR α1在小泡体、逗号小体和S小体均有表达,表达逐渐增强;在毛细血管袢期肾小体及未成熟期肾小体表达减弱,在成熟肾小体未见表达。RET在各期发育阶段的肾小体未见阳性表达。随着早期髓质的出现,GFRα1在近端小管、远端小管和集合管有明显表达;RET在集合管有明显表达。在成熟肾脏中,GFR α1主要定位表达于近端小管、远端小管和集合管;RET主要定位表达于集合管。见图1、2。

图1 GFRα1在小鼠肾脏表达的免疫荧光染色

图2 RET在肾脏表达的免疫荧光染色
2.2 蛋白印迹检测
随着胚龄的增加,GFRα1和RET在肾脏表达量逐渐增加,生后1 d表达量最高,随后GFRα1和RET在肾脏表达量逐渐减少。见图3。
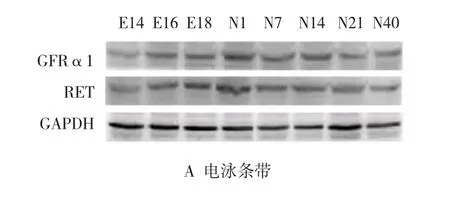

图3 小鼠肾脏发育各阶段GFRα1和RET蛋白表达变化
3 讨论
哺乳动物肾脏发育是输尿管芽和生后肾组织相互诱导的结果。以小鼠为例,胚龄12 d输尿管芽及其分支出现,生后肾组织呈帽状围绕在输尿管芽及分支周围;胚龄14 d,输尿管芽分支周围出现小泡体、逗号小体、S小体,这部分皮质称为生肾区;胚龄16 d,大多数肾小体仍停留在逗号小体、S小体阶段,可见到少量Ⅲ和Ⅳ期的髓旁肾小体,即第1代成熟肾小体出现;胚龄18 d,早期髓质出现,髓质由少量近直小管、远直小管、细段和集合管构成,其间散在大量间质,相当于成年后的髓质外带外区;生后1 d,被膜下仍有生肾区,但相对面积减少,髓质外带内区出现;生后7 d,皮质生肾区消失,只有Ⅳ期肾小体存在,肾小体发育基本成熟,集合管不再分支,髓放线出现,可见近直小管,远直小管和集合管,肾乳头可见由远端小管直部、细段以及集合管构成的髓质外带内区;随后,皮质增厚,髓质可区分为髓质外带内外区;生后40 d,肾发育达到成年水平[8]。
有研究表明,GFRα1和RET参与肾脏发生、发育过程。1998年TOWERS等[9]发现,GFRα1和RET在肾脏表达,参与肾发生、发育过程。2003年CAMASSEI等[6]通过免疫组织化学检测肾胚细胞瘤中GFRα1和RET的阳性表达,证实GFRα1和RET参与诱导肾胚细胞瘤的细胞分化。2004年CHARLETBERGUERAND等[10]报道GDNF家族复合受体GFRα1是RET信号转换的重要成分,与神经细胞和肾发育有关,其活性可被GDNF激活。2006年COSTANTINI等[11]证实,GDNF/RET信号系统是肾脏发育中输尿管芽正常生长的必要条件,但GDNE/RET信号在肾分支形态学的作用机制仍不清楚。2008年SKINNER等[12]提出人类RET和GDNF突变可能导致肾发育异常。2009年LU等[13]发现在胚胎发育中,缺乏Etv4和Etv5等位基因会导致肾发育不良,并推测Etv4和Etv5是RET的下游信号。JAIN[14]报道GFRα1或RET缺失将导致肾发育不全,引起围产期死亡,在人类先天性肾畸形中可检测出RET基因突变。
本研究显示,胚龄12 d时,GFRα1和RET分别在小鼠肾脏输尿管芽和生后肾组织开始表达,表明两者对肾脏的发生起关键作用。在肾小体的发育过程中,GFRα1在肾小体早期发育阶段有表达;在发育后期减弱,成熟肾小体未见表达,说明GFRα1参与肾小体的发生及早期分化、增殖,而对肾小体的后期发育及功能可能不起关键作用。随着早期髓质的出现,GFRα1在近端小管、远端小管和集合管有明显的表达,RET在集合管有表达。说明两者分别参与肾小管和集合管的形态发生、发育过程。在成熟肾脏中,GFRα1定位表达于近端小管、远端小管和集合管;RET定位表达于集合管,与其他研究结果相似[9,11]。表明两者在维持肾脏正常生理功能方面同样发挥重要作用。蛋白印迹结果显示,随着胚龄的增加,GFRα1和RET在肾脏表达量表现为先递增,达到峰值之后逐渐递减,其峰值出现在生后1 d。本研究首次发现,GFRα1和RET在肾脏发育过程中的表达变化特点,该特点具有的生理意义还有待于进一步研究。因此,GFRα1和RET可参与肾脏不同结构的发生、发育过程,并维持其正常生理功能。然而,两者是如何通过其信号通路调控肾发育过程,还有待下一步研究。
[1]GUO G,SINGH V,ZOCHODNE DW.Growth and turning properties of adult glial cell-derived neurotrophic factor coreceptor α1 nonpeptidergic sensory neurons[J].J Neuropathol Exp Neurol, 2014,73(9):820-836.
[2]GOODMAN KM,KJAER S,BEURON F,et al.RET recognition of GDNF-GFR α1 ligand by a composite binding site promotes membrane-proximal self-association[J].Cell Rep,2014,25(6):1894-1904.
[3]FROMONT-HANKARD G,PHILIPPE-CHOMETTE P,DELEZOIDE AL,et al.Glial cell-derived neurotrophic factor expression in normal human lung and congenital cystic adenomatoid malformation[J].Arch Pathol Lab Med,2002,126(4):432-436.
[4]SUVANTO P,HILTUNEN JO,ARUMAE U,et al.Localization of glial cell line-derived neurotrophic factor(GDNF)mRNA in em bryonic rat by in situ hybridization[J].Eur J Neurosci,1996,8(4): 816-822.
[5]SARIOLA H,SAARMA M.GDNF and its receptors in the regulation of the ureteric branching[J].Int J Dev Biol,1999,43(5): 413-418.
[6]CAMASSEI FD,BOLDRINI R,JENKNER A,et al.Expression of glial cell line-derived neurotrophic factor and neurturin in mature kidney,nephrogenic rests,and nephroblastoma:possible role as differentiating factors[J].Pediatr Dev Pathol,2003,6(6): 511-519.
[7]赵越超,田娟,郭芳,等.胶质细胞源性神经营养因子在小鼠肾脏发育过程中的表达[J].中国现代医学杂志,2014(6):485-487.
[8]UPADHYAYKK,SILVERSTEINDM.Renaldevelopment:a complex process dependent on inductive interaction[J].Curr Pedi-atr Rev,2014,10(2):107-114.
[9]TOWERS PR,WOOLF AS,HARDMAN P.Glial cell line-derived neurotrophic factor stimulates ureteric bud outgrowth and enhances survival of ureteric bud cells in vitro[J].Exp Nephrol, 1998,6(4):337-351.
[10]CHARLET-BERGUERAND N,LE HIR H,INCORONATO M, et al.Expression of GFR alpha 1 receptor splicing variants with different biochemical properties is modulated during kidney development[J].Cell Signal,2004,16(12):1425-1434.
[11]COSTANTINI F,SHAKYA R.GDNF/Ret signaling and the development of the kidney[J].Bioessays,2006,28(2):117-127.
[12]SKINNER MA,SAFFORD SD,REEVES JG,et al.Renal aplasia in humans is associated with RET mutations[J].Am J Hum Genet,2008,2(2):344-351.
[13]LU BC,CEBRIAN C,CHI X,et al.Etv4 and Etv5 are required downstream of GDNF and Ret for kidney branching morphogenesis[J].Nat Genet,2009,41(12):1295-1302.
[14]JAIN S.The many faces of RET dysfunction in kidney[J]. Organogenesis,2009,5(4):177-190.
(张蕾 编辑)
Expression of glial cell line-derived neurotrophic factor family receptor α1 and receptor tyrosine kinase in kidney development of mouse*
Fang GUO,Juan TIAN,Yue-chao ZHAO
(Department of Histology and Embryology,Liaoning Medical College, Jinzhou,Liaoning 121001,P.R.China)
【Objective】To investigate the expressions of glial cell line-derived neurotrophic factor family receptor α1(GFR α1)and receptor tyrosine kinase(RET)during renal development of mice and the significance.【Methods】The expressions of GFR α1 and RET were examined by immunofluorescence.The protein content of GFR α1 and RET in the kidneys of embryonic and neonatal mice was measured by Western blot.【Results】In the early development of kidney,GFR α1 and RET began to express in epithelium of ureteric bud,and only GFR α1 appeared in metanephrogenic tissue.Along with the development of renal corpuscles, GFR α1 was expressed in the early-development renal corpuscles such as vesicle bodies,comma-shaped bodies and S-shaped bodies;but the expression was reduced in the later-stage renal corpuscles and disappeared in mature renal corpuscles.RET was not expressed in renal corpuscles of any stage.Along with the emerging of early medulla,GFR α1 was also expressed in proximal tubules,distal tubules and collecting ducts of developmental and mature kidney.RET was expressed in collecting ducts of developmental and mature kidney.Western blot results showed the expressions of GFRα1 and RET in kidney increased along with embryonic age andreached to the peak on N1 d.Then,the expressions of GFR α1 and RET in kidney decreased along with neonatal age.【Conclusions】GFR α1 may participate in the generation and early development of renal corpuscles and in the development and function of proximal tubules,distal tubules and collecting ducts.RET may participate in the development and function of collecting ducts.
glial cell line-derived neurotrophic factor family receptor α l;receptor tyrosine kinase;kidney;development
R329.461;R-332
A
1005-8982(2015)30-0013-05
2015-04-23
国家级大学生创新创业训练计划项目(No:201410160037);辽宁省大学生创新创业训练计划项目(No:201410160037);辽宁省教育厅科学技术研究项目(No:L2012307);辽宁省科学技术计划项目(No:2013022067)
田娟,E-mail:tian555juan555@sina.com
