促红细胞生成素衍生肽抑制大鼠心肌微血管内皮细胞缺血再灌注损伤的作用研究*
2015-12-15王琛司瑞张明明余文军郝启萌张荣庆王海昌
王琛,司瑞,张明明,余文军,郝启萌,张荣庆,王海昌
促红细胞生成素衍生肽抑制大鼠心肌微血管内皮细胞缺血再灌注损伤的作用研究*
王琛,司瑞,张明明,余文军,郝启萌,张荣庆,王海昌
目的:探讨促红细胞生成素衍生肽(HBSP)抑制大鼠心肌微血管内皮细胞(CMECs)缺血/再灌注损伤的作用及其机制。
方法:分离培养大鼠CMECs,建立缺血/再灌注损伤模型,随机分为对照组、模拟缺血/再灌注组(SI/R组)、SI/R+重组人促红细胞生成素组(SI/R+rhEPO组)、SI/R+HBSP组;HBSP分别选择2.5 ng/ml、25 ng/ml、50 ng/ ml、100 ng/ml四个浓度,通过噻唑蓝(MTT)比色实验检测CMECs增殖能力以确定药物作用的最适浓度。而后采用细胞划痕实验检测细胞迁移能力,末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定(TUNEL)法检测细胞凋亡率来进一步验证其保护作用。研究保护机制的实验分组为:对照组、SI/R组、SI/R+HBSP(HBSP最适浓度为25 ng/ml)组、SI/R+HBSP+磷脂酰肌醇-3激酶(PI3K)抑制剂(LY294002)组、SI/R+HBSP+雷帕霉素组,采用蛋白免疫印迹(Western blot)法检测蛋白激酶B(AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)、核糖体S6蛋白激酶(p70S6K)等蛋白的表达及其磷酸化水平。
结果:与SI/R组比,SI/R+rhEPO组和SI/R+HBSP组CMECs增殖能力明显上升(P<0.05),凋亡率显著下降(P<0.01),迁移能力增强。用抑制剂LY294002及雷帕霉素处理后,与SI/R组相比,SI/R+HBSP组AKT、mTOR及p70S6K的磷酸化水平均显著提高(P<0.05);与SI/R+HBSP组相比,SI/R+HBSP+LY294002组的AKT、mTOR及p70S6K的磷酸化水平均显著下降(P<0.05),SI/R+HBSP+雷帕霉素组mTOR磷酸化水平及p70S6K磷酸化水平显著下降(P<0.05)。
结论:HBSP能够抑制缺血/再灌注诱导的CMECs的损伤,其保护作用可能与PI3K-AKT/mTOR信号通路激活有关。
促红细胞生成素衍生肽;心肌微血管内皮细胞;缺血/再灌注损伤;细胞凋亡
Methods: The CMECs were isolated from SD rats to establish I/R model, and the cells were randomly divided into 4 groups: ①Control group, ②Simulated ischemia/reperfusion (SI/R) group, ③SI/R + rhEPO group, ④SI/R + HBSP group, in which the reperfusion medium contained HBSP at 2.5 ng/ml, 25 ng/ml, 50 ng/ml and 100 ng/ml respectively. MTT method showed that HBSP 25 ng/ml was the best concentration to detect CMECs proliferation. The protective experiment was divided into 5 groups: ①Control group, ②SI/R group, ③SI/R + HBSP (25 ng/ml) group, ④SI/R + HBSP + PI3K inhibitor LY294002 group and ⑤SI/R + HBSP + Rapamycin group. The protein expressions of AKT, mTOR and p70S6K were examined by Western blot analysis.
Results:①Compared with SI/R group, SI/R + rhEPO group and SI/R + HBSP group had increased CMECs
proliferation, increased migration ability, P<0.01 and decreased apoptosis rate, P<0.01.②Compared with SI/R group, SI/R + HBSP group increased the phosphorylation level of AKT, mTOR and p70S6K, P<0.05. ③compared with SI/R + HBSP group, SI/R + HBSP + PI3K inhibitor LY294002 group presented decreased phosphorylation level of AKT, mTOR and p70S6K, P<0.05; SI/R + HBSP + Rapamycin group had decreased phosphorylation level of mTOR and p70S6K, P<0.05.
Conclusion: HBSP may protect CMECs from I/R injury in experimental rats, which might be related to the activation of PI3K-AKT/mTOR signal pathway.
(Chinese Circulation Journal, 2015,30:280.)
心肌缺血/再灌注损伤(I/RI)是急性心肌梗死患者血管再通治疗时常伴随着的重要病理生理过程,不仅发生率高,而且影响血管再通治疗效果,严重者甚至导致死亡。以往研究证实,促红细胞生成素(EPO)除具有治疗贫血作用外,还可对心脏、肾脏等重要器官发挥保护作用[1,2]。但发挥此保护作用需要给予较高浓度,易产生红细胞增多、血黏度增高等严重不良反应,额外增加了心血管疾病危险因素,极大限制了EPO的临床应用。Brines等[3]通过分析EPO空间构象,合成了一种11个氨基酸残基组成的线性多肽链——促红细胞生成素衍生肽(HBSP),在动物模型中显示出良好的组织保护作用,且无促红细胞生成的不良反应。本课题组前期研究结果亦证实,HBSP可显著抑制大鼠心肌缺血/再灌注损伤,减少梗死面积[4]。但是HBSP对I/ RI的心肌微血管内皮细胞(CMECs)是否具有保护作用及其可能涉及的机制并未见报道。本研究通过建立模拟缺血/再灌注模型,观察HBSP对于缺血/再灌注的CMECs是否有保护作用,并进一步探讨其具体机制。
1 材料与方法
实验动物和材料:2013-07至2014-08纳入雄性SD大鼠10只,体重80~100 g,购于第四军医大学实验动物中心。HBSP(纯度≥98%)购自上海科肽生物科技有限公司。重组人EPO(rhEPO)、磷脂酰肌醇-3激酶(PI3K)特异性抑制剂LY294002购自美国Millipore公司。哺乳动物雷帕霉素靶蛋白(mTOR)特异性抑制剂雷帕霉素购于美国Cell signaling公司。蛋白激酶B(AKT)抗体及磷酸化蛋白激酶B(pAKT)抗体、mTOR抗体及磷酸化哺乳动物雷帕霉素靶蛋白(pmTOR)抗体、核糖体S6蛋白激酶(p70S6K)抗体及磷酸化核糖体S6蛋白激酶(pp70S6K)抗体来自美国Abcam公司。
CMECs分离培养及鉴定:采用酶消化法分离CMECs,具体步骤见参考文献[5]。采用免疫细胞化学染色进行细胞鉴定,具体步骤见参考文献[6]。
模型的建立及分组:模拟缺血/再灌注(SI/R)模型的建立见参考文献[7]。更换培养液为缺血液(含NaCl、KCl、MgCl2、CaCl2·2H2O、HEPES、脱氧葡萄糖、连二硫酸钠、乳酸;pH=6.5),37℃缺氧孵箱内孵育2 h后,更换正常培养液或含药物的培养液,37℃5% CO2孵箱内孵育4 h后进行各项检测。CMECs随机分组:①对照组:正常培养液培养,不加任何干预;②模拟缺血/再灌注组(SI/R组);③模拟缺血/再灌注+重组人促红细胞生成素组(SI/ R+rhEPO组):再灌注时更换加入含rhEPO 10 IU/ ml的培养液;④模拟缺血/再灌注+促红细胞生成素衍生肽组(SI/R+HBSP组):再灌注时更换加入含不同浓度的HBSP(2.5、25、50、100 ng/ml)的培养液。确定HBSP的最适浓度后,用此浓度进行细胞迁移能力及凋亡率的测定。研究保护机制的实验分组:①对照组;②SI/R组;③SI/R+HBSP组:HBSP最适浓度为25 ng/ml;④SI/R+HBSP+磷脂酰肌醇-3激酶(PI3K)抑制剂(LY294002)组:再灌注液除含HBSP外,还含有30 μmol/L的LY294002;⑤SI/ R+HBSP+雷帕霉素组:再灌注液除含HBSP外,还含有10 nmol/L的雷帕霉素。
噻唑蓝(MTT)比色法检测细胞增殖能力:参照文献[8],取同一批的CMECs,将细胞密度调整至5×104/ml接种于96孔板,每组接种100 μl,每组设5个复孔。待细胞生长至80%汇合后,按上述方法进行分组及造模。复氧结束后加入MTT 20 μl,继续孵育4 h,终止培养。小心吸弃孔内的上清,每孔加入150 μl二甲基亚砜(DMSO),震荡10 min待结晶物充分溶解后,用酶标仪于波长490 nm处测定各孔吸光度(A) 值。
末端脱氧核苷酸转移酶介导的dUTP 缺口末端
标记测定(TUNEL)法检测CMECs的凋亡率:制备细胞爬片,按上述方法分组及造模后,按照试剂盒说明书进行操作。冷丙酮室温固定20 min后,0.1%Triton X-100孵育2 min(冰上),磷酸盐缓冲液(PBS,成分为NaCl、Na2HPO4、KCl、KH2PO4,pH=7.35)冲洗。加入TUNEL混合溶液,37℃避光孵育1 h。续用4,6-联脒-2-苯基吲哚(DAPI)室温孵育10 min,PBS冲洗。抗荧光淬灭剂封片后,在荧光显微镜下观察并拍照。TUNEL染色阳性为凋亡细胞,呈绿色荧光,DAPI对所有细胞核进行染色,呈蓝色荧光。每张爬片随机选取5个视野进行计数,统计细胞总数和凋亡细胞数,取其平均值。凋亡率(AI)=凋亡阳性细胞数/总细胞数×100%。
细胞划痕法测定CMECs的迁移能力:参照文献[8],取同一批CMECs,将细胞密度调整至1×106/ml接种于6孔板,每孔接种2 ml,待细胞后生长汇合后,吸弃孔内培养液,用200 μl移液器枪头垂直于培养板底部均匀划痕。将孔板置于倒置显微镜下拍照,每孔任选3个视野拍照记录划痕区的相对距离。而后按上述方法进行随机分组,模型建立后继续以含1%FBS的DMEM培养液继续培养24 h后取出拍照,记录各组划痕后的相对距离,测定CMECs的迁移能力。
免疫蛋白印迹法(Western Blot)检测AKT等相关蛋白的表达:预冷PBS冲洗收集细胞,细胞裂解液裂解,低温离心后取上清,参照文献[9],按照二喹啉甲酸(BCA)蛋白定量试剂盒说明书测定蛋白浓度。而后采用湿转的方法将蛋白转移至聚偏二氟乙烯膜(PVDF)后,置于含5%脱脂乳的TBST封闭缓冲液(含有 Tris-HCl、NaCl、Tween-20,pH=7.4)中封闭,加入pAKT、pmTOR、pp70S6K一抗4℃孵育过夜。加二抗37℃孵育1 h,经化学发光法曝光后观察结果。随后Stripping 缓冲液解离一抗,漂洗并重新封闭印迹膜,检测三种信号分子AKT、mTOR、p70S6K的表达。采用Bio-image(Bio-Rad)分析软件采集信号和灰度扫描。
统计学方法:用SPSS 14.0软件进行统计学分析,数据以x±s表示,多组间比较采用单因素方差分析,再以LSD-t检验分析相应两组差异。以P<0.05为差异有统计学意义。
2 结果
CMECs的鉴定:CMECs吞噬Alexa594红色荧光标记的乙酰化低密度脂蛋白(acLDL)后,细胞质呈红色荧光,DAPI染色后细胞核呈蓝色荧光。图1

图1 心肌微血管内皮细胞鉴定(×400)
CMECs增殖能力的检测:与对照组(0.411±0.020)相比,SI/R组(0.180±0.010)吸光度值明显下降( P<0.01)。再灌注时与SI/R组比,SI/R+rhEPO组以rhEPO作用于CMECs后,吸光度值显著增高为0.245±0.015(P<0.05),SI/R+HBSP组以不同浓度的HBSP(2.5 ng/ml、25 ng/ml、50 ng/ ml、100 ng/ml)作用于CMECs后,吸光度值均增高,分别为0.241±0.011、0.320±0.010、0.282±0.014、0.263±0.017(P<0.05);不同浓度的HBSP相比,中浓度HBSP(25 ng/ml)时,CMECs增殖能力最强(图2)。此浓度为最适浓度,后续研究保护机制的实验用此浓度进行。
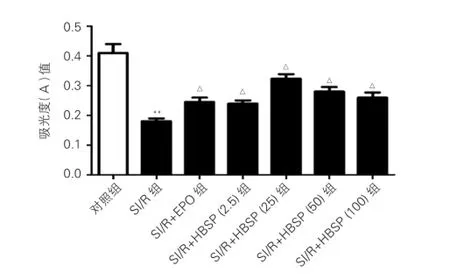
图2 噻唑蓝(MTT)比色法检测心肌微血管内皮细胞增殖能力
HBSP对SI/R诱导的凋亡的影响:与对照组(3.54%±0.21%) 相比,SI/R组(41.1%±0.8)的CMECs的凋亡率显著增加(P<0.001);与SI/R组(41.1%±0.8%)相比,rhEPO组(25.5%±0.43%)凋亡率降低(P<0.01);与SI/R组和SI/R+rhEPO组
相比,HBSP(25 ng/ml)组凋亡率显著下降,为16.9%±0.78%(P<0.01)。
CMECs迁移能力比较:细胞划痕实验显示,与对照组相比,再灌注24 h后SI/R组图3E中划痕后的相对距离较宽(细胞迁移能力明显减弱);而与SI/R组相比,SI/R+HBSP组图3F中划痕后的相对距离缩窄(细胞迁移能力增强)。图3
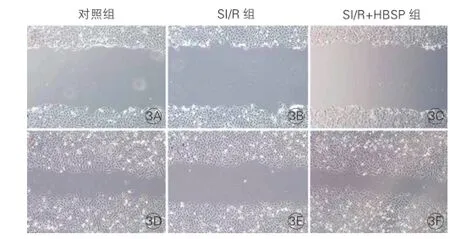
图3 细胞划痕实验检测心肌微血管内皮细胞迁移能力图(×100)
AKT、mTOR、p70S6K蛋白的磷酸化水平改变:Western blot 检测显示,与SI/R组相比,SI/R+HBSP组AKT的磷酸化水平显著增加(P<0.05),这一效应可被PI3K抑制剂LY294002(30 μmol/L)部分抵消(P<0.05),而雷帕霉素(10 nmol/L)的使用则对AKT的磷酸化水平无明显影响(图4A)。
因上游调控AKT的方式之一是依赖PI3K,当使用LY294002后可阻止此信号通路,下调AKT的磷酸化表达;而mTOR位于AKT下游,故雷帕霉素的使用对AKT的活化无影响。与SI/R组相比,SI/R+HBSP组mTOR的磷酸化水平亦有显著性提高,这一效应可被LY294002及雷帕霉素部分抵消(P<0.05,图4B)。
同样,与SI/R组相比,HBSP组mTOR下游分子p70S6K的磷酸化水平也显著性增高,而使用LY294002及雷帕霉素处理后,这一效应被部分消除(P<0.05,图4C)。
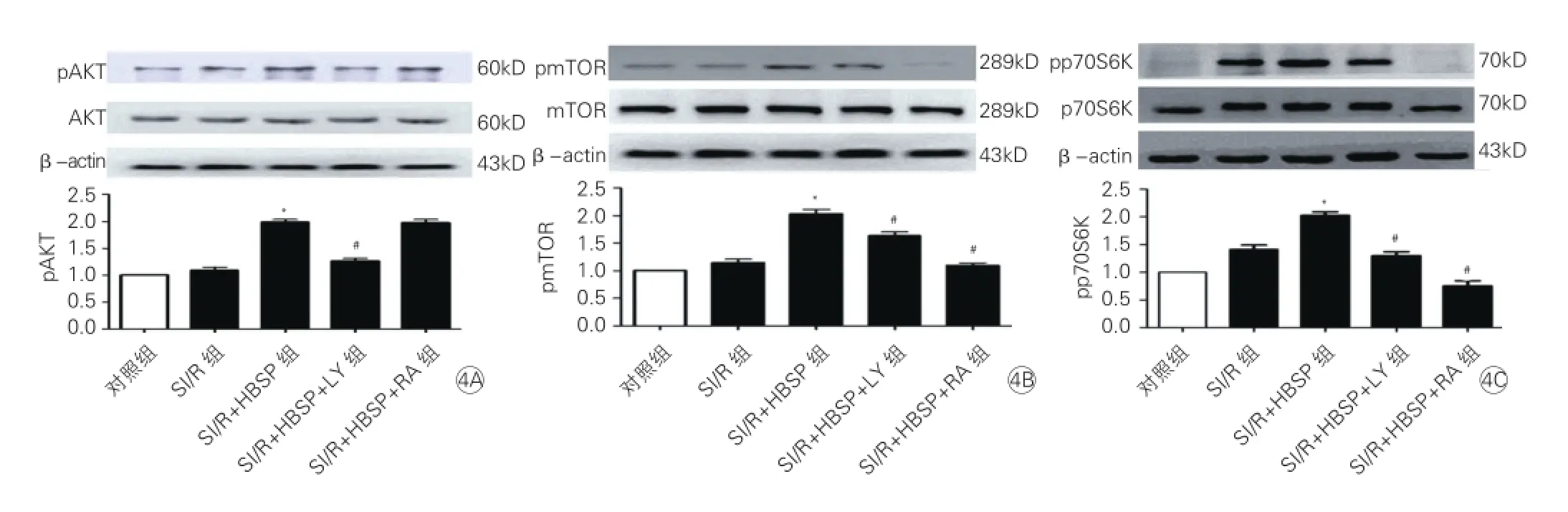
图4 免疫印迹法检测心肌微血管内皮细胞内AKT、mTOR、p70S6K蛋白的磷酸化水平
3 讨论
I/RI机制复杂。近年来研究发现,I/RI在微血管水平的病理变化主要表现为 CMECs 正常屏障功能损伤和细胞凋亡[5]。并且,研究证实在再灌注早期,CMECs的凋亡要早于心肌细胞, 并可通过释放一些炎性介质,促发心肌细胞凋亡,提示减少再灌注后CMECs 的凋亡将对抑制心肌I/RI具有重要作用[10]。
促红细胞生成素(EPO)是由肾脏合成并分泌的一种激素。以往研究发现EPO在减少I/RI心肌细胞凋亡、缩小梗死面积、改善梗死后心功能和心肌重构等方面有重要保护作用[11]。然而,研究数据显示,EPO发挥组织保护作用的最低浓度要远高于其发挥促红细胞生成作用的最低浓度,在组织损伤初期,需要极高浓度的EPO才能发挥组织保护作用,从而大量红细胞生成导致的不良反应成为难以调和的矛盾[12]。鉴于此,Brines等[3]通过分析EPO空
间构象,合成了一种由11个氨基酸残基构成的线性多肽链(Helix B-surface peptide),并进一步证实HBSP可特异性结合EPO βc受体(CD131),促进神经系统损伤修复,即使重复给药也不会增加红细胞和血小板数量[13]。最新研究显示HBSP可显著减少大鼠心梗模型心肌梗死面积,减少TNF-α诱导的离体心肌细胞凋亡[14]。我们课题组前期研究亦证实,HBSP可抑制在体大鼠心肌缺血/再灌注损伤[4]。
但是,HBSP对大鼠I/RI的离体CMECs是否具有保护作用还不明确。本研究结果显示,I/RI可抑制CEMCs的增殖能力和迁移能力,并可诱导细胞凋亡,与以往文献结果相似[15]。而再灌注时给予HBSP,可显著增加CMECs的增殖能力,提高CMECs的迁移能力,抑制I/RI诱导的CMECs凋亡。近年来研究显示,EPO和HBSP均可通过激活AKT通路显著抑制肿瘤坏死因子-α诱导的离体心肌细胞凋亡[14]。我们的前期研究结果亦证实,HBSP可通过激活PI3K/AKT通路,抑制在体大鼠I/RI[4]。但其对I/RI的离体CMECs的保护作用及其具体机制尚未研究。我们的研究结果显示,与SI/R组相比,HBSP可上调AKT、mTOR、p70S6K蛋白的磷酸化表达;而采用PI3K特异性抑制剂LY294002、mTOR特异性抑制剂雷帕霉素后,与HBSP组相比,AKT等相关蛋白的磷酸化水平显著下降,提示HBSP对I/RI的CMECs的保护作用可能与PI3K/AKT/mTOR通路有关。
由于CMECs在心肌微循环中的特异性,其可作为预测血管功能的指标之一,如何保护I/RI过程中的CMECs,已成为心血管病防治的重要内容之一。心脏内EPO受体也在内皮细胞中表达,而HBSP作为EPO衍生物,可特异性结合EPO受体,故用HBSP治疗能够防止再灌注期内皮细胞凋亡,进而保护心肌,维持血流,且避免了EPO促血栓形成等副作用。由于凋亡活性在再灌注期达到顶峰,所以对于接受溶栓治疗或经皮冠状动脉介入治疗术后的患者应用HBSP治疗可能获得明显的益处。
[1] 程希富, 肖祥彬, 马康华, 等. 促红细胞生成素对大鼠心肌缺血再灌注损伤的保护作用. 中国循环杂志, 2008, 23: 306-309.
[2] Imamura R, Okumi M, Isaka Y, et a1. Carbamylated erythropoietin improves angiogenesis and protects the kidneys from ischemia reperfusion injury. Cell Transplant, 2008, 17: 135-141.
[3] Brines M, Patel NS, Villa P, et al. Nonerythropoietic, tissue-protective peptides derived from the tertiary structure of erythropoietin. Proc Natl Acad Sci USA, 2008, 105: 10925-10930.
[4] 蒋娜, 叶谨, 党晶艺, 等. 促红细胞生成素衍生肽抑制缺血/再灌注损伤诱导的大鼠心肌细胞凋亡. 心脏杂志, 2013, 3: 81-86.
[5] Wei L, Sun D , Yin z, et a1. A PKC-beta inhibitor protects against cardiac microvascula ischemia reperfusion injury in diabetic rat. Apoptosis, 2010, 15: 488-498.
[6] 尹志勇, 魏丽萍, 郝媛媛, 等. LY333531对高糖所致心肌微血管内皮细胞通透性上调的拮抗作用. 细胞与分子免疫学杂志, 2009, 25: 303-305
[7] Li J, Zhang H , Wu F, et a1. Insulin inhibits tumor necrosis factor-α induction in myocardial ischemia/reperfusion: role of Akt and endothelial nitric oxide synthase phosphorylation. Crit Care Med, 2008, 36: 1551-1558.
[8] Wang J, Hong Z, Zeng C, et al. NADPH oxidase 4 promotes cardiac microvascular angiogenesis after hypoxia/reoxygenation in vitro. Free Radic Biol Med, 2014, 69: 278-288.
[9] Su TF, Zhao YQ, Zhang LH, et al. Electroacupuncture reduces the expression of proinflammatory cytokines in inflamed skin tissues through activation of cannabinoid CB2 receptors. Eur J Pain, 2012, 16: 624-635.
[10] Buja LM. Myocardial ischemia and reperfusion injury. Cardiovasc Pathol, 2005, 14: 170-175.
[11] 金鑫, 李拥军. 促红细胞生成素治疗急性冠脉综合症研究现状. 中国循环杂志, 2010, 25: 238-240.
[12] Yuan R, Maeda Y, Li W, et a1. Erythropoietin:a potent inducer of peripheral immune/inflammtory modulation in autoimmune EAE. PloS one, 2008, 3: 1924.
[13] Robertson CS, Cherian L, Shah M, et al. Neuroprotection with an Erythropoietin Mimetic Peptide (pHBSP) in a Model of Mild Traumatic Brain Injury Complicated by Hemorrhagic Shock. J Neurotrauma, 2011, 29: 1156-1166.
[14] Ueba H, Brines M, Yamin M, et al. Cardioprotection by a nonerythropoietic, tissue-protective peptide mimicking the 3D structure of erythropoietin. Proc Natl Acad Sci USA, 2010, 107: 14357-14362.
[15] 马文帅, 李兰荪, 王海昌. 白藜芦醇对心肌微血管内皮细胞缺血再灌注损伤的保护作用. 中华老年心血管病杂志, 2009, 11: 527-530.
Investigation of Helix B-surface Peptide Protecting the Cardiac Micro-vascular Endothelial Cell Injury by Ischemia/reperfusion in Experimental Rats
WANG Chen, SI Rui, ZHANG Ming-ming, YU Wen-jun, HAO Qi-meng, ZHANG Rong-qing, WANG Hai-chang.
Department of Cardiology, Xijing Hospital, Fourth Military Medical University, Xi’an (710032), Shan’xi, China
Objective: To investigate the effect of Helix B-surface peptide (HBSP) reducing the cardiac micro-vascular endothelial cells (CMECs) injury by ischemia/reperfusion (I/R) in experimental rats with possible mechanisms.
Helix B-surface peptide; Cardiac micro-vascular endothelial cells; Ischemia/reperfusion injury; Apoptosis
2014-10-18)
(编辑:许 菁)
国家自然科学基金(81200100)
710032 陕西省西安市,中国人民解放军第四军医大学第一附属医院 心内科
王琛 硕士研究生 主要从事心血管病学研究 Email: wangchen1398@sina.com 通讯作者:王海昌 Email: wanghc@fmmu.edu.cn
R54
A
1000-3614(2015)03-0280-05
10.3969/j.issn.1000-3614.2015.03.020
