屋尘螨变应原 Derp1对人肥大细胞HMC-1释放类胰蛋白酶的影响
2015-12-14王朵勤沈燕芸徐金华
唐 慧 王朵勤沈燕芸 徐金华
·论著·
屋尘螨变应原 Derp1对人肥大细胞HMC-1释放类胰蛋白酶的影响
唐 慧 王朵勤#沈燕芸 徐金华∗
目的: 明确屋尘螨变应原Derp1对人肥大细胞系HMC-1释放类胰蛋白酶的影响。方法:培养后的HMC-1细胞分为单纯培养液组、5μg/mLDerp1组和5μg/mLDerp1+100μmol/LPAR2拮抗剂(FSLLY)组,用ELISA方法检测各组类胰蛋白酶水平,显微镜观察HMC-1细胞脱颗粒率。结果:培养液组,Derp1组和Derp1+FSLLRY组中类胰蛋白酶水平分别为31.12±3.60 ng/mL、70.40±1.55 ng/ mL和56.72±2.66 ng/mL。Derp1组和Derp1+FSLLRY组肥大细胞脱颗粒率分别为66.67%和16.67%。结论: 屋尘螨变应原Derp1可以通过激活人肥大细胞HMC-1表面PAR2受体引起肥大细胞脱颗粒释放类胰蛋白酶。
屋尘螨; 肥大细胞; 蛋白酶激活受体2; 类胰蛋白酶
瘙痒几乎是所有过敏性皮肤病的共同症状,尤其是慢性瘙痒可严重影响患者的生活质量,如何控制慢性瘙痒也是临床的难题之一。肥大细胞是瘙痒发生中的关键细胞之一,其活化脱颗粒后可产生多种介质,如组胺、类胰蛋白酶等。1类胰蛋白酶是重要的致痒介质,通过神经源性的机制调节皮肤的免疫,并参与瘙痒的发生。2屋尘螨是引起过敏性皮肤病或其他系统过敏性疾病的最常见的环境变应原之一。也是蛋白酶激活受体2(PAR2)的天然受体。3因此本实验旨在研究屋尘螨变应原Derp1通过PAR2信号通路对人肥大细胞HMC-1脱颗粒释放类胰蛋白酶水平的影响。
1 材料与方法
1.1 材料 人肥大细胞HMC-1细胞株由Butterfield实验室(Mayo Clinic,Rochester,USA)馈赠,类胰蛋白酶ELISA试剂盒购自美国RND公司,SLIGRL-NH2 (PAR2活化剂)、和FSLLRY(PAR2抑制肽)购自Tocris公司,屋尘螨Derp1购自abnova公司,倒置显微镜(Nikon,Japan),细胞培养箱(Thermo electron co,USA),胎牛血清(Gibco),青霉素(Gibco),Poly-L-lysine(Sigma,USA)。
1.2 人肥大细胞HMC-1培养与激发4HMC-1细胞接种于75 cm2培养瓶内,用细胞培养液0%(v/v)胎牛血清(FBS),20 mmol/L 4-羟乙基哌嗪乙磺酸,0.01%(v/v)硫代甘油,2 mmol/L L-谷氨酰胺,链霉素和盘尼西林/青霉素)于37℃、5%(v/v)CO2、湿度为95%的无菌环境培养箱中培养。收集对数生长期的细胞,用血球计数板计数,6孔板每孔5×105,设3个重复,将5μg/mL Derp1、100μmol/L FSLLY+5μg/
mL Derp1及细胞培养液分别处理细胞,于30 min后终止反应,4℃条件下1500 r/min离心10 min后收集上清置于-80℃备用。
1.3 ELISA方法检测类胰蛋白酶水平 用类胰蛋白酶ELISA试剂盒按照操作说明检测上述实验收集的上清液中类胰蛋白酶水平。
1.4 人肥大细胞HMC-1脱颗粒率 将HMC-1用Poly-L-lysine固定至载玻片上,用凡士林固定在显微镜槽中,在显微镜下观察用 5μg/m L Derp1、100 μmol/L FSLLY+5μg/mL Derp1及细胞培养液分别处理HMC-1细胞30 min前后观察细胞形态变化,对HMC-1细胞的脱颗粒情况进行统计。肥大细胞脱颗粒计数标准为,肥大细胞细胞膜破裂且有颗粒散落在周围认为为肥大细胞脱颗粒。脱颗粒率=脱颗粒肥大细胞/肥大细胞总数×100%。5
1.5 统计学方法 全部数据均采用SPSS 19.0分析,两组间比较采用t检验,P<0.05时为有显著统计学差异。
2 结果
2.1 屋尘螨变应原Derp1对人肥大细胞HMC-1释放类胰蛋白酶水平的影响 见表1、图1。Derp1和细胞培养液组分别作用于HMC-1 30 min后类胰蛋白酶水平分别为70.40±1.55 ng/mL及31.12±3.60 ng/ mL。经统计,屋尘螨变应原Derp1组释放类胰蛋白酶的水平明显高于细胞培养液组(P<0.05),差别有统计学意义。

表1 不同药物刺激下人肥大细胞HMC-1释放类胰蛋白酶的水平
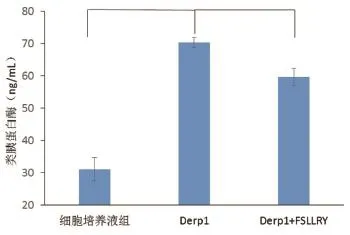
图1 不同药物刺激下人肥大细胞HMC-1释放类胰蛋白酶的水平
2.2 屋尘螨变应原Derp1和PAR2抑制剂FSLLY联合作用对人肥大细胞HMC-1释放类胰蛋白酶水平的影响 见表1、图1。Derp1与 FSLLY共同作用HMC-1 30 min后类胰蛋白酶水平为56.72±2.66 ng/ mL,较Derp1单独作用时明显降低(P<0.05),较细胞培养液组依然明显增高(P<0.05),差别有统计学意义。
2.3 屋尘螨变应原Derp1对人肥大细胞HMC-1脱颗粒水平的影响 见图2a及2b细胞培养液孵育HMC-1 30 min后,显微镜视野内的细胞处于稳定状态,细胞膜表面光滑,见图3a及3b,Derp1作用于HMC-1 30 min后,细胞发生了明显的脱颗粒情况,肥大细胞脱颗粒率为66.67%。
2.4 屋尘螨变应原Derp1和PAR2抑制剂FSLLY联合作用对肥大细胞HMC-1脱颗粒水平的影响 见图4a和4b。相比较于Derp1组,Derp1与FSLLRY共同作用于HMC-1 30 min后,细胞脱颗粒情况被明显抑制,肥大细胞脱颗粒率为16.67%。
3 讨论
过敏性皮肤病是皮肤科的常见病,发病率逐年增多,部分患者还同时合并哮喘或过敏性鼻炎等其他过敏性疾病。常见的过敏性皮肤病中,瘙痒是其共同的症状,但是目前针对慢性瘙痒却缺乏切实有效的治疗手段。反复的瘙痒-搔抓的恶性循环除了会加剧皮疹之外,还会严重影响患者的身心健康和生活质量。因此如何防治慢性瘙痒应当是目前皮肤科的研究重点之一。
以往大规模的变应原检测,发现吸入性变应原(主要是屋尘螨和粉尘螨)是引起过敏性皮肤病的重要诱因6而且在具有慢性瘙痒的特应性皮炎等疾病中,持续性的接触屋尘螨与疾病的加重有关。7既往研究认为,屋尘螨可通过I型变态反应诱导肥大细胞释放组胺引起瘙痒,但这只能解释部分情况。8现有研究发现屋尘螨的提取物通过活化PAR-2,可导致呼吸道黏膜下腺体的分泌增加,并可以引起肺的感觉神经元细胞内钙离子内流增加,9,10由此可见屋尘螨可以通过与PAR-2的作用参与疾病的发生。PARs属于与G蛋白偶联受体家族,有四个成员:PAR1、PAR2、PAR3和PAR4。11,12PAR2分布于各种组织和细胞表面,主要包括人皮肤肥大细胞、上皮细胞、活化的内皮细胞、肌细胞、神经元和星形细胞等。9,10肥大细胞是瘙痒发病中的关键细胞之一,其释放的组胺和类胰蛋白酶都是重要的致瘙痒的介质,尤其是后者与慢性瘙痒密切相关。13因此我们针对屋尘螨变应原-PAR2信号通路-肥大细胞-类胰蛋白酶途径进行研究,以期阐明这一途径的分子机制。
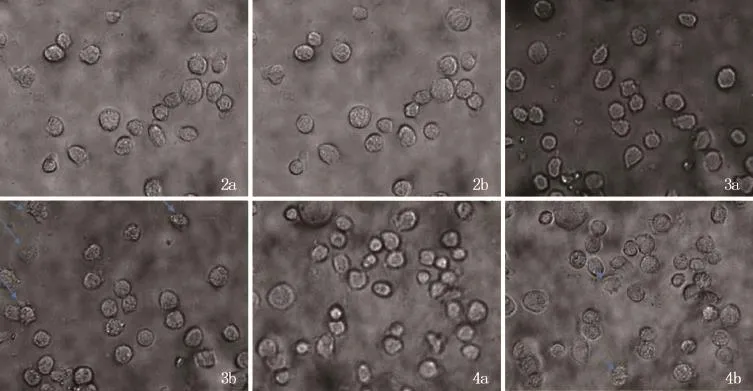
图2 细胞培养液孵育30min后,显微镜视野内的人肥大细胞HMC-1处于稳定状态,细胞膜表面光滑 a:细胞培养液孵育前;b:细胞培养液孵育30min后 图3 屋尘螨变应原Derp1孵育后,人肥大细胞HMC-1发生了明显的脱颗粒情况 a:屋尘螨变应原Derp1孵育前;b:屋尘螨变应原Derp1孵育30 min后 图4 屋尘螨变应原Derp1与拮抗剂FSLLRY共同孵育后,人肥大细胞HMC-1脱颗粒情况被明显抑制 a:屋尘螨变应原Derp1与拮抗剂FSLLRY共同孵育前;b:屋尘螨变应原Derp1与拮抗剂FSLLRY共同孵育30 min后
本实验研究发现PAR2激活剂SLIGRL-NH2可明显引起人肥大细胞HMC-1类胰蛋白酶释放,证实了HMC-1细胞表面PAR2受体的存在。屋尘螨变应原Derp1单独作用于HMC-1细胞可明显引起HMC-1细胞脱颗粒释放类胰蛋白酶,其水平明显高于正常对照,表明屋尘螨变应原Derp1是人肥大细胞HMC-1活化的重要刺激物。而将屋尘螨变应原Derp1与PAR2拮抗剂FSLLRY共同作用于HMC-1细胞时,可部分抑制HMC-1细胞脱颗粒引起类胰蛋白酶的释放,因此我们认为屋尘螨变应原Derp1可以通过激活人肥大细胞HMC-1表面PAR2受体引起肥大细胞脱颗粒释放类胰蛋白酶,但这并不是唯一途径。本研究通过对屋尘螨变应原-PAR2信号通路-肥大细胞-类胰蛋白酶这一途径的研究,明确其在慢性瘙痒中所发挥的作用及其分子机制,从而为临床新的治疗提供切实的理论基础,为真正解决临床实际问题提供帮助。
1Xie H,He SH.Roles of histamine and its receptors in allergic and inflammatory bowel diseases.World J Gastroenterol,2005,11:2851-2857.
2Ribatti D,Ranieri G.Tryptase,a novel angiogenic factor stored inmast cell granules.Exp Cell Res,2015,332(2):157-162. 3 Steinhoff M,Buddenkotte J,Shpacovitch V,et al.Proteinaseactivated receptors:transducers ofproteinase-mediated signaling in inflammation and immune response.Endocr Rev,2005,26:1-43.
4Wang L,Ding G,Gu Q,et al.Single-channel properties of a stretch-sensitive chloride channel in the human mast cell line HMC-1.Eur Biophys J,2010,39(5):757-767.
5 Zhang D,Spielmann A,Wang L,etal.Mast-cell degranulation induced by physical stimuli involves the activation of transientreceptor-potential channel TRPV2.Physiol Res,2012,61(1): 113-124.
6秦晓蕾,徐金华,唐慧,等.1195例过敏性皮肤病变应原皮肤点刺试验结果分析.中国麻风皮肤病杂志,2007,23(11):941-943.
7 Choi JS,Ryu HR,Yoon CH,et al.Treatment of patients with refractory atopic dermatitis sensitized to house dustmites by using sublingual allergen immunotherapy.Ann Dermatol,2015,27 (1):82-86.
8 Rajan TV.The Gell-Coombs classification of hypersensitivity reactions:a re-interpretation.Trends Immunol,2003,24:376-379.
9 Cho HJ,Lee HJ,Kim SC,et al.Protease-activated receptor 2-dependent fluid secretion from airway submucosal glands by house dustmite extract.JAllergy ClinImmunol,2012,129(2): 529-535.
10 Gu Q,Lee LY.House dustmite potentiates capsaicin-evoked Ca(2+)transients inmouse pulmonary sensory neurons via activation of protease-activated receptor-2.Exp Physiol,2012,
97(4):534-543.
11D’Andrea MR,Rogahn CJ,Andrade-Gordon P.Localization of protease-activated receptors-1 and-2 in humanmast cells: indications for an amplified mast cell degranulation cascade. Biotech Histochem,2000,75(2):85-90.
12 Shpacovitch VM,Brzoska T,Buddenkotte J,et al.Agonists of proteinase-activated receptor 2 induce cytokine release and activation of nuclear transcription factor kappaB in human dermal microvascular endothelial cells.J Invest Dermatol,2002,118: 380-385.
13 Kempkes C,Buddenkotte J,Cevikbas F,etal.Role of PAR-2 in Neuroimmune Communication and Itch.Itch:Mechanisms and Treatment.Boca Raton(FL):CRC Press,2014,Chapter 11. (收稿:2015-01-23 修回:2015-02-21)
Effect of house ductm ite Derp1 on the secretion of tryptase from human mast cell line HMC-1
TANG Hui,WANGDuo-qin,SHEN Yan-yun,et al.Department ofDermatology,Huashan Hospital,Fudan U-niversity,Shanghai,200040
Objective:To determine the effect of house dustmite Derp1 on the secretion of typtase from human mast cell line HMC-1.Methods:After cultured HMC-1 cellswere incubated respectivelywith Derp1 5μg/mL and Derp1 5μg/mL+PAR2 antagonist(FSLLY)100μmol/L.The level of typtase from HMC-1 cells was detected by ELISA.The degranulation of HMC-1 cells was observed under microscope.Results: The levels of the typtase from HMC-1 cells in culturemedium group,Derp1 group and Derp1 combined FSLLY group were 31.12±3.60 ng/mL,70.40±1.55 ng/mL and 56.72±2.66 ng/mL,respectively.The degranulation rates in Derp1 group and Derp1 combined FSLLY group were 66.67%and 16.67%.Conclusion:The PAR2 receptor can be activated by house dustmite Derp1,which results in typtase secretion of the human mast cell line HMC-1.
house dustmite;mast cell;protease activated receptor 2;typtase
国家自然科学基金青年项目(编号:81402603)上海市卫生局青年科研项目(编号:20124y032)
复旦大学附属华山医院,上海,200040#为共同第一作者∗通信作者
