超顺磁微球快速吸附去除水中镍离子的研究
2015-12-13张铃苏洪凤林黄胤圣林幼文陈颖卢露肖旺钏
张铃苏,洪凤林,黄胤圣,林幼文,陈颖,卢露,肖旺钏
(三明学院资源与化工学院,福建三明365004)
超顺磁微球快速吸附去除水中镍离子的研究
张铃苏,洪凤林,黄胤圣,林幼文,陈颖,卢露,肖旺钏
(三明学院资源与化工学院,福建三明365004)
采用多元醇法制备得到表面包覆聚丙烯酸、平均粒径约为134 nm,平均晶粒度约6.5 nm的超顺磁Fe3O4微球,该微球具有好的磁响应性,系统研究了pH值、吸附时间、微球用量对吸附去除水中痕量镍离子的影响。结果表明,pH=6时,微球对水中镍离子的吸附去除效率可达98%,50 Min可达到吸附平衡,最大吸附量可以达到68 mg·g-1。该研究为超顺磁微球吸附去除工业废水中痕量重金属离子提供了实验参考。
微球;吸附;镍离子
随着现代工业的不断发展,工业废水的排放成为一个社会关注的焦点,工业废水中重金属排放给人类带来了极大的危害[1-2]。重金属废水治理的传统方法有吸附、离子交换、微滤膜、反渗透、电渗析法、化学沉淀、氧化还原、电化学,其中吸附是最常使用的方法之一[3-6]。镍在电镀行业中的使用较多,镀液中主要含有硫酸镍和氯化镍。镍及其化合物有毒,镍在废水中主要以游离态存在,废水中的镍可在土壤中富集,镍进入人体后主要存在于脊髓、脑、五脏中,以肺为主,其毒性主要体现在抑制酶系统[7-8]。在重金属离子常用的吸附剂为活性炭和高分子化合物[9],但是活性炭吸附镍离子后不能重复利用,成本高,高分子化合物吸附后不容易从水中分离出来,因此寻找新的高效、低成本的重金属离子吸附剂具有重要的研究意义。
纳米材料具有比表面积大和表面原子配位不足的特性,所以有良好的吸附性能。利用纳米材料的强吸附性可以去除水中的重金属离子[10-13]。纳米磁颗粒吸附重金属离子后在外磁场作用下可分离富集,撤去外磁场后可重新分散,在重金属离子吸附应用中具有独特的优势[14]。纳米磁颗粒的粒径越小,比表面积越大,吸附量越高,但是在实际应用中,粒径太小,磁响应弱,难以被外磁场捕获富集。为了吸附重金属离子后便于磁富集,单个纳米磁颗粒的粒径必须控制在超顺磁临界尺寸附近并包覆大量的亲水性高分子[15],而粒径更小的超顺磁纳米粒子则要组装成粒径超过100 nm的团簇[16]。目前,超顺磁微球的制备方法都采用溶剂热法,最近几年开发的多元醇方法合成超顺磁微球具有优势,一般是以多元醇为溶剂,三氯化铁为铁源,加上碱性水解剂和稳定剂,然后把上述溶液置于高压反应釜中,控制温度200℃左右,反应3~72 h,可得到不同粒径的微球[17-19]。但是现有的多元醇法均采用固定碱性水解剂,如以尿素为碱性水解剂,压力大,对设备要求高,不利于大规模制备。本课题组采用本文采用乙二醇和3-氨基丙醇的混合液为溶剂,以无水FeCl3为铁源,3-氨基丙醇为碱性水解剂,聚丙烯酸为稳定剂合成了超顺磁Fe3O4微球,通过改变乙二醇和3-氨基丙醇的比例,可以调节微球大小和组成微球的颗粒大小,微球具有良好的超顺磁性[20]。
本文在先前的基础上制备粒径为134 nm的超顺磁微球,并研究了微球对水中镍离子的吸附效果,考察了pH、微球用量和吸附时间等对吸附效果的影响,为微球在重金属离子吸附的应用提供实验参考。
1 实验部分
1.1试剂和仪器
1.1.1主要实验试剂
三氯化铁(AR,阿拉丁化学有限公司);3-氨基丙醇(AR,阿拉丁化学有限公司);无水乙醇(AR,广东光华科技股份有限公司);乙二醇(AR,阿拉丁化学有限公司);聚丙烯酸(PAA)(AR,阿拉丁化学有限公司);镍离子标准溶液(AR,阿拉丁化学有限公司)。
1.1.2主要实验仪器
电子天平(FA2204B,上海精科天美科学仪器有限公司);电热恒温鼓风干燥箱(DHG-9070A,上海基玮电器有限公司);超声波清洗器(8K1200H,上海科导超声仪器有限公司);真空干燥箱(DZF-6053,上海齐欣科学仪器有限公司);调速多用振荡器(HY-4,金坛市城东新瑞仪器厂);移液枪(1-100μL,德国BRAND公司);移液枪(100-1000μL,德国BRAND公司);水热合成反应斧(ZNKH-20,上海羌强仪器有限公司);离心机(800,菏泽市石油化工学校仪器设备厂);火焰原子吸收分光光度计(GBC932plus,苏州科力华电子有限公司)。
1.2微球的制备
微球的制备在文献[17]的基础上进行改进,具体为:无水氯化铁0.1625 g加入到12 mL乙二醇中,超声辅助溶解,接着加入0.2165 g聚丙烯酸,并超声至全部溶解,再向溶液中加入3 mL 3-氨基丙醇,混合均匀,把溶液移入20 mL水热反应釜中,置于鼓风干燥箱中,200℃恒温6 h,反应后随炉冷却。待釜冷却至室温后,得黑色胶状液体,加入50 mL水,磁铁辅助分离洗涤5次,最终固体分散在5 mL水中。取一定量的超顺磁微球真空烘干,计算出超顺磁微球溶液的浓度。
1.3吸附试验
本实验主要研究pH、微球用量和吸附时间等因素对吸附效果的影响。取一定量的超顺磁微球水分散液加入到20 mL不同浓度的Ni2+溶液中,恒温振荡一定时间,用强力磁铁使超顺磁微球与溶液分离,取上清液,用火焰原子分光光度计测定上清液中Ni2+浓度。利用公式1、2计算比吸附量Q与吸附率E。

式中:C0和C分别为镍离子溶液的初始浓度和吸附后的浓度(mg·L-1);V为镍离子溶液的体积(mL);m为超顺磁微球的质量(g)。
1.4样品表征
微球形貌及大小分布:将磁性微球水分散液稀释到合适浓度,然后把磁微球分散液滴到喷碳膜的铜网上,自然晾干后,采用透射电镜(TEM)(JEM-2010,JEOL,日本电子株式会社)观察磁性Fe3O4微球的形貌、粒径大小和分布;表面有机物含量:采用热重分析仪(TGA)(TG209,NETZSCH)对样品中Fe3O4的含量进行表征,升温速度为10°C/min,最终温度1000°C;晶相分析:取上述固体粉末,用X射线衍射仪(XRD,日本理学,D/max-2200/PC),计算磁性Fe3O4微球的形貌、粒径大小和平均晶粒度。衍射峰扫描范围10°~70°,扫描速度4°/min。
2 结果与讨论
2.1微球表征
2.1.1透射电镜分析
图1为所得微球的透射电镜照片及粒径分布。从图1a看出,微球呈球形,大小均一,平均粒径约134 nm(图1b)。图1c看出,每个微球都是由很多小颗粒组成,高分辨率透射电镜照片(图1d)可以看出,晶面间距为0.253 nm,对应为Fe3O4的(311)晶面,与文献一致[20],初步证实为Fe3O4。
2.1.2 X-射线衍射分析
从图2看出,在2θ=30.11°,35.41°,43.11°,53.41°,57.11°和62.61°的各个角度与文献中分别对应为反尖晶石型Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)晶面所在的这6个特征衍射峰一致[20],进一步证实产物为Fe3O4。根据谢乐公式,利用(311)衍射峰计算出平均晶粒大小约为6.5 nm。

图1微球的透射电镜照片

图2微球的X-射线衍射图
2.1.3热失重分析
图3为微球的热失重曲线。从图中看出,30~150℃之间的失重对应为游离水或结合水的蒸发[20],失重量为1.5%,微球在150~1000℃之间有两个失重峰,其中150~450℃之间的失重对应为聚丙烯酸游离羧基和碳链的热分解,失重量为12.1%,450~1000℃之间的失重对应为配位羧基的热分解,失重量为10.4%,表面有机物总含量22.5%。
2.1.4磁性分析
图4为该样品的室温磁滞回线,可以看出298 K时,Fe3O4微球矫顽力为零无剩磁现象,表现为超顺磁性,虽然微球的粒径远大于Fe3O4超顺磁临界尺寸(30 nm)[19],但组成微球的Fe3O4粒子的晶粒度小于临界尺寸。因此从图中看出,样品的剩磁几乎为零,因而微球在室温下表现为超顺磁性。

图3微球热失重曲线

图4室温磁滞回线
2.2微球吸附去除水中镍离子
2.2.1微球用量对镍离子吸附去除效果的影响
图5为固定溶液pH=6和镍离子浓度为1.0 mg·L-1,微球用量对Ni2+镍离子吸附去除效果的影响。从图中看出,超顺磁微球对Ni2+的吸附去除率随着微球用量的增加而增加,在微球用量为450μL时,镍离子去除率达到97.5%,最大吸附量可以达到68 mg·g-1,进一步增加微球用量,仍然无法把镍离子完全除去,原因是镍离子在微球表面的吸附与解吸附达到了平衡。
2.2.2 pH值对吸附去除效果的影响
固定镍离子浓度为1.0 mg·L-1,调节溶液pH,在不同pH的镍离子溶液中分别加入100μL超顺磁微球,振荡吸附2 h,用强力磁铁使超顺磁微球与溶液分离,上清液用火焰原子分光光度计测定Ni2+浓度,结果如图6。当pH<6.0时,吸附率随pH值增大而增大,原因是微球表面羧基与镍离子配位能力随着pH增大而增强;当pH=6.0时,吸附率达到最大值;当7.40>pH>6.00时吸附率下降,原因是镍离子部分形成沉淀,导致镍离子浓度降低,吸附率下降;当pH>7.40时吸附率一直增加原因是镍离子随着pH增加,沉淀越完全,导致溶液中镍离子浓度进一步降低,上层清液检测到游离的镍离子浓度很小。
2.2.3吸附时间对吸附去除效果的影响
固定镍离子浓度为1.0 mg·L-1,向溶液中加入100μL超顺磁微球溶液,振荡器反应在10、20、30、40、50、60、90 min时分别取用磁铁辅助分离超顺磁微球与溶液,取上清液,用火焰原子分光光度计测定上清液中Ni2+浓度,结果如图7。由实验数据和图表可知,在50 min以前,吸附率随吸附时间的增加而增大,在50 min后吸附率趋于稳定,原因是在50 min以前超顺磁微球表面的活性位点随时间的增加不断吸附溶液中的金属离子,在50 min后达到了吸附平衡,超顺磁微球表面的活性位点被金属离子全部结合,所以随着吸附时间的增加吸附率趋于平稳。
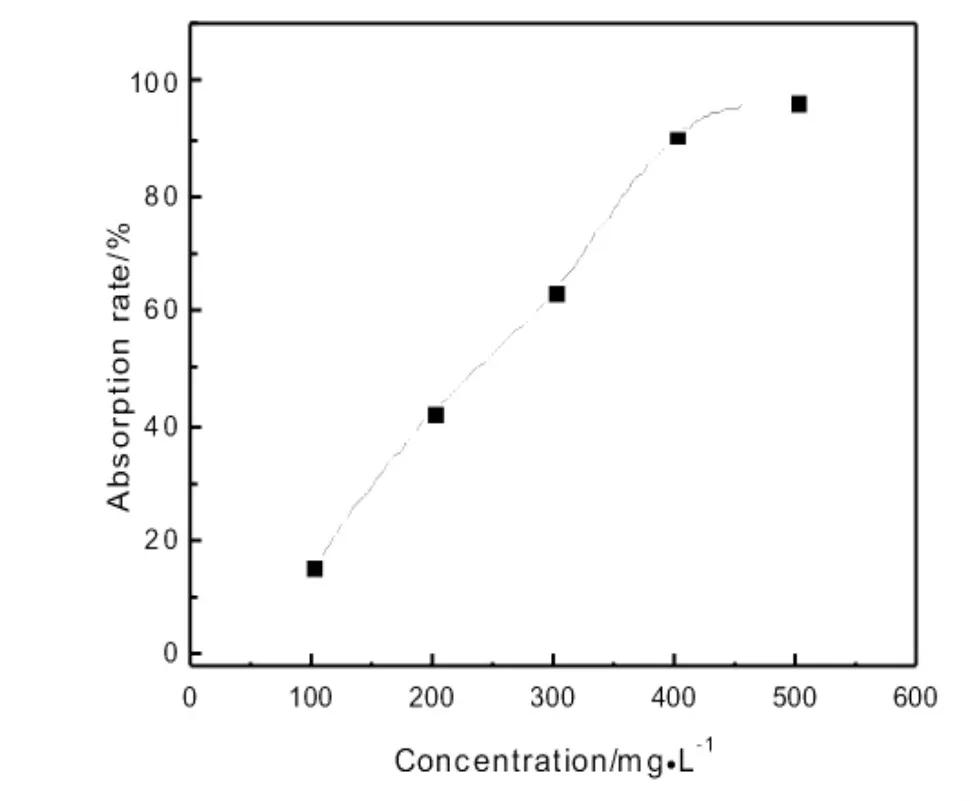
图5微球用量对Ni2+吸附去除效果的影响
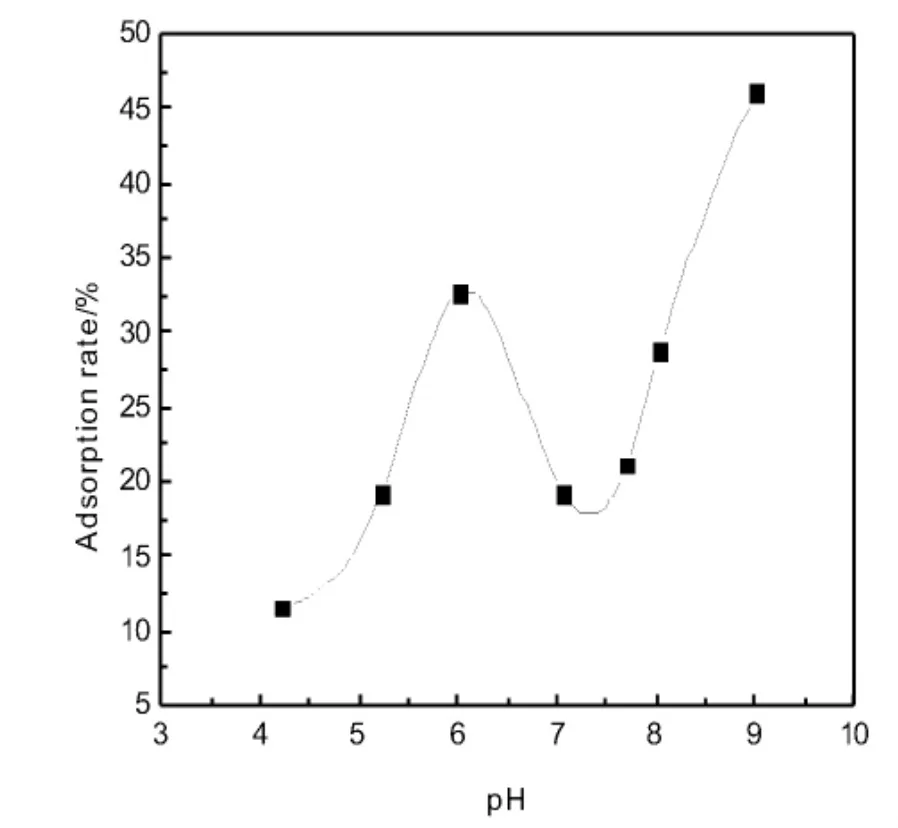
图6 pH对吸附效果的影响
3 结论
采用多元醇法制备得到表面包覆聚丙烯酸、平均粒径约为134 nm,平均晶粒度约6.5 nm的超顺磁Fe3O4微球。超顺磁微球表面包覆聚丙烯酸,含有大量的羧基,可以吸附废水中的金属离子,超顺磁微球对镍离子的吸附率随吸附时间的延长,在50 min达到吸附饱和,在pH=6.0时,最大吸附量可以达到68 mg·g-1,去除效率可达98%。该研究为超顺磁微球吸附去除工业废水中痕量重金属离子提供了实验参考。

图7吸附时间对吸附效果的影响
[1]胡洪营,赵文玉,吴乾元,等.工业废水污染治理途径与技术研究发展需求[J].环境科学研究,2010,23(7):861-868.
[2]梅光泉.重金属废水的危害及治理[J].微量元素与健康研究,2004,21(4):54-56.
[3]马前,张小龙.国内外重金属废水处理新技术的研究进展[J].环境工程学报,2007,1(7):10-14.
[4]吴彦军,张林楠,李振山.重金属废水无害化处理技术最新进展[J].工业水处理,2009,29(3):1-3.
[5]邓景衡,余侃萍,肖国光,等.吸附法处理重金属废水研究进展[J].工业水处理,2014,34(11):4-7.
[6]李东伟,袁雪,王克浩,等.化学沉淀-铁氧体法处理重金属废水试验研究[J].重庆建筑大学学报2007,29(2):90-93.
[7]李姣.化学沉淀法处理电镀废水的实验研究[D].长沙:湖南大学,2010.
[8]王宗海.络合-超滤技术处理镍离子废水[D].大连:大连理工大学,2008.
[9]赵红艳,张水花,史俊友,等.氧化腐殖酸对N i2+、Cu2+、Zn2+的吸附性能[J].江苏农业科学,2014,42(4):331-334.
[10]RAHMAN IA,MOUSAVIH,FAZLIM.Effect of nanostructure alum ina on adsorption of heavy metals[J].Desalination,2010,253:94-100.
[11]DEBNATH S,BISWASK,GHOSH U.Removal of Ni(II)and Cr(VI)with titanium(IV)oxide nanoparticle ag-glomerates in fixed-bed columns[J].In Eng Chem Re,2010,49:2031-2039.
[12]CAO C Y,QU J,WEIF,et al.Superb adsorption capacity and mechanism of flowerlike magnesium oxide nanostructures for lead and cadm ium ions[J].ACSAppl Mat Interfaces,2012(4):4283-4287.
[13]MAHDAVI S,JALALI M,AFKHAM I A.Removal of heavy metals from aqueous solutions using Fe3O4,ZnO,and CuO nanoparticles[J].JNanopart Re,2012,14:1-18.
[14]HUA M,ZHANG S,PAN B,et al.Heavymetal removal from water/wastewater by nanosized metaloxides:A review[J].J Hazard Mater,2011,211/212:317-331.
[15]WANG L,LI J,JIANG Q,et al.water-soluble Fe3O4nanoparticlesw ith high solubility for removal of heavy-metal ions from waste water[J].Dalton Tra,2012,41:4544-4551.
[16]LIU J,ZHAO Z,JIANG G.Coating Fe3O4magnetic manoparticlesw ith hum ic acid for high efficient removal of heavy metals in water[J].Environ Sci Technol,2008,42:6949-6954.
[17]XUAN S,WANG Y J,YU JC,etal.Tuning the grain size and particle size of superparamagnetic Fe3O4Microparticles[J].Chem Mater,2009,21:5079–5087.
[18]CHENG C M,XU F J,GU H C.Facile synthesis and morphology evolution ofmagnetic iron oxide nanoparticles in different polyol processes[J].New JChem,2011,35:1072–1079.
[19]GEJ,HU Y,BIASIN IM,etal.Superparamagneticmagnetite colloidalnanocrystalclusters[J].Angew Chem IntEd,2007,46:4342-4345.
[20]肖旺钏,王叶敏,王仁章,等.3-氨基丙醇调控合成超顺磁四氧化三铁微球[J].无机化学学报,2014,30(11):2559-2563.
(责任编辑:朱联九)
Fast Removal of Ni2+from Aqueous Solution by Superparamagnetic Magnetite Microspheres
ZHANG Lin-su,HONG Feng-lin,HUANG Yin-sheng,LIN You-wen,CHEN Yin, LU Lu,XIAOWang-chuan
(School of Resources and Chemical Engineering,Sanming University,Sanming 365004,China)
Astract:Superparamagnetic Fe3O4microspheresw ith coating of poly acrylic acid,average diameter of 130 nm and the grain size of 6.5 nm were synthesized by polyol process.Themicrospheres is of fast response in appliedmagnetic field.The influence of pH,absorption time and the amount of themicrospheres on the absorption and removal rate of Ni2+from aqueous solution were investigated.The results indicate that the highest removal rate of 98%and themaximum adsorbing capacity of 68mg·g-1can be obtained under pH=6.0 and absorption time≥50m in.The significance of this study is to provide an experimentalapplication of the Fe3O4Microspheres for fast removalof Ni2+from industrialwaste.
magnetitem icrosphere;absorption;nickel ion
O 631.3
A
1673-4343(2015)06-0076-06
10.14098/j.cn35-1288/z.2015.06.016
2015-03-08
福建省科技厅引导性项目(2015Y01010201);福建省高校杰出青年科研人才培育计划(JA14286);国家级大学生创新训练计划项目(201311311009)
张铃苏,女,福建周宁人,大学生。主要研究方向:超顺磁纳米材料制备及应用。通讯作者:肖旺钏,男,福建尤溪人,讲师。主要研究方向:超顺磁纳米材料的制备及应用。
