4 ℃贮藏期内冷鲜羊肉表面菌相变化分析
2015-12-13周琰冰艾启俊张德权
周琰冰,艾启俊′*,张德权*
(1.北京农学院食品科学与工程学院,北京 102206;2.中国农业科学院农产品加工研究所,北京 100193)
4 ℃贮藏期内冷鲜羊肉表面菌相变化分析
周琰冰1,艾启俊1′*,张德权2′*
(1.北京农学院食品科学与工程学院,北京 102206;2.中国农业科学院农产品加工研究所,北京 100193)
研究4℃条件下贮藏时间对冷鲜羊肉表面菌相组成的影响,以菌落总数为指标,结合菌落聚合酶链式反应法,了解冷鲜羊肉在其贮藏期内的菌群构成,以及随着贮藏时间延长其优势菌群的变化。结果表明,冷鲜羊肉在4℃托盘贮藏条件下,菌落总数随贮藏时间的延长而增加,第7天其菌落总数超过106CFU/g,样品已经腐败变质;其表面主要菌群包括假单胞菌属、芽孢杆菌属、不动杆菌属等。随着贮藏时间的变化,假单胞菌占总菌相的大部分,是造成冷鲜羊肉腐败变质的主要优势菌。
冷鲜羊肉;菌落总数;菌落聚合酶链式反应;4 ℃冷藏;优势菌
近年来,随着经济的飞速发展,我国肉品生产得到了快速提高,据国家统计局公布数据显示,2013年我国肉类总产量8 535万 t,比上年增长1.7%[1]。但是,畜体屠宰及加工过程中损失率高、品质较低、货架期较短等问题一直阻碍着我国肉类产业的发展。
冷鲜肉是指将屠宰后的畜胴体进行冷却处理后,其胴体温度在24 h之内降至0~4 ℃,并在后续加工、运输和销售过程中一直保持此温度的生鲜肉[2]。低温能够抑制大多数酶的活性和微生物的生长繁殖。基于冷鲜肉的各种优势,国家明确指出,要在2015年使冷鲜肉占比提高到30%,可见冷鲜肉将是我国肉类行业发展的必然趋势[3]。畜肉由于受到微生物和酶作用以及环境中温度、氧气、水分等条件的影响,很容易腐败变质。肉品在一定条件下贮藏时,细菌的数目几乎呈线性增加[4]。所以,细菌数目的变化可以作为判断肉品被污染程度以及肉品卫生质量的评判标准之一。因此,冷鲜肉的保鲜要考虑到抑制表面微生物的生长繁殖以及氧化作用造成的肉品质降低。
羊肉在我国相当受欢迎,2013年我国羊肉产量达到408万 t,增长2.0%[1],不仅肉品鲜嫩,营养充足,易于消化,而且进食时不用考虑文化与宗教的禁忌[5]。但是,肉中的微生物来源广泛,品种众多,包含真菌、细菌、病毒等,可分为食物中毒性微生物、致病性微生物以及致腐性微生物三大类群及其他微生物[6]。传统的微生物检测大多以分离纯化培养为基础,再根据菌落形态及生理生化特征确定其类型,但此方法耗时较长,需要1~2 d的培养时间,并对单菌落进行各种生理指标测定来确定其种属,因此,这种传统的研究方法只能作为一种辅助手段,需要与其他方法结合起来才能客观而全面反映微生物群落结构的真实信息。
在食品工业中,生物技术是一种得以让人类生活质量发生进步的科学措施,通过利用生物流程生产细胞或其代谢物质来生产食物并改变以前的生产过程[7]。菌落聚合酶链式反应(polymerase chain reaction,PCR)是一种直接从培养基中获得单个菌落,或者直接分析需要的DNA片段部分的方法[8],它被应用于细菌、酵母、真菌的研究中[9-11]。与普通DNA的PCR不同在于菌落PCR的方法不提取基因组DNA,而是直接以菌体热解后暴露的DNA为模板进行PCR扩增,省时少力,可以快速鉴定菌落是否为含目的质粒的阳性菌落。操作简单、快捷,阳性率较高,结果具有高度的特异性和敏感性,在转化鉴定中较常见[12],还经常用于基因扩增,分类筛选和诊断等实验中[13]。
已有研究[14-16]利用选择培养基的方法分离和鉴定冷鲜羊肉的菌相消长规律,但培养时间长,培养条件要求多,不能快速知晓冷鲜肉表面的菌相情况。而本研究则是以菌落总数为指标,判断托盘包装冷鲜羊肉在4 ℃条件下的贮藏期,并通过菌落PCR方法对冷鲜羊肉贮藏过程中表面微生物的多样性进行研究,从而了解冷鲜羊肉在其贮藏期内的菌群构成,以及随着贮藏时间延长其优势菌群的菌相变化。与前人的方法相比较,菌落PCR节省了鉴定各种微生物生理生化指标的时间,通过返回的序列进行同源性比对,可以得知样品表面的菌相构成并判断其消长规律。
1 材料与方法
1.1 材料与试剂
新鲜羊前腿肉(当天屠宰)购自北京农学院便民超市,返回实验室后将其迅速放入—20 ℃冰箱内1h,使其中心温度降至4 ℃后,取出置于4 ℃冰箱保藏。
营养琼脂、营养肉汤、NaCl(分析纯)、无水乙醇、三羟甲基氨基甲烷、乙二胺四乙酸二钠、冰醋酸 北京蓝弋试剂有限公司;Primer Eu27F、1492R 生工生物工程(上海)股份有限公司;TaKaRa TaqTMPremix、DL2000、Andy Safe核酸染料 北京六合通经贸有限公司。
1.2 仪器与设备
YT-CJ-1ND型超净工作台 北京亚泰科隆实验科技开发中心;TCYQ型全温振荡器 太仓市实验设备厂;MLS-3780型全自动高压蒸汽灭菌锅 日本Sanyo公司;MyCycler Thermal Cycler型PCR仪、76S106783型凝胶成像仪 美国Bio-Rad公司;TE212-L型电子天平 赛多利斯科学仪器(北京)有限公司;BG-subMINI型迷你水平电泳仪 北京百晶生物技术有限公司;BCD-288WSL型冰箱 青岛海尔股份有限公司;DHP-500型电热恒温培养箱 天津市中环实验电炉有限公司;微波炉 广东格兰仕集团有限公司。
1.3 方法
利用传统微生物培养法和菌落PCR技术进行冷鲜羊肉表面微生物种类的分析。
1.3.1 样品准备
取出中心温度已降至4 ℃的羊大腿肉,放置在无菌超净台内,用无菌刀除去其表面筋膜与脂肪,切成约10 g的肉块,随机挑选3 块为一组样品,放入无菌托盘内,用无菌保鲜膜包好后,置于4 ℃冰箱内备用。准备6 组样品,每天测定冷鲜羊肉表面的菌落总数,直至其菌落总数超过国家规定数值。
1.3.2 菌落总数测定
按照GB 4789.2—2010《食品卫生微生物学检验:菌落总数测定》[17]进行测定。
取一份样品置于无菌操作台内,用无菌剪刀剪碎后置于带滤网的无菌均质袋内,倒入90 mL 0.85%已灭菌的生理盐水,均质机拍打1 min,制成1∶10的稀释液,静置5 min后,吸取上清液1 mL于装有9 mL灭菌生理盐水的试管内,制成1∶100的样品匀液,制备10 倍系列稀释样品匀液。
平皿中倒入15 mL左右冷却至50 ℃的营养琼脂培养基,稍转动培养皿后平放在超净操作台,待琼脂凝固后,根据对样品污染情况的估计,选择2~3 个适宜稀释度的样品匀液,吸取100 μL稀释液于培养基表面,用涂布棒涂匀,平板静置10 min后于(36±1)℃恒温培养箱内倒置培养48 h,记录稀释倍数和相应的菌落总数,选择菌落数在30~300 CFU范围内的平板进行计数后放于4 ℃冰箱内贮藏备用,平行实验3 次。
1.3.3 菌悬液制备
选取菌落总数在30~300 CFU范围内的平皿,菌落计数,用记号笔标记出每个可见单菌落的位置,划分区域,用接种环依次挑取每个单菌落于装有5 mL灭菌营养肉汤培养基的试管内,尽量保证所有数据采集完整,摇床37 ℃、160 r/min振荡过夜。待菌悬液制备后,用移液枪从每支试管内吸取100 μL菌液,垂直滴落在已凝固的营养琼脂培养基上,静置10min左右,倒扣于(36±1) ℃的培养箱内培养24 h,进行保种,待单菌落生成后,将平板置于4 ℃冰箱内保藏备用,菌悬液置于冰箱内备用。
1.3.4 PCR扩增
采用细菌16S rDNA通用引物(Eu27F:5’-GAGAGTTTGATCCTGGCTCAG-3’)和(1492R:5’-CTACGGCTACCTTGTTACGA-3’)进行PCR扩增。50 μL反应体系:Taq PCR Master Mix 25 μL,上下游引物各1 μL,以上一步中已振荡过夜培养并经过保种实验后能够成功得到单菌落的菌悬液作为模板,添加1 μL于反应体系中,补充ddH2O 22 μL至反应总体系为50 μL。反应程序:94 ℃预变性5 min;94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸60 s,30 个循环;72 ℃延伸8 min。扩增产物经1%琼脂糖凝胶电泳检测,片段长度为1 500 bp左右,PCR反应原液置于4 ℃贮藏备用。
1.3.5 序列测序
PCR原液的测序工作由上海生工生物有限公司完成,测序后的拼接结果在NCBI上进行BLAST(http:// blast.ncbi.nlm.nih.gov/Blast.cgi)相似序列检索比对。
2 结果与分析
2.1 不同贮藏时间条件下菌落总数变化

表1 不同贮藏时间对冷鲜羊肉表面菌落总数的影响Table1 Effects of storage time on the total number of colonies on chilled fresh muttttoonn
我国对于冷鲜肉的卫生标准尚无菌落总数指标,一般菌落总数参考评价标准为新鲜肉相关标准[18-19]。本实验测定了不同贮藏时间后冷鲜羊肉表面的菌落总数,从表1可以看出,随着贮藏时间延长,冷鲜羊肉表面的菌落总数呈上升趋势,贮藏一段时间后样品表面的菌落总数由最初的103CFU/g增加到了106CFU/g,根据参考标准规定,冷鲜肉细菌菌落总数不能超过1×106CFU/g,因此,冷鲜羊肉在4 ℃条件下贮藏时间一般不超过7 d。
2.2 PCR扩增结果

图1 PCR扩增产物电泳图Fig.1 Electrophoresis of PCR amplified products
以菌悬液作为DNA模板,利用细菌通用引物27F和1492R进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,获得长度约1 500 bp的片段,结果见图1。所有样品均可见较明亮的扩增条带,且阴性对照孔无条带出现,说明操作过程方法可行,操作规范无污染,本实验的PCR扩增条件是合适的。
2.3 贮藏期内冷鲜羊肉表面优势菌组成分析及其变化规律

表2 不同贮藏时间条件下冷鲜羊肉单菌落个数Table2 Individual colony numbers of chilled fresh mutton as a function of storage ttiimmee
由表2可知,以每个单菌落制备菌悬液作为DNA模板进行的PCR扩增,实验结果有部分损失,但整体送检有效率能够达到87%以上,实验方法操作可行。
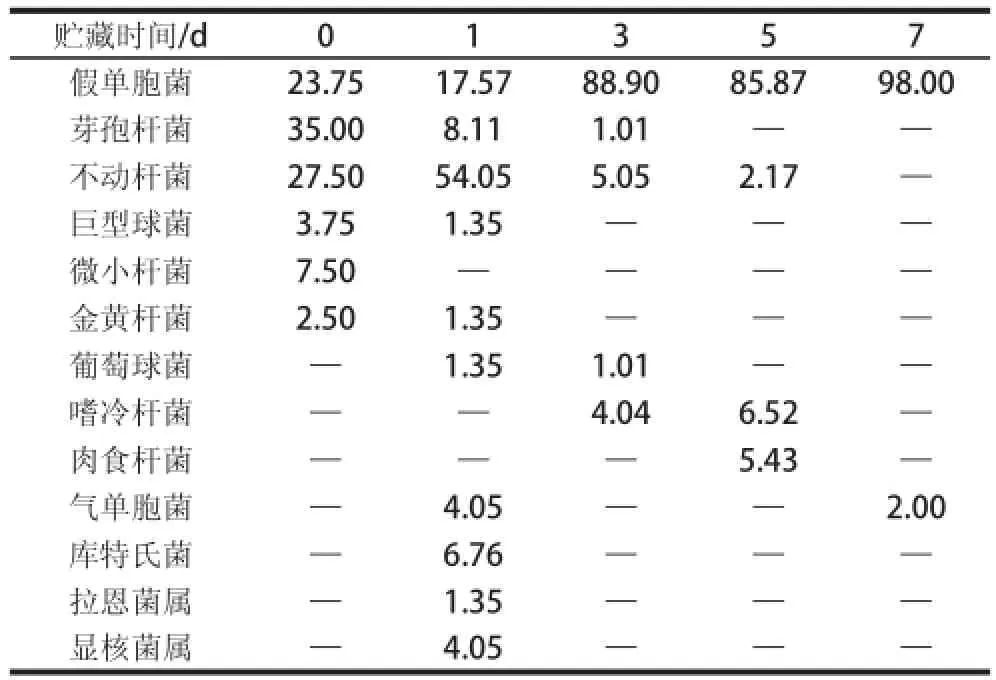
表3 贮藏期内冷鲜羊肉表面优势菌组成比例Table3 The composition of dominant bacteria on chilled fresh mutton as a function of storage ttiimmee%
分析贮藏期冷鲜羊肉各种细菌占总菌数的百分比,通过表3分析测序结果可以看出,冷鲜羊肉贮藏初期,微生物种类较多,其中,假单胞菌、芽孢杆菌和不动杆菌所占比例较大,随着贮藏时间的延长,冷鲜羊肉表面的优势菌有了明显的变化,到了贮藏第3天,假单胞菌所占比例较前2 d有了大幅增加,而初始比例较大的芽孢杆菌和不动杆菌的占比却有所下降;当达到贮藏第7天时,送检样品只检测出两种细菌,而假单胞菌更是占送检样品结果的98%,所占比例占明显优势,成为冷鲜羊肉表面的绝对优势菌群。
由此可以看出,冷鲜羊肉表面初始微生物包括假单胞菌、不动杆菌、芽孢杆菌以及检测到的球菌、杆菌等微生物,而在贮藏后期,优势菌群主要为假单胞菌,随着贮藏时间的延长,嗜冷杆菌的数量也呈小幅增加趋势,气单胞菌在贮藏后期也可检出,但最主要的菌群是假单胞菌,是造成托盘包装的冷鲜羊肉腐败的主要微生物。
3 结论与讨论
以单菌落的菌悬液作为DNA模板,利用细菌通用引物进行PCR扩增,产物经电泳检测后可以获得约1 500 bp的片段长度,操作过程方法可行,相比于传统的微生物分离鉴定方法判断样品菌落的变化规律,本实验能够节省鉴定单菌落各生理生化指标的时间,一定程度上减少实验员的工作量。
托盘包装冷鲜羊肉中的初始微生物主要包括了假单胞菌、芽孢杆菌、不动杆菌、嗜冷杆菌、气单胞菌属等微生物,其中,假单胞菌、芽孢杆菌和不动杆菌属在冷鲜羊肉贮藏初期占据优势地位,随着时间的延长,假单胞菌的增长速率加快,贮藏后期,它在数量上占有绝对优势,是引起冷鲜羊肉腐败的主要微生物,这与已有研究[20]指出的常存在于胴体和分割肉表面的微生物主要为假单胞菌、不动杆菌、气单胞菌属等嗜冷菌的结论一致。
采用菌落计数法测定冷鲜羊肉表面菌落总数,参考GB 5009.44—2003《肉与肉制品卫生标准的分析方法》[19]:新鲜肉为104CFU/g以下、次鲜肉为104~106CFU/g、变质肉为106CFU/g以上。样品冷鲜羊肉在第7天的菌落总数超过106CFU/g,根据标准已腐败变质,不可再食用。在4℃条件下,冷鲜羊肉贮藏时间不超过7 d。
本实验通过菌落计数与菌落PCR法,可以有效判断贮藏期间冷鲜羊肉表面菌相的变化。样品在低温贮藏初期保持了一定的新鲜度,说明低温环境和保鲜膜包装可在一定程度上抑制微生物的生长繁殖,从而延缓羊肉腐败变质速率,在第0天时样品表面细菌种类多,所占比例相对平均,而到第7天时,细菌种类只剩下2 种,并且假单胞菌所占比例极大。这表明在对羊肉进行保鲜的过程中,不仅要利用合理的保鲜方法,还要找到抑制假单胞菌的有效方法。
大部分微生物,如致病菌和嗜温菌,在冷藏条件下其生长因温度因素影响而受到抑制,但4 ℃冷藏条件不能完全抑制嗜冷菌的生长繁殖。假单胞菌是一类革兰氏阴性菌,广泛存在于自然界中,在冷藏温度条件下可以快速生长,大部分报道指出,假单胞菌在低温有氧贮藏条件下具有很高的生长率,决定了冷鲜肉的货架期[21-24],当温度是唯一或者主要的限制因素时,假单胞菌在冷藏食品中的生长速率比其他污染细菌的生长速率快30%[25]。本研究结果也证实了这一结论,所以在使用各种保鲜技术对羊肉进行保鲜时,还应该特别找出抑制假单胞菌的方法,这样才能更好的保持冷鲜羊肉的品质,以延长保质期。
为此,后续实验应加强对假单胞菌一些特性反应的研究,寻求一种定性定量的快速方法,能够判断冷鲜肉表面假单胞菌的含量,从而快速判断肉品的新鲜度。此外实验送样测序的返回率未达到100%,证明实验中存在着数据的损失,这和人为实验操作有密不可分的关系,后续实验需要加强对这方面干扰的控制。
[1] 邓富江. “十二五”时期中国肉类工业发展战略研究报告[R]. 北京: 中国肉类协会′2010.
[2] 戴瑞彤′吴国强. 肉嫩度的研究进展[J]. 肉类工业′2000(10): 32-35.
[3] 工业和信息化部.肉类工业“十二五”发展规划[EB/OL]. (2012-02-24). http://www.miit.gov.cn/n11293472/n11293832/n11293907/ n11368223/14474947.html.
[4] 侯瑞锋′黄岚′王忠义′等. 肉品新鲜度检测方法[J]. 现代科学仪器′2005(5): 79-83.
[5] 张进′王卫′郭秀兰′等. 羊肉制品加工技术研究进展[J]. 肉类研究′2011′25(11): 50-54.
[6] 金鑫′周光宏′徐幸莲. 冷却肉微生物腐败与冷链系统[J]. 食品工业科技′2012′33(6): 417-420.
[7] 孙毅. 生物工程技术的开发现状及展望[J]. 科技情报开发与经济′2005′15(22): 封2; 142.
[8] WAN M X FARUQ J ROSENBERG J N et al An improved colony PCR procedure for genetic screening of Chlorella and related microalgae[J]. Biotechnology Letters′2011′33(8): 1615-1619.
[9] HOFMANN M A BRIAN D A Sequencing PCR DNA amplified directly from a bacterial colony[J]. Biotechniques′1991′11(1): 30-31. [10] WARD A C Rapid analysis of yeast transformants using colony-PCR[J]. Biotechniques′1992′13(3): 350.
[11] van ZEIJL C M van de KAMP E H PUNT P J et al An improved colony-PCR method for filamentous fungi for amplification of PCR-fragments of several kilobases[J]. Journal of Biotechnology′1998′59(3): 221-224.
[12] 黄留玉. PCR最新技术原理、方法及应用[M]. 北京: 化学工业出版社′2011: 208-209.
[13] PACKEISER H LIM C BALAGURUNATHAN B et al An extremely simple and effective colony PCR procedure for bacteria yeasts and microalgae[J]. Applied Biochemistry and Biotechnology′2013′169(2): 695-700.
[14] 张德权′王宁′王清章′等. 真空条件下冷却羊肉的菌相消长规律[J]. 食品科学′2006′27(4): 47-50.
[15] 于见亮′李开雄′蒲菊霜′等. 冷却羊肉中腐败菌的分离、初步鉴定与初始菌相分析[J]. 肉类工业′2007(11): 27-29.
[16] 诸永志′姚丽娅′王道营′等. 冷却羊肉微生物菌群分析与鉴定[J]. 江西农业学报′2009′21(3): 124-126.
[17] 卫生部. GB 4789.2—2010 食品卫生微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社′2010.
[18] 姜绍通′吴洁方′刘国庆′等. 茶多酚和大蒜素在冷却肉涂膜保鲜中的应用[J]. 食品科学′2010′31(10): 313-316.
[19] 卫生部. GB 5009.44—2003 肉与肉制品卫生标准的分析方法[S]. 北京: 中国标准出版社′2003.
[20] GILL C O DUSSAULT F HOLLEY R A A et al Evaluation of the hygienic performances of the processes for cleaning dressing and cooling pig carcasses at eight packing plants[J]. International Journal of Food Microbiology′2000′58: 65-72.
[21] 刘子宇′周伟′李平兰. 冷却猪肉中主要微生物的分离与初步鉴定[J]. 肉品卫生′2005(6): 17-19.
[22] 马俪珍′南庆贤′戴瑞彤. 冷却猪肉中腐败菌的分离、初步鉴定与初始菌相分析[J]. 天津农学院学报′2005′12(3): 39-42.
[23] 傅鹏′李平兰. 冷却猪肉初始菌相分析与冷藏过程中的菌相变化规律研究[J]. 食品科学′2006′27(11): 119-124.
[24] 马展′张德纯. 假单胞基因工程菌的开发应用现状与展望[J]. 中国微生态学杂志′2003′15(3): 186-187.
[25] NYCHAS G J SKANDAMIS P N TASSOU C C et al Meat spoilage during distribution[J]. Meat Science′2008′78: 77-89.
Changes in Microflora on Fresh Mutton during Chilled Storage
ZHOU Yanbing1′AI Qijun1′*′ZHANG Dequan2′*
(1. College of Food Science and Engineering Beijing University of Agriculture Beijing 102206′China; 2. Institute of Agro-products Processing Science and Technology Chinese Academy of Agricultural Sciences Beijing 100193′China)
The composition of the bacterial microflora on fresh mutton as a function of storage time at 4 ℃ was determined by total plate count and colony polymerase chain reaction (PCR). The results showed that the total number of colonies on tray-packaged mutton increased with an increase in storage time and exceeded 106CFU/g at the seventh day indicating spoilage of the mutton The main bacteria were Pseudomonas′ Bacillus Acinetobacter and etc During storage Pseudomonas became the dominant spoilage bacterium in chilled meat.
chilled fresh mutton total number of colonies colony PCR refrigeration at 4 ℃; dominant bacteria
TS201.3
A
1002-6630(2015)06-0242-04
10.7506/spkx1002-6630-201506046
2014-06-24
公益性行业(农业)科研专项(201303083)
周琰冰(1989—),女,硕士研究生,研究方向为食品质量与安全控制。E-mail:starella@aliyun.com
*通信作者:艾启俊(1954—),男,教授,硕士,研究方向为食品安全、农产品有害微生物及农残安全检测与控制。E-mail:aiqj@sohu.com张德权(1972—),男,研究员,博士,研究方向为肉品加工与安全。E-mail:dqzhang0118@126.com
