3 种方法提取的雨声红球藻多糖的理化性质及抗氧化活性比较
2015-12-13王诗卉
刘 杨,王诗卉,刘 云*
(北京化工大学生命科学与技术学院,北京市生物加工过程重点实验室,北京 100029)
3 种方法提取的雨声红球藻多糖的理化性质及抗氧化活性比较
刘 杨,王诗卉,刘 云*
(北京化工大学生命科学与技术学院,北京市生物加工过程重点实验室,北京 100029)
以雨声红球藻(Haematococcus pluvialis)为原料,研究超声辅助酸提取、超声辅助碱提取、超声辅助水提取3 种不同提取工艺对雨声红球藻多糖提取效率和产品理化特性的影响,在此基础上对3 种多糖抗氧化活性进行比较分析。结果表明,3 种提取方法所得多糖提取率大小依次为:超声辅助碱提法(9.52%)>超声辅助酸提法(1.50%)>超声辅助水提法(1.29%)。傅里叶红外变换光谱分析结果表明,3 种多糖的组成单糖中均包含吡喃糖,成苷的半缩醛羟基主要为α构型,其中以酸提多糖的吸收峰最强。扫描电子显微镜证实了超声辅助碱提法对雨声红球藻细胞壁的破坏程度最大,胞内多糖溶出最多。通过对还原力、1′1-二苯基-2-苦基肼自由基清除能力和·OH清除能力等抗氧化活性的测定,表明3 种多糖均具有一定的抗氧化能力,其中以碱提多糖的综合抗氧化能力最优。由此可见,超声辅助碱提法是一种提取藻多糖较好的方法。
雨声红球藻多糖;超声辅助提取;理化特性;抗氧化
生物多糖是一类在自然界中广泛存在的天然大分子化合物,在心血管疾病、肝炎的治疗以及抗肿瘤、抗氧化、抗凝等方面均呈现出了独特的生理活性,且有着非常低的细胞毒性。因此,生物多糖不但可以增强机体的免疫力,而且还能增强机体的抗氧化能力[1-2]。随着对海洋资源的深入研究,发现海洋中的海藻、虾壳素、微生物等来源的活性多糖,是开发海洋生物功能性食品、寻找新型多糖药物先导化合物的宝贵资源[3-4]。
雨声红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻,隶属绿藻门、团藻目、红球藻科、红球藻属。主要作为天然虾青素来源,用于虾青素的有关研究[5-6]。目前,国内外对雨声红球藻多糖的研究报道不多,冯以明等[7]依次采用冷水法、热水法和热碱法分级提取雨声红球藻多糖,得率均不高,分别为2.74%、1.36%及1.55%;通过高效液相色谱法、红外光谱法等对分级纯化后的3 种冷水提多糖的单糖组成、相对分子质量和基本结构特征进行了 分析,结果表明,雨声红球藻多糖的单糖种类复杂,主要含有11 种单糖,其中半乳糖含量最高,大于20%;冷水法、热水法所得多糖的硫酸基及糖醛酸相对含量均低于碱提多糖。分级所得3 种冷水提多糖的相对峰位分子质量分别为502.6、373.2,577.5、300.5 ku。Park等[8]在研究雨声红球藻多糖时,发现雨声红球藻多糖是一种酸性多糖;经琼脂糖CL-6B柱层析和体积排阻色谱法纯化后,测得其单糖组成包括半乳糖、葡萄糖和甘露糖,相对物质的量比率为2.0、1.0和4.1;多糖中硫酸酯含量为1.08%,未检测到蛋白质及酚类物质;同时发现,雨声红球藻多糖有较好的免疫活性,可以激活小鼠巨嗜细胞RAW264.7分泌促炎性细胞因子,呈剂量依赖性,且没有细胞毒性。Rodríguez-Meizoso等[9]采用亚临界水萃取技术提取雨声红球藻中可以用作功能食品原料的天然生物活性类物质,发现当提取温度为200 ℃时,提取率最高,大于30%;通过Trolox等价抗氧化能力(Trolox equivalent and oxidant capacity,TEAC)法研究提取物的抗氧化能力,结果表明,提取物的抗氧化能力与雨声红球藻中的糖类物质在高温条件下产生的焦糖化反应产物及美拉德反应产物有关。
多糖的提取方法可分为溶剂提取法、酸提法、碱提法、生物提取法、强化提取法。其中,水提法是一种传统的提取方法,该法不需复杂的设备,成本低,安全无毒害,适合大规模工业化生产。但因水的极性大,易引入蛋白质等杂质。酸碱提取法是在水提法的基础上衍生出来的多糖提取方法,在一定程度上提高了提取率,但操作中应对浓度加以控制,防止造成多糖的降解[10]。酶法具有条件温和、杂质易除和提取率高等优点。但是该法成本较高,并且对反应条件要求较苛刻。超临界流体萃取法的优点是传质速率高、穿透力强、萃取效率高,缺点是设备复杂,成本高。超声波辅助提取多糖的过程是一种物理破碎过程,它利用空化和机械振动作用瞬间使细胞壁结构破裂,提高了多糖的提取率,同时还能产生乳化、热效应等,加速了植物有效成分的扩散[11]。且该法具有能耗低、效率高等优点,在实际生产中得到了广泛的应用。雨声红球藻厚壁孢子坚韧的细胞壁阻碍了对胞内目的产物的提取,从而降低了生物利用度[9]。研究[12]表明超声辅助提取法可以通过破壁增强雨声红球藻细胞内生物活性物质的溶出。
本实验比较了超声辅助酸提法、超声辅助碱提法和超声辅助水提法3 种不同提取工艺对雨声红球藻多糖的提取效果,并对所提多糖产品的理化性质进行了全面考察,以期为雨声红球藻多糖的综合开发利用提供技术支持。
1 材料与方法
1.1 材料与试剂
雨声红球藻(Haematococcus pluvialis)由云南爱尔发生物技术有限公司馈赠。
1′1-二苯基-2-苦基肼(1′1-dipheny1-2-picrylhydrazyl,DPPH,分析纯) 上海Aladdin公司;2′6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT,化学纯)、酒石酸甲钠、α-萘酚(分析纯) 上海国药集团化学试剂有限公司;乙醇、丙酮、葡萄糖、氯化铁(分析纯) 北京化工厂;三氯乙酸(trichloroacetic acid,TCA,分析纯) 天津市大贸化学试剂厂;半乳糖醛酸(分析纯) 美国Sigma公司。
1.2 仪器与设备
UV-756CRT型紫外分光光度计 上海佑仪仪器仪表有限公司;Vector22型红外光谱仪 德国Bruker公司;3K15型冷冻离心机 美国Sigma公司;SB-5200超声波清洗机 宁波新芝生物科技股份有限公司;DF-101S型水浴恒温磁力搅拌器 巩义予华仪器有限公司;SU-1510型扫描电镜 日本Hitachi公司;SH-D(Ⅲ)型真空泵 河南予华仪器有限公司;DHG-9070A型干燥箱 北京陆希科技有限公司。
1.3 方法
1.3.1 多糖的提取与纯化
雨声红球藻藻粉于90 ℃烘箱中烘干,乙醇-乙酸乙酯(1∶2,V/V)浸泡12 h脱脂,烘干。取3 份脱脂藻粉,分别加入40 倍体积的去离子水、稀碱(4% NaOH溶液,pH 14)、稀盐酸(pH 3),于55 ℃,超声功率200 W条件下,提取2 h,重复2次。提取液中加入3 倍体积的95%乙醇溶液,静置过夜,5 000 r/min离心15 min,沉淀用去离子水溶解后采用TCA法脱蛋白[13],调节pH值至中性后将提取液置于截留分子质量为8 000 D的透析袋内于流动的去离子水中透析48 h除去小分子杂质,旋转蒸发浓缩至原体积的1/5,最后经冷冻干燥依次得水提多糖、碱提多糖和酸提多糖。
1.3.2 雨声红球藻多糖的一般理化特性分析
总糖含量测定:以葡萄糖为标准品采用苯酚-硫酸法[14]对总糖含量进行测定,准确称取标准葡萄糖10 mg于100 mL容量瓶中,加水定容至刻度,摇匀后分别吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,再加入蒸馏水补至2 mL,然后加入5%苯酚1 mL及浓硫酸5 mL,摇匀冷却,室温放置20 min后于490 nm波长处测吸光度,以2 mL蒸馏水同样处理作为对照。多糖提取率按式(1)计算。

α-萘酚实验:取粗多糖10.0 mg,加入1.0 mL去离子水溶解,加2 滴15% α-萘酚乙醇溶液,混合摇匀后,沿管壁缓缓加入硫酸0.5 mL,将试管静置10 min后50 ℃水浴5 min,观察在两液面交界处有无紫红色环出现。
斐林实验:取4.0 mL多糖溶液置于试管中,加5%盐酸1.0 mL,沸水浴15 min,室温静置冷却,加酚酞指示剂1 滴,用10% NaOH试液中和至中性,加入斐林试剂(碱性酒石酸铜溶液)4~5 滴,50 ℃水浴5 min,观察是否生成棕红色沉淀。
I2-KI颜色反应:取1 mL质量浓度为1 mg/mL的多糖溶液加入I2-KI溶液,观察颜色变化。以蒸馏水作阴性对照,淀粉溶液(1 mg/mL)作阳性对照。
FeCl3反应:取待测多糖溶液1 mL加入1% FeCl3溶液0.6 mL,观察溶液是否呈蓝墨绿色。
考马斯亮蓝反应:取0.01 g/mL的溶液1 mL加入考马斯亮蓝G-250试剂5 mL,观察其变色情况[15]。
糖醛酸的测定:以半乳糖醛酸为标准品采用间羟联苯法测定[16]。
1.3.3 不同提取方法所得多糖的紫外吸收光谱分析
将3 种多糖分别配制成0.01 g/mL的溶液,以去离子水为空白对照,采用UV-756CRT型紫外分光光度计于200~400 nm的波长范围内进行紫外扫描。
1.3.4 不同提取方法所得多糖的红外光谱分析
采用KBr压片法。取100 mg干燥KBr粉末研细,加入多糖样品0.5 mg混合研细,压成透明薄片。Vector22型红外光谱仪在4 000~400 cm-1波数范围内进行测定。红外光谱仪测定参数:分辨率:4.0 cm-1;背景扫描次数:32 次;检测器:氘化硫三肽。
1.3.5 不同方法提取后雨声红球藻细胞壁扫描电镜(scanning electron microscope,SEM)分析
不同的提取条件对雨声红球藻细胞壁结构的影响是不同的。SEM可以揭示物质的微细结构[17]。分别对未经过任何处理的雨声红球藻样品和采用3种不同超声辅助法提取及在其他条件相同情况下分别仅经过稀盐酸溶液(pH 3)、去离子水及碱溶液(4% NaOH溶液)浸提后的雨声红球藻样品进行SEM分析。首先将藻粉脱水固定,采用2.5%戊二醛溶液浸泡2~4h,之后用磷酸缓冲液清洗3次,再经乙醇梯度脱水,分别用30%、50%、70%、85%、95%的乙醇溶液各浸泡1 次,再用100%乙醇浸泡2 次,每次浸泡15~20 min。将脱水后的藻粉低温冷冻干燥12 h。最后对藻粉样品通过离子溅射喷金,采用SU-1510型扫描电子显微镜在低真空条件下测定。SEM测定参数:电子加速电压5.00 kV;放大倍数400 倍。
1.3.6 不同提取方法所得多糖的体外抗氧化活性测定1.3.6.1 还原力的测定[18]
分别取1.0、2.0、3.0、4.0、5.0 mg/mL的3 种多糖溶液各1.0 mL,依次加入1.0 mL磷酸盐缓冲液(0.2 mol/L)和1.0 mL K3Fe(CN)6溶液(1%),后将混合液于50 ℃条件下恒温反应20 min,急速冷却,接着向混合物中加入1.0 mL 10%的TCA溶液,3 000 r/s离心10 min后取2.5 mL上清液,再依次加入2.5 mL蒸馏水、1.2 mL FeCl3(0.1%)。
以蒸馏水为参比在700 nm波长处测定吸光度,取质量浓度为0.01、0.02、0.03、0.04、0.05 mg/mL的2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)进行同样处理并作为阳性对照。混合溶液的吸光度增加,表明还原能力增强。
1.3.6.2 羟自由基(·OH)清除能力的测定[19]
分别取1.0、2.0、3.0、4.0、5.0 mg/mL的3 种多糖样品水溶液1.0 mL,然后依次加入1.0 mL FeSO4(9 mmol/L),1.0mL水杨酸(9 mmol/L)和1.0 mL 9 mmol/L的H2O2,摇匀,37 ℃条件下反应30 min。以蒸馏水作为参比在510 nm波长处测吸光度记为A1,以去离子水代替样品作为待测溶液,相同条件下测定吸光度记为A0;取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的BHT进行同样处理并作为阳性对照。·OH清除率计算见式(2):

1.3.6.3 DPPH自由基清除能力的测定
分别取1.0、2.0、3.0、4.0、5.0 mg/mL的3 种多糖水溶液2.0 mL,加入2.5 mL DPPH-DMSO溶液(100 μmol/L),室温条件下反应30 min,以蒸馏水为参比,在517 nm波长处测量各质量浓度糖液的吸光度记为A1,以去离子水代替多糖,相同条件下测定的吸光度记为A0;对相同质量浓度的BHT进行同样处理作为阳性对照。DPPH自由基清除率计算见式(3)[20-21]:

2 结果与分析
2.1 不同提取方法对雨声红球藻多糖理化特性的影响
实验中详细比较了超声辅助酸提法、超声辅助水提法、超声辅助碱提法3 种不同提取工艺对雨声红球藻多糖一般理化特性的影响,结果见表1。

表1 3 种提取方法所得多糖的提取率及基本理化性质比较Table1 Comparison of the yields and basic physicochemical characteristics of polysaccharides extracted from H. pluvialis by thhrreeee extraction methooddss..
冷冻干燥后的酸提多糖和水提多糖均为白色絮状物,而碱提多糖却呈现为浅黄色絮状物;3 种多糖产品均可溶于水以及稀酸、稀碱溶液当中,都不溶于乙醇、乙醚、丙酮等有机溶剂。酸提多糖、水提多糖得率分别为1.5%和1.29%,与文献[7]报道相当,碱提多糖的得率最高(9.52%),高于文献[7]报道的1.55%。分析原因可能是由于超声波的辅助萃取提高了对细胞壁的破碎力度,加快了反应速度,故胞内溶出物更多。Wu Guanghong等[22]曾报道有些多糖尤其是含有糖醛酸的多糖及酸性多糖,在碱液中有更高的提取率。上述实验结果与该结论一致。由表1可知,苯酚-硫酸测试和α-萘酚测试的结果均呈阳性,表明这3 种组分具有一般多糖的性质;碱提多糖的I-KI反应呈阳性,表明其中含有淀粉,可能是淀粉性多糖,酸提多糖、水提多糖则均为非淀粉多糖;考马斯亮蓝反应呈阳性,表明3 种多糖样品中可能含有糖蛋白;3 种多糖的斐林测试、FeCl3反应结果均为阴性,说明它们不含单糖、多酚类物质;间羟联苯反应结果表明3 种多糖均含有糖醛酸,可能是酸性多糖,与Park等[8]所报道的结果一致。

图1 雨声红球藻多糖的紫外光谱分析Fig.1 UV absorption spectra of the three H. pluvialis polysaccharides
紫外光谱分析(图1),超声辅助酸提法、超声辅助碱提法、超声辅助水提法3 种方法所得雨声红球藻多糖产品在260 nm和280 nm波长处均没有核酸、蛋白质的特征峰,可能是其含量较低所致。
2.2 不同提取方法所得多糖的傅里叶红外变换光谱分析
对超声辅助酸提法、碱提法和水提法所得3 种多糖及原料进行了红外光谱扫描分析,结果如图2和表2所示。

图2 不同提取方法所得多糖及雨声红球藻原料的红外光谱图Fig.2 Infrared spectra of H. pluvialis and the three polysaccharides
研究[23]表明红外吸收光谱可以用来检测糖类中功能基团,据此可以判断糖链上的主要取代基,有关单糖组成、糖环构型、半缩醛羟基构型等结构信息也可通过红外光谱图获得。

表2 雨声红球藻及3 种多糖的红外光谱分析Table2 Infrared spectral analysiss ooff H. pluvialis aanndd the three polysacchariiddeess
如图2所示,不同提取方法所得多糖的红外光谱图基本相似,说明3 种多糖在化学结构上类似。原料藻粉及3 种雨声红球藻多糖在3 600~3 200 cm—1处均存在强宽吸收峰,为糖类—OH的伸缩振动;3 000~2 800 cm—1(2 887、2 889、29 26 cm—1)处的吸收峰为—CH的伸缩振动,其中超声辅助酸提多糖的吸收峰比超声辅助碱提多糖和超声辅助水提多糖强,说明超声辅助酸提多糖中有较多的—CH结构[24];在1 636 cm—1及1 639 cm—1处,超声辅助酸提多糖、水提多糖和碱提多糖的谱图中各自有一不太尖的峰,为酰胺基的吸收峰[24];1 150~1 000 cm—1为C—O—C环内醚C—O伸缩振动和C—O—H变角振动所引起的吸收[25],超声辅助酸提多糖在1 110 cm—1处的吸收强于水提及碱提多糖;在糖类的环振动吸收区900~700 cm—1,可观察到843 cm—1处3 种提取方法所得多糖均呈现特征吸收,并以超声辅助酸提多糖吸收峰最强,说明组成单糖中包括吡喃糖[25],成苷的半缩醛羟基主要为α构型。
2.3 不同提取方法对雨声红球藻细胞壁的SEM分析
如图3所示,多糖提取前后的雨声红球藻细胞壁形貌差异明显。提取前雨声红球藻细胞壁表面光滑,无折痕或裂痕(图3A)。而经超声辅助酸、碱提取多糖后的雨声红球藻细胞壁表面出现不规则褶皱,表面积增大,有利于多糖从细胞内溶出。Zhang Zuof a等[26]研究超声辅助法提取金针菇中的活性多糖时,通过SEM分析表明,提取后细胞壁受到严重破损,而未经超声辅助法提取的材料其细胞壁较完好。李辉等[27]比较了超声辅助法和常规回流法提取白背三七总黄酮,SEM证明了超声处理后的植物叶片表面损伤严重,而常规回流处理后的叶片表面仍较完整,表明超声波与溶剂中的植物材料作用时,对其细胞壁具有较强的破坏作用。
目前普遍认为,超声辅助提取是多糖提取的一种有效方法[28]。超声波可致物料和溶液的接触面间形成空穴,气泡的瞬间形成和破裂产生极大压力可以造成细胞壁的破裂,同时伴随热效应和机械作用对介质中的悬浮细胞造成剪切应力,加速传质[29]。本实验中,经过超声辅助水提取后的雨声红球藻细胞壁表面出现褶皱(图3C)。而经超声辅助酸、碱提取后的雨声红球藻细胞壁表面塌陷和褶皱程度更加明显(图3B和3D),从而加速多糖从胞内溶出。这与表1多糖提取得率结果一致。
图3E~G依次为不施加超声波辅助作用下雨声红球藻经酸溶液(pH 3的稀盐酸)、去离子水及碱溶液(4%的NaOH溶液)浸提后的SEM图。如图3E所示,少量红球藻细胞壁呈现褶皱,图3F中几乎没有表面褶皱的红球藻,图3G中大部分红球藻细胞壁均呈现褶皱。对比图3B及3E,可知酸碱对雨声红球藻细胞壁有一定的破坏作用,但不及在超声波协同作用下的效果明显。酸、碱法有助于解除细胞壁聚合物分子间的物理和化学作用,使不溶性纤维素、木质素、半纤维素与果胶多糖之间的化学键断裂,从而提高多糖产率。赵晨淏等[30]研究不同提取方法对龙眼多糖性质的影响时,发现碱溶液会导致细胞壁破损更严重,利于胞内多糖的溶出。Xue Fang等[31]研究超声辅助热水法、超声辅助热碱法提取花生多糖,发现超声热水提取后花生粕细胞壁断裂为不规则片状,而超声热碱提取后的花生饼粕粉末表面有多处塌陷,细胞壁已经完全破碎。这与本实验结论相一致。
2.4 不同提取方法所得多糖的体外抗氧化活性比较2.4.1 还原力测定结果
Fan Liuping等[32]研究发现合成化合物及天然提取物的还原能力是反映其抗氧化活性的一个有效指标。抗氧化剂通过自身的还原作用给出电子而清除自由基,其抗氧化活性与还原力呈正相关,还原能力越大,抗氧化活性越强[33]。
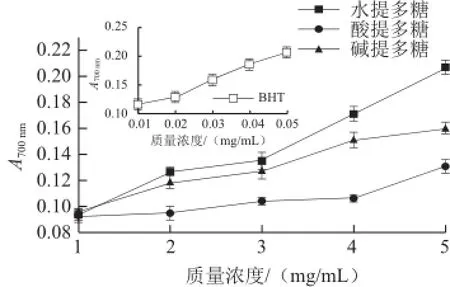
图4 BHT和3 种雨声红球藻多糖的还原力Fig.4 Reducing power comparison of BHT and the three polysaccharides from H. pluvialis
如图4所示,3 种方法提取雨声红球藻多糖的还原力(A700nm值)均随多糖质量浓度的增加而逐渐增强,其中超声辅助水提多糖的还原能力最高,超声辅助碱提多糖次之,超声辅助酸提多糖最弱,当3 种多糖质量浓度达到5 mg/mL时,其吸光度分别为0.207、0.156和0.131。以上结果表明,3 种提取方法得到的雨声红球藻多糖均具有一定的还原力,但与BHT相比较弱。类似的,Zhang Zuofa等[26]研究了金针菇多糖的还原能力,发现质量浓度为5 mg/mL的金针菇多糖在700 nm波长处的吸光度低于0.2,与阳性对照丁基羟基茴香醚同样具有较大差异。Kozarski等[34]研究药用真菌多糖的还原能力时,发现当灵芝多糖的质量浓度为5 mg/mL,其吸光度约为0.23。此外,Lu Xinshan等[18]在研究黄山毛峰多糖的还原力时以BHT作为阳性对照,当BHT的质量浓度在0.01~0.05 mg/mL之间时,A700nm在0.6~2.3之间,与本实验结果一致。
2.4.2 ·OH的清除效果
·OH的检测对自由基的生物作用研究而言非常重要。·OH是已知活性最强的活性氧自由基,易穿过细胞膜,直接作用于细胞内的蛋白质、脂质、DNA等生物分子,引起组织损伤或细胞死亡。因此,清除·OH可能是保护生命系统的有效方式[35]。多糖抗氧化机制可能是通过糖醛酸与亚铁离子耦合抑制·OH的产生,提高还原力[36]。同时也可能通过提供氢原子,与·OH结合成水,达到清除自由基的作用。

图5 BHT和3 种雨声红球藻多糖的・OH清除能力Fig.5 Hydroxyl radical scavenging activity of BHT and the three polysaccharides from H. pluvialis
由图5可知,当多糖的质量浓度在1~3 mg/mL之间时,其对·OH的清除能力随质量浓度的升高而增大,呈现剂量依赖性;但当质量浓度高于3 mg/mL后,其清除率基本不再变化,说明该质量浓度为清除·OH的最佳质量浓度,在本实验最高质量浓度下(5 mg/mL),超声辅助碱提多糖对·OH的清除作用最强(6.85%),超声辅助水提多糖次之(5.75%),超声辅助酸提多糖最弱(4.73%)。Wu Guanghong等[22]用碱提法得到的菌核侧耳多糖对·OH的清除率为水提多糖的 1.2 倍,说明碱液提取方法可能更有利于酸(活)性多糖溶出。Huang等[37]研究了茶树菇子实体和发酵液提取物的抗氧化活性,发现当质量浓度为5 mg/mL时清除率分别为3.82%和3.56%,均低于雨声红球藻多糖。此外,Pan Yingming等[38]以BHT作为阳性对照,当BHT质量浓度在0.2~1.0 mg/mL范围内时其·OH清除率在5%~20%之间与本实验研究结果基本一致。
在本实验中,当多糖质量浓度在1~2 mg/mL时,酸提多糖的·OH清除率高于另外2 种多糖,而当质量浓度高于3 mg/mL后,超声辅助碱提多糖的清除率最高,造成该现象的原因主要是超声辅助酸提多糖中包含较多的—CH基团(2.2节)。当多糖质量浓度较低时,超声辅助酸提多糖主要以单体形式存在于溶液中,而当多糖质量浓度提高时,过多的—CH基团导致酸性多糖聚集成簇从而降低整个体系的熵。簇的存在降低了·OH和酸性多糖的可及性,从而减弱了酸性多糖的·OH清除率[39]。
2.4.3 DPPH自由基清除作用
DPPH自由基是一种很稳定的以氮为中心的有机自由基,其孤对电子在517 nm波长附近有强吸收;当有抗氧化剂存在时,孤对电子被配对,吸收消失或减弱,溶液由紫色变为浅黄色[40]。因此可以通过测定吸收减弱的程度,来评价抗氧化剂的抗氧化活性。对BHT和3 种不同方法提取所得雨声红球藻多糖的DPPH自由基清除能力的研究结果如图6所示。

图6 BHT和3 种雨声红球藻多糖的DPPH自由基清除能力Fig.6 DPPH radical scavenging activities of BHT and the three polysaccharides extracted from H. pluvialis
3 种多糖均表现出质量浓度与自由基清除作用间的量效关系,即在一定质量浓度范围内,随着多糖质量浓度的增加其对DPPH自由基的清除作用也随之增强。当雨声红球藻多糖质量浓度为5mg/mL时,超声辅助碱提多糖对DPPH自由基的清除率达到62.78%,分别是超声辅助水提多糖的5.5 倍和超声辅助酸提多糖的2.3 倍。徐怀德等[41]研究超声波辅助提取的光皮木瓜多糖对DPPH自由基的清除能力,发现当多糖质量浓度为8 mg/mL时,光皮木瓜多糖对DPPH自由基的清除率可达到74.68%,高于同质量浓度下VC对DP PH自由基的清除率。Hua Dehong等[42]研究山桃草果实多糖清除DPPH自由基的能力,结果表明:山桃草多糖具有DPPH自由基清除活性,当质量浓度为5 mg/mL时,对DPPH自由基的清除率接近30%。由此可知,5 mg/mL的碱性多糖的清除率略低于8 mg/mL的光皮木瓜多糖,但是远高于同质量浓度下的山桃草果实多糖,说明超声辅助碱提多糖在DPPH自由基清除方面有潜在的应用价值。类似的,超声辅助酸提多糖和超声辅助水提多糖也有一定的DPPH自由基清除作用。
3 结 论
比较了超声辅助酸提取、超声辅助水提取、超声辅助碱提取3 种方法对雨声红球藻多糖的提取效果及所得3 种多糖的理化性质,进一步对多糖的体外抗氧化活性进行了比较分析。结果表明,超声辅助酸提法、超声辅助水提法及超声辅助碱提法的多糖提取率依次是1.50%、1.29%、9.52 %。3 种多糖的组成中均包括糖醛酸;超声辅助碱提法所得多糖是淀粉性多糖,其他2 种为非淀粉性多糖;3种方法所得多糖中均不含单糖、多酚类物质,但其组成单糖中均包含吡喃糖,成苷的半缩醛羟基主要为α构型,其中以超声辅助酸提多糖的吸收峰最强。傅里叶红外变换光谱显示,3 种多糖组成基本相似。SEM结果显示,超声辅助碱提法对雨声红球藻细胞表面形态影响最大,多糖释放最充分。超声辅助碱提多糖对DPPH自由基有较好的清除效果,清除率达60%以上;对·OH的清除能力也强于其他两种多糖;还原力表现为超声辅助水提多糖>超声辅助碱提多糖>超声辅助酸提多糖。综合分析,超声辅助碱提法所得雨声红球藻多糖提取率和抗氧化活性最高。
[1] BAO Yang JIANG Yueming SHI J et al Extraction and pharmacological properties of bioactive compounds from longan (Dimocarpus longan Lour.) fruit a review[J]. Food Research International′2011′44(7): 1837-1842.
[2] LI Jinwei LIU Yanfa FAN Liuping et al Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv Jinsixiaozao[J]. Carbohydrate Polymers′2011′84(1): 390-394.
[3] CHEUNG R C F WONG J H PAN Wenliang Antifungal and antiviral products of marine organisms[J]. Applied Microbiology and Biotechnology′2014′98(8): 3475-3494.
[4] ISURU W RAITIH P SE-KWON K Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J]. Carbohydrate Polymers′2011′84(1): 14-21.
[5] WANG Junfeng HAN Danxiang SOMMERFELD M R et al Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor[J]. Journal of Applied Phycology′2013′25(1): 253-260.
[6] GUEDES A C AMARO H M MALCATA F Microalgae as sources of high added-value compounds a brief review of recent work[J]. Biotechnology Progress′2011′27(3): 597-613.
[7] 冯以明′李广生′吴建东′等. 雨声红球藻多糖的提取分离及理化性质研究[J]. 海洋科学′2012′36(1): 17-22.
[8] PARK J K KIM Z H LEE C G et al Characterization and immunostimulating activity of a water-soluble polysaccharide isolated from Haematococcus lacustris[J]. Biotechnology and Bioprocess Engineering′2011′16(6): 1090-1098.
[9] RODR☒GUEZ-MEIZOSO I JAIME L SANTOYO S et al Subcritical water extraction and characterization of bioactive compounds from Haematococcus pluvialis microalga[J]. Journal of Pharmaceutical and Biomedical Analysis′2010′51(2): 456-463.
[10] NIE Shaopeng XIE Mingyong A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids′2011′25(2): 144-149.
[11] ZHOU Cunshan YU Xiaojie ZHANG Youzuo et al Ultrasonic degradation purification and analysis of structure and antioxidant activity of polysaccharide from Porphyra yezoensis Udea[J]. Carbohydrate Polymers′2012′87(3): 2046-2051.
[12] MERCER P ARMENTA R E Developments in oil extraction from microalgae[J]. European Journal of Lipid Science and Technology′2011′113(5): 539-547.
[13] ZHANG Hailin CUI Shaohua ZHA Xueqiang et al Jellyfish skin polysaccharides extraction and inhibitory activity on macrophagederived foam cell formation[J]. Carbohydrate Polymers′2014′106(6): 393-402.
[14] LIANG Junrong AI Xinxinn GAO Yahui et al MALDI-TOF MS analysis of the extracellular polysaccharides released by the diatom Thalassiosira pseudonana[J]. Journal of Applied Phycology′2013′25(2): 477-484.
[15] 路阳′王培之. 用考马斯亮蓝G-250迅速灵敏地测定蛋白质浓度[J]. 生物学杂志′1992′45(1): 24-26.
[16] OZTURK S ASLIM B SULUDERE Z et al Metal removal of cyanobacterial exopolysaccharides by uronic acid content and monosaccharide composition[J]. Carbohydrate Polymers′2014′101(1): 265-271 .
[17] CAPITANI M I IXTAINA V Y NOLASCO S M et al Microstructure chemical composition and mucilage exudation of chia (Salvia hispanica L.) nutlets from Argentina[J]. Journal of the Science of Food and Agriculture′2013′93(15): 3856-3862.
[18] LU Xinshan ZHAO Yan SUN Yanfei et al Characterisation of polysaccharides from green tea of Huangshan Maofeng with antioxidant and hepatoprotective effects[J]. Food Chemistry′2013′141(4): 3415-3423.
[19] BI Hongtao GAO Tingting LI Zonghong et al Structural elucidation and antioxidant activity of a water-soluble polysaccharide from the fruit bodies of Bulgaria inquinans (Fries)[J]. Food Chemistry′2013′138(2/3): 1470-1475.
[20] SUN Liwei FENG Kai JIANG Rui et al Water-soluble polysaccharide from Bupleurum chinense DC isolation structural features and antioxidant activity[J]. Carbohydrate Polymers′2010′79(1): 180-183.
[21] CHEN Ruizhan LIU Zhigang ZHAO Jimin et al Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J]. Food Chemistry′2011′127(2): 434-440.
[22] WU Guanghong HU Ting LI Ziyi et al In vitro antioxidant activities of the polysaccharides from Pleurotus tuber-regium (Fr.) Sing[J]. Food chemistry′2014′148: 351-356.
[23] ZHANG Daihui WANG Chong WU Hongxi et al Three sulphated polysaccharides isolated from the mucilage of mud snail Bullacta exarata philippi characterization and antitumour activity[J]. Food Chemistry′2013′138(1): 306-314.
[24] LUO Aoxue HE Xingjin ZHOU Songdong et al Purification composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J]. Carbohydrate Polymers′2010′79(4): 1014-1019.
[25] G☒MEZ-ORD☒☒EZ E RUP☒REZ P FTIR-ATR spectroscopy as a tool for polysaccharide identification in edible brown and red seaweeds[J]. Food Hydrocolloids′2011′25 (6): 1514-1520.
[26] ZHANG Zuofa L Guoying HE Weiqiang et al Effects of extraction methods on the antioxidant activities of polysaccharides obtained from Flammulina velutipes[J]. Carbohydrate Polymers′2013′98(2): 1524-1531.
[27] 李辉′卜晓英′陈功锡′等. 超声辅助提取白背三七总黄酮[J]. 食品科学′2011′32(14): 144-146.
[28] MING Shi YANG Yingnan HU Xuansheng et al Effect of ultrasonic extraction conditions on antioxidative and immunomodulatory activities of a Ganoderma lucidum polysaccharide originated from fermented soybean curd residue[J]. Food Chemistry′2014′155(7): 50-56.
[29] ZHAO Chao YANG Rifu QIU Taiqiu Ultrasound-enhanced subcritical water extraction of polysaccharides from Lycium barbarum L.[J]. Separation and Purification Technology′2013′120(12): 141-147.
[30] 赵晨淏′刘钧发′冯梦莹′等. 不同提取方法对龙眼多糖性质的影响[J]. 现代食品科技′2012′28(10): 1298-1305.
[31] XUE Fang YAN Rui WANG Chengming Study on ultrasonic waveassisted alkali extraction of polysaccharides from Peanut Meal[J]. Food Science′2008′29(8): 158-163.
[32] FAN Liuping LI Jinwei DENG Kequan et al Effects of drying methods on theantioxidant activities of polysaccharides extracted from Ganoderma lucidum[J]. Carbohydrate Polymers′2012′87(2): 1849-1854.
[33] LI Bing LIU Song XING Ronge et al Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J]. Carbohydrate Polymers′2013′92(2): 1991-1996.
[34] KOZARSKI M KLAUS A NIKSIC M et al Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agaricus bisporus Agaricus brasiliensis Ganoderma lucidum and Phellinus linteus[J]. Food Chemistry′2011′129(4): 1667-1675.
[35] WANG Jianguo WANG Yutang LIU Xuebo et al Free radical scavenging and immunomodulatory activities of Ganoderma lucidum polysaccharides derivatives[J]. Carbohydrate Polymers′2013′91(1): 33-38.
[36] BARAHONA T EMCINAS M V MANSILA A et al A sulfated galactan with antioxidant capacity from the green variant of tetrasporic Gigartina skottsbergii (Gigartinales Rhodophyta)[J]. Carbohydrate Research′2012′347(1): 114-120.
[37] HUANG S J TSAI S Y MAU J L Antioxidant properties of methanolic extracts from Agrocybe cylindracea[J]. LWT-Food Science and T echnology′2006′39(4): 379-387.
[38] PAN Yingming WANG Kai HUANG Siqin et al Antioxidant activity of microwave-assisted extract of longan (Dimocarpus longan Lour.) peel[J]. Food Chemistry′2008′106(3): 1264-1270.
[39] WANG Shihui DONG Xiaoyan SUN Yan Effect of (+)-epigallocatechin-3-gallate on human insulin fibrillation/aggregation kinetics[J]. Biochemical Engineering Journal′2012′63: 38-49.
[40] SHEN Shian CHEN Daju LI Xu et al Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J]. Carbohydrate Polymers′2014′104(4): 80-86.
[41] 徐怀德′秦盛华. 超声波辅助提取光皮木瓜多糖及其体外抗氧化性研究[J]. 食品科学′2010′31(10): 106-111.
[42] HUA Dehong ZHANG Dezhi HUANG Bing et al Structural characterization and DPPH radical scavenging activity of a polysaccharide from Guara fruits[J]. Carbohydrate Polymers′2014′103(12): 143-147.
Physicochemical Properties and Antioxidant Activity of Polysaccharide Extracted from Haematococcus pluvialis with Three Different Methods
LIU Yang WANG Shihui LIU Yun*
(Beijing Key Laboratory of Bioprocess College of Life Science and Technology Beijing University of Chemical Technology Beijing 100029′China)
Three different methods ultrasonic-assisted acid extraction ultrasonic-assisted alkali extraction and ultrasonicassisted water extraction were compared to extract polysaccharides from Haematococcus pluvialis with respect to yield and physicochemical characteristics The results showed that polysaccharide yield decreased in the following order alkali extraction (9.52%) > acid extraction (1.50%) > water extraction (1.29%). Scanning electron microscopy (SEM demonstrated that the cell wall of algae was most seriously damaged by ultrasonic-assisted alkali extraction leading to the largest amount dissolved polysaccharides In addition the polysaccharides extracted by ultrasonic-assisted acid extraction had the strongest absorption peaks on Fourier transform infrared spectroscopy (FTIR spectra and all the three polysaccharides contained pyranose monomers in their structures The main hemiacetal hydroxyl was α configuration The antioxidant analyses of 1′1-dipheny1-2-picrylhydrazyl (DPPH)′hydroxyl radical scavenging activities and reducing power testes showed that the polysaccharides extracted by these three methods all presented some natural antioxidant activities Among them the polysaccharide extracted by ultrasonic-assisted alkali extraction showed the strongest antioxidant activity It is concluded that ultrasonic-assisted alkali extraction is an effective method for extracting polysaccharides from H. pluvialis.
Haematococcus pluviali polysaccharide ultrasonic-assisted extraction physicochemcial properties antioxidant activity
TS202.1
A
1002-6630(2015)06-0161-08
10.7506/spkx1002-6630-201506030
2014-06-15
北京市自然科学基金项目(5142013)
刘杨(1990—),女,硕士研究生,研究方向为天然活性成分及其与蛋白质相互作用机理。E-mail:liuyangtjbd@126.com
*通信作者:刘云(1972—),男,教授,博士,研究方向为生物炼制、食品科学。E-mail:liuyun@mail.buct.edu.cn
