藤黄果提取物对雄性大鼠脂代谢的影响及降脂机理
2015-12-13刘冠星韩宁宁马海田
刘冠星,韩宁宁,马海田
(南京农业大学 农业部动物生理生化重点实验室,江苏 南京 210095)
藤黄果提取物对雄性大鼠脂代谢的影响及降脂机理
刘冠星,韩宁宁,马海田*
(南京农业大学 农业部动物生理生化重点实验室,江苏 南京 210095)
以雄性大鼠为研究对象,探讨日粮中添加不同剂量的藤黄果提取物对大鼠脂代谢常规生化指标及相关基因表达的影响。结果表明:日粮中添加不同剂量的藤黄果提取物均可显著降低大鼠血清中甘油三酯的含量(P<0.05),高剂量藤黄果提取物则可显著降低肝脏组织中甘油三酯的含量(P<0.05);不同剂量藤黄果提取物处理对血清和肝脏组织中总胆固醇含量均无显著影响(P>0.05)。脂肪代谢相关基因分析结果表明:高剂量藤黄果提取物处理可显著抑制SREBP1c(P<0.01)和ACL(P<0.05)基因表达水平,同时显著提高ACO和ATGL基因表达水平(P<0.05);MCD和PPARα基因表达水平在中剂量(P<0.05)和高剂量(P<0.01)藤黄果提取物处理组显著高于对照组;高剂量藤黄果提取物处理可显著促进AMPKα1和AdipoR-1基因表达水平(P<0.05),但对脂联素基因表达水平没有影响。以上结果提示,藤黄果提取物处理可通过激活Adipo-AMPK信号通路,进而抑制脂肪酸合成途径中的关键因子、增强脂肪酸氧化途径中的关键因子基因的表达,最终降低雄性大鼠体内脂肪的沉积。
藤黄果提取物;羟基柠檬酸;脂代谢;5’-腺苷-磷酸激活的蛋白激酶
在现代社会,肥胖的发生率越来越高,无论在发达国家还是发展中国家,都已成为重要的健康问题[1-3]。肥胖是很多疾病的重要诱因,例如:关节炎、糖尿病、心脑血管疾病及高血压甚至癌症[2-4]。肥胖表现为长期的食物摄入与能量支出的失衡。因此,抗肥胖的食物或食品添加剂如果能够有效地减少脂肪堆积,就可以避免肥胖,进而对肥胖引起的疾病起到一定的预防效果[4]。
藤黄有与众不同的酸味,南亚的许多国家作为调料一直使用了几个世纪[5]。常用作研究的为Garcinia cambogia,又称马拉巴尔罗望子(Malabar tamarind),是一种小型或中型的藤黄科果树,其果实已被用于提升肉类及海鲜的风味,调制饮料,还曾经用于鱼类的保鲜。(-)-羟基柠檬酸((-)-hydroxycitric acid,(-)-HCA)是藤黄果提取物中的主要成分。人体实验大量研究发现,(-)-HCA可以通过抑制脂肪的合成、抑制食欲等机制,从而达到减轻体质量的功效,且目前已经有商品化的健康食品投入市场[6-7]。虽然藤黄果提取物及其主要成分(-)-HCA因具有独特的生物学功能而引起生物学家的广泛关注,但其调控机体脂肪代谢的生物化学机制还不是很清楚。因此,本实验以雄性Sprague-Dawley(SD)大鼠为研究对象,探讨长期饲喂藤黄果提取物对SD大鼠体质量、脂代谢常规生化指标及相关基因表达的影响,以期为其作为降脂调节剂在人类医学和畜牧生产中的应用提供理论基础和实验依据。
1 材料与方法
1.1 材料、试剂与仪器
藤黄果提取物 郑州安誉科技有限公司。
(-)-羟基柠檬酸(纯度56%~58%) 上海微谱化工技术服务有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、游离脂肪酸(free fatty acid,FFA)、血糖检测试剂盒 南京建成生物工程研究所;反转录所用试剂 美国Vazyme Biotech公司。
UV-2100型分光光度计 上海尤尼柯仪器有限公司;MIKRO-22R型高速冷冻离心机 德国Andreas Hettich GmbH公司;核酸浓度测定仪 德国Eppendorf公司;TPERSONRAL型PCR仪 美国Biometra公司。
1.2 动物及处理
雄性SD大鼠(动物合格证号0013070,动物使用许可证号SCXK(苏)2009-0002),220 g左右,购自江苏大学实验动物中心。
60 只SD大鼠饲养期间,自由采食饮水,自然光照。适应性饲养一周后,随机分为4 组:普通饮食组(NC组,n=15)、藤黄果提取物低剂量组(NC+L组,n=15)、藤黄果提取物中剂量组(NC+M组,n=15)和藤黄果提取物高剂量组(NC+H组,n=15)。饲料由江苏协同生物工程有限责任公司加工配制,各实验组饲料中含藤黄果提取物分别为0、25、50、75 g/kg,内含有效成分(-)-HCA 56%~58%,实验饲养8 周后,采集血液和肝脏、睾丸周围脂肪等组织,待测。
1.3 生长性能的检测
记录实验期大鼠体质量增加情况,称量肝脏、睾脂的质量。计算肝脏指数和睾脂指数。

1.4 血清及肝脏生化指标测定
采用试剂盒法检测血清及肝脏组织中TG、TC、FFA和血糖水平,所用试剂盒均购自南京建成生物工程研究所。
1.5 脂代谢相关基因检测
1.5.1 总RNA提取
取SD大鼠肝脏组织样品,用Trizol试剂提取总RNA,紫外分光光度计和变性琼脂糖凝胶电泳测定总RNA浓度与纯度(OD260nm/OD280nm=1.8~2.0)。
1.5.2 反转录

表1 基因引物序列Table 1 Primer sequences for target genes
反转录采用20 μL体系:12 μmol/L随机引物、0.5 mmol/L dNTP、20 U/μL RNA酶抑制剂、10 U/μL反转录酶、4 μL 5×RT Buffer(250 mmol/L Tris-HCl(pH 8.3)、50 mmol/L MgCl2、250 mmol/L KCl、50 mmol/L二硫苏糖醇(dithiothreitol,DTT)、2.5 mmol/L亚精胺)。反转录流程为:RNA模板,dNTP和随机引物混合,70 ℃变性5 min,立即冷却,加入其余试剂37 ℃反应60 min,95 ℃灭活5 min。所得产物放于-20 ℃保存备用。脂代谢相关基因引物序列使用Primer 5.0软件设计,由Invitrogen生物技术有限公司合成。引物序列及相关参数如表1所示。
1.5.3 实时定量-聚合酶链式反应(real time quantitypolymerase chain reaction,RTQ-PCR)
实时定量PCR使用20 μL反应体系:2 μL cDNA模板、10 μL AceQTMqP CR SYBR®Green Master Mix、目的基因引物2 μL、灭菌蒸馏水加入使体系体积至20 μL。PCR反应条件如下: 95 ℃ 10 s、60 ℃ 5 s、72 ℃ 30 s、40 个循环。
1.6 数据分析
2 结果与分析
2.1 藤黄果提取物对大鼠体质量增加及肝脏、睾脂指数的影响

图1 藤黄果提取物对大鼠体质量增加及肝脏、睾脂指数的影响Fig.1 Effect of Garcinia cambogia extract on body weight gain and relative weights of liver and epididymal fat pad in rats
由图1A可知,不同剂量的藤黄果提取物对实验大鼠体质量增加量的影响均无统计学上的显著性变化。但添加中剂量和高剂量的藤黄果提取物有降低大鼠体质量增加的趋势,其体质量分别较普通饮食组降低了7%和2%。与普通饮食组相比,添加不同剂量的藤黄果提取物均可显著降低雄性大鼠肝脏指数(P<0.01)(图1B);睾脂指数虽无显著性变化(P>0.05),但添加高剂量的藤黄果提取物使睾脂指数较普通饮食组降低了14%(图1C)。
2.2 藤黄果提取物对大鼠血清脂代谢相关生化指标的影响
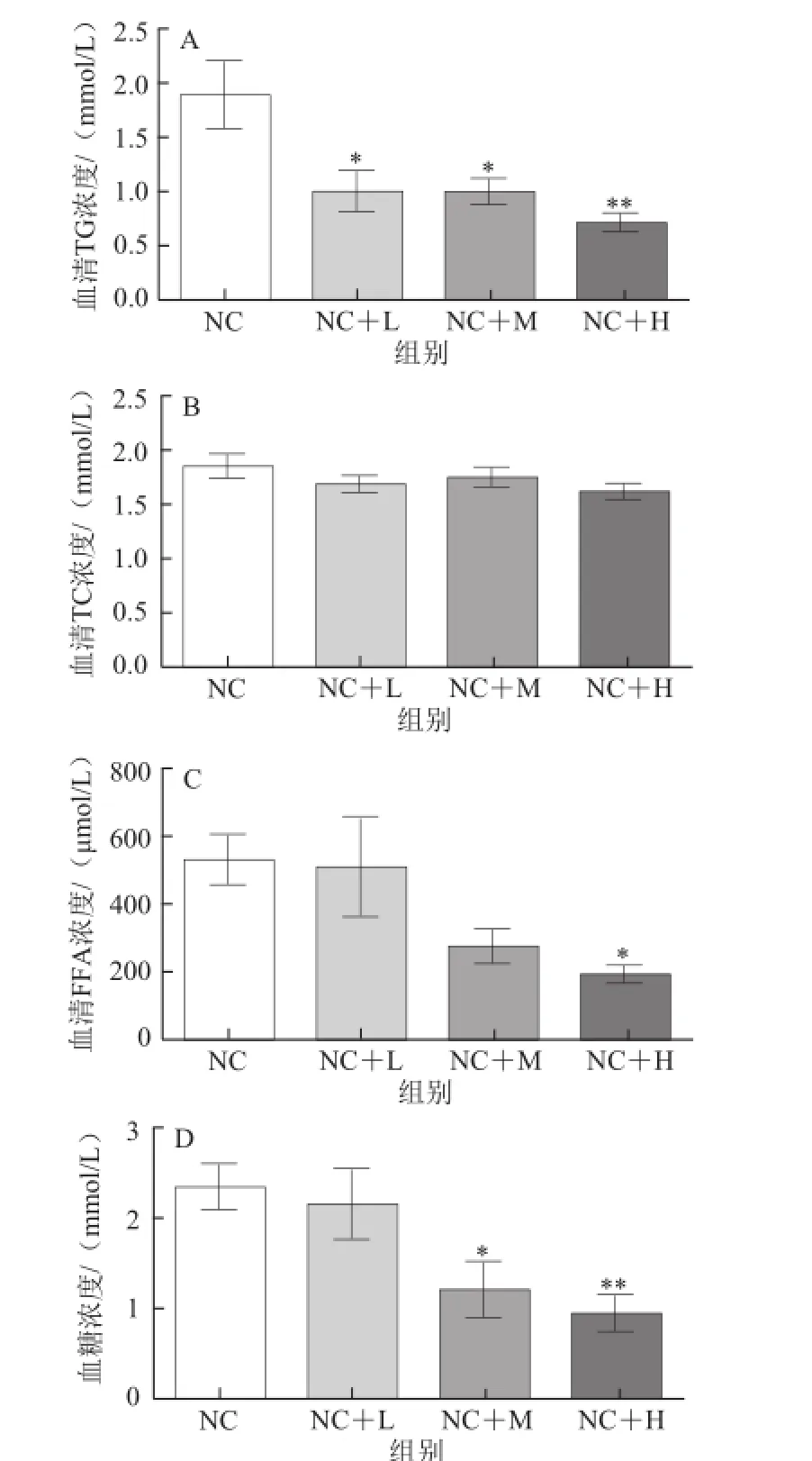
图2 藤黄果提取物对大鼠血清脂代谢相关指标的影响Fig.2 Effect of Garcinia cambogia extract on lipid metabolic parameters in serum of rats
如图2所示,日粮中添加低、中剂量的藤黄果提取物均可显著降低大鼠血清中TG的含量(P<0.05),添加高剂量的藤黄果提取物则可极显著降低血清中TG的含量(P<0.01)。与普通饮食组相比,添加中、高剂量的藤黄果提取物可显著降低血清中血糖的含量(P<0.05),添加高剂量的藤黄果提取物可显著降低血清FFA的含量(P<0.05);但与普通饮食组相比,添加不同剂量的藤黄果提取物对血清中TC的含量均无显著影响(P>0.05)。
2.3 藤黄果提取物对大鼠肝脏TG和TC水平的影响
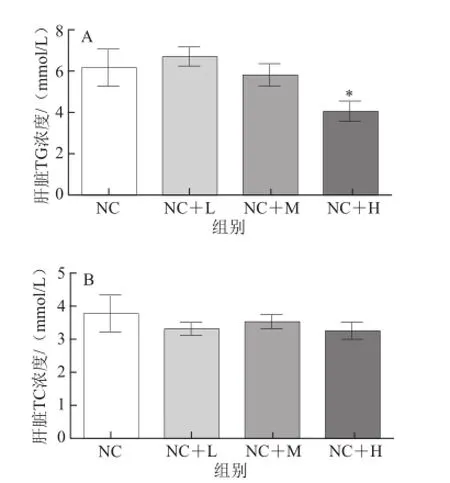
图3 藤黄果提取物对大鼠肝脏中TG和TC浓度的影响Fig.3 Effect of Garcinia cambogia extract on lipid metabolic parameters in liver of rats
如图3所示,日粮中添加不同剂量的藤黄果提取物对大鼠肝脏中TC含量无显著影响(P>0.05)。但添加高剂量的藤黄果提取物显著降低肝脏组织中TG的含量(P<0.05)。
2.4 藤黄果提取物对大鼠肝脏脂代谢相关基因表达的影响
2.4.1 藤黄果提取物对大鼠肝脏脂肪合成代谢相关基因表达的影响
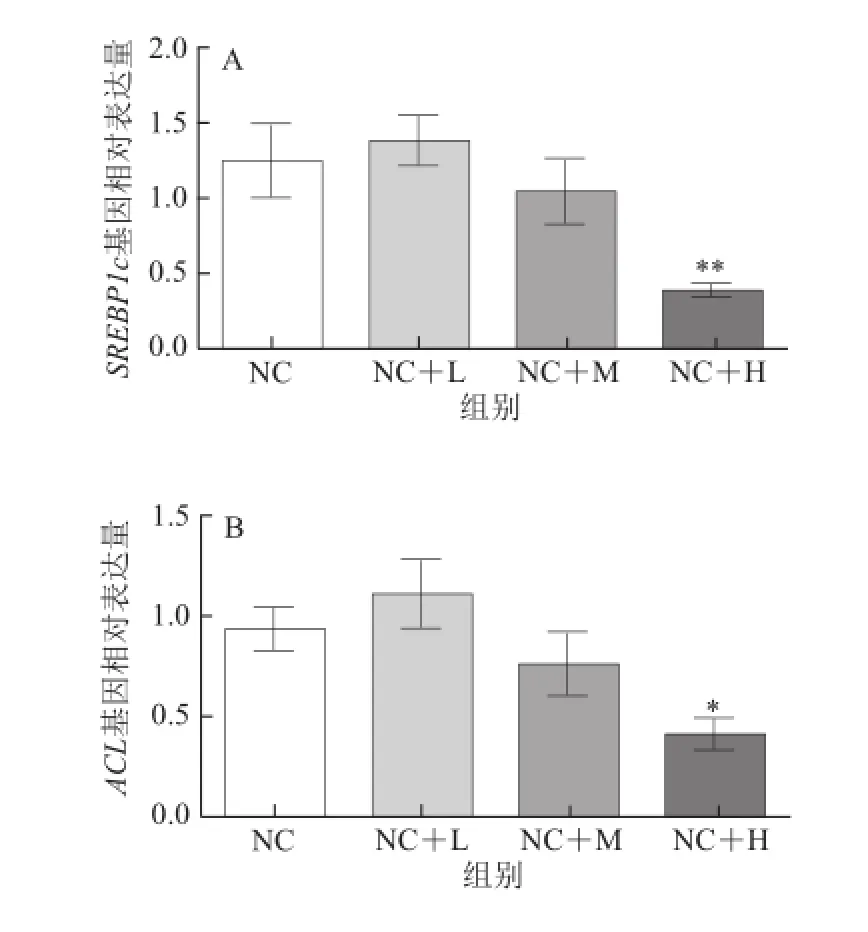
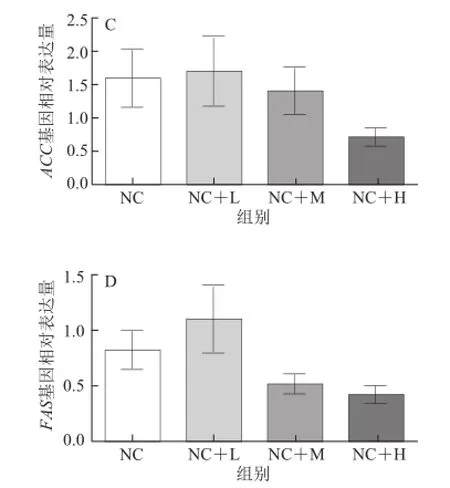
图4 藤黄果提取物对大鼠肝脏脂肪合成代谢相关基因表达的影响Fig.4 Effect of Garcinia cambogia extract on lipid anabolism related genes mRNA expression in the hepatic tissue of rats
如图4所示,与普通饮食组相比,日粮中添加高剂量的藤黄果提取物可降低大鼠肝脏组织中固醇调节元件结合蛋白-1(sterol regulatory element-binding proteins-1,SREBP-1)基因的表达(P<0.01)和ATP-柠檬酸裂解酶(ATP citr ate lyase,ACL)(P<0.05)基因的表达水平。添加不同剂量的藤黄果提取物对肝脏组织中乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS)基因表达均无统计学上的显著影响(P>0.05),但高剂量藤黄果提取物处理组大鼠肝脏组织中ACC及FAS基因表达水平分别较普通饮食组下降了55%和49%。
2.4.2 藤黄果提取物对大鼠肝脏脂肪分解代谢相关基因表达的影响

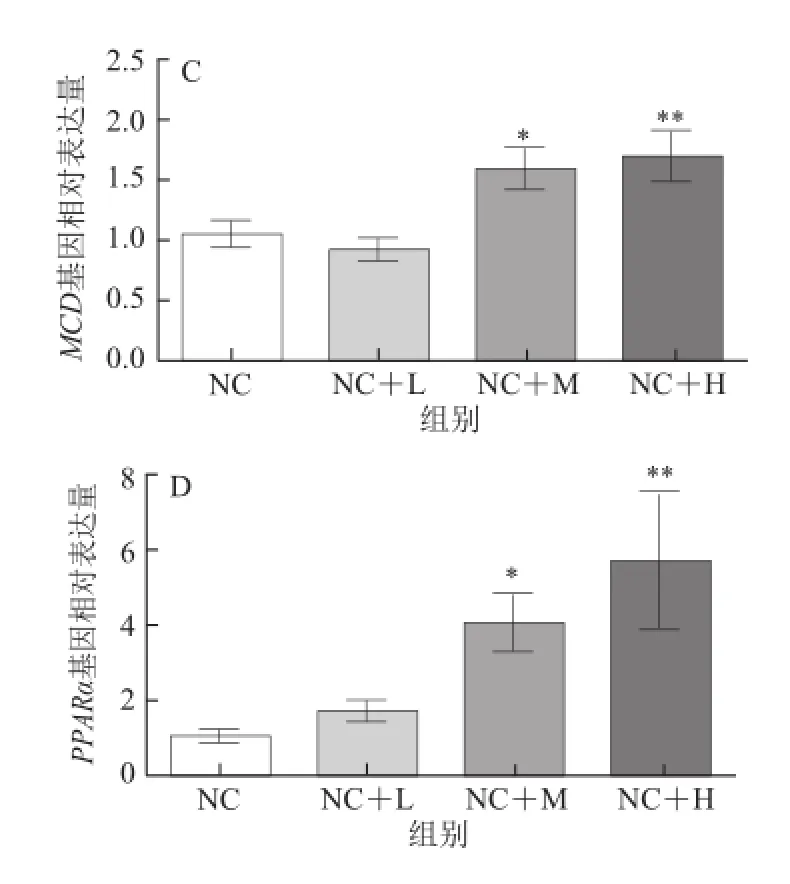
图5 藤黄果提取物对大鼠肝脏脂肪分解代谢相关基因表达的影响Fig.5 Effect of Garcinia cambogia extract on lipolysis metabolism related genes mRNA expressio n in the hepatic tissue of rats
由图5可知,乙酰辅酶A氧化酶(acyl-CoA oxidase,ACO)、脂肪三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)基因表达水平在高剂量藤黄果提取物处理组均显著高于普通饮食组(P<0.05);丙二酰辅酶脱羧酶(malonyl CoA decarboxylase,MCD)和过氧化物酶体增殖物激活受体α( peroxisome proliferators-activativated receptor-α,PPARα)基因表达水平在中剂量藤黄果提取物处理组均显著高于普通饮食组(P<0.05),而在高剂量藤黄果提取物处理组则极显著高于普通饮食组(P<0.01)。
2.5 藤黄果提取物对大鼠AMPKα1和AMPKα2基因表达的影响

图6藤黄果提取物对大鼠AMPKα1MPK1和AMPKα2MPK2基因表达的影响Fig.6 Effect of Garcinia cambogia extract on AMPKα1 and AMPKα2 mRNA expression in the hepatic tissue of rats
如图6所示,5’-腺苷-磷酸激活的蛋白激酶α1(adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPKα1)基因表达水平在高剂量藤黄果提取物处理组显著高于普通饮食组(P<0.05),但添加不同剂量的藤黄果提取物对5’-腺苷-磷酸激活的蛋白激酶α2(adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPKα2)基因表达则无显著影响(P>0.05)。
2.6 藤黄果提取物对脂联素及其受体基因表达的影响
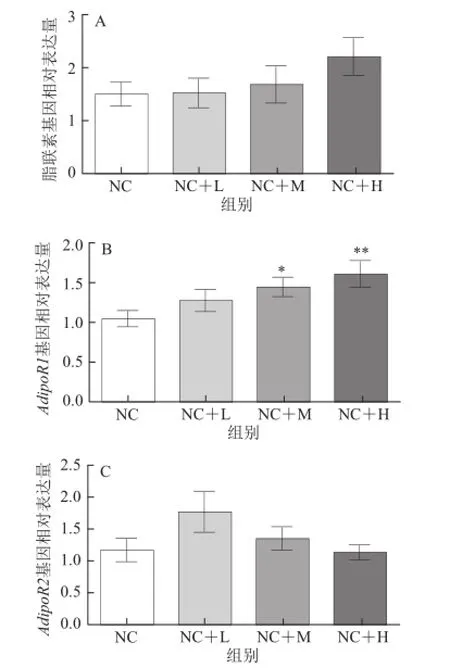
图7 藤黄果提取物对大鼠脂联素及其受体基因表达的影响Fig.7 Effect of Garcinia cambogia extract on Adiponectin and AdipoR mRNA expression in the hepatic tissue of rats
如图7所示,不同剂量藤黄果提取物处理对脂联素基因表达水平无显著影响(P>0.05)。脂联素受体-1(adiponectin receptor-1,AdipoR-1)基因表达水平在中、高剂量藤黄果提取物处理组均显著高于普通饮食组(P<0.05或P<0.01),但不同剂量的藤黄果提取物处理对脂联素受体-2(adiponectin receptor-2,AdipoR-2)基因表达水平则无显著影响(P>0.05)。
3 讨 论
本研究结果表明,添加不同剂量的藤黄果提取物对大鼠体质量增加量和睾脂指数均无统计学上的显著影响,但添加高剂量的藤黄果提取物有降低大鼠体质量增加量和睾脂指数的趋势,且与普通饮食组相比体质量增加量和睾脂指数分别下降了2%和14%。在大鼠及人类的相关研究中,藤黄果提取物中的有效成分(-)-HCA可以降低体质量增加量,并减少脂肪堆积[5,8-9],这与本实验的结果基本相符。本研究结果表明,添加不同剂量的藤黄果提取物处理均可极显著地降低大鼠肝脏指数,这与Kim[9]、Onakpoya[10]等的研究结果相符合,其机制可能与(-)-HCA可以减少内脏脂肪堆积、并且增强机体的新陈代谢有关。从血清和肝脏组织中相关生化指标可以看出,添加不同剂量的藤黄果提取物均可显著性地降低血清中TG的含量,而添加高剂量的藤黄果提取物可显著性地降低肝 脏组织中TG的含量, 并且降低血清中FFA和血糖水平。提示藤黄果提取物对于雄性大鼠有一定的降糖、降脂作用。许多研究都显示藤黄果提取物(或其主要成分(-)-HCA)对于控制肥胖及其他代谢有一定影响,例如控制脂肪堆积、血脂异常等[4,9,11-13],这与本实验的结果相符。
动物脂肪代谢与脂肪的合成、分解过程息息相关。ACL是一种线粒体外酶,该酶参与线粒体外脂肪酸的合成[14]。本研究结果表明,添加高剂量的藤黄果提取物可抑制ACL基因的表达水平。早在1970年,Lowenstein[15]就已经确定了(-)-HCA是此种酶的竞争性抑制剂。在体内实验或是体外实验中都已证明(-)-HCA可以引起乙酰辅酶A含量的降低,因而可以限制各个组织中脂肪酸和胆固醇的生物合成[15-16]。ACC是催化脂肪酸合成的限速酶,其可催化胞液中乙酰CoA羧化为丙二酸单酰CoA。FAS继而催化丙二酸单酰CoA和乙酰CoA缩合、还原等一系列反应,最终生成脂肪酸[17]。本实验结果表明,添加不同剂量的藤黄果提取物对肝脏组织中ACC和FAS基因表达水平均无显影响,结合ACL基因表达情况分析,其原因可能是因(-)-HCA抑制ACL基因表达导致在细胞液中用于生成脂肪酸前体的乙酰CoA含量的减少所致。SREBP-1是重要的核转录因子之一,能与脂质合酶基因的启动子/增强子的固醇调节元件结合而激活靶基因转录,从而特异性调控胆固醇和脂肪酸合成[18]。本实验中研究表明,日粮中添加高剂量的藤黄果提取物处理可极显著地抑制SREBP1c基因表达。提示:日粮中添加藤黄果提取物可通过调节SREBP-1基因的表达而影响肝脏组织中脂肪酸的合成,从而导致TG含量的减少。
ATGL是脂肪分解的关键酶,与TG的分解代谢过程密切相关。ATGL可以显著的提升甘油三酯酯酶的活性并且催化脂类分解的第一步限速反应[19]。本实验中添加高剂量的藤黄果提取物处理可导致肝脏组织中ATGL表达量增强,说明藤黄果提取物可以加强肝脏组织中甘油三酸的分解,这与藤黄果提取物处理可导致肝脏组织中甘油三酸含量下降的结果相一致。PPARs属于细胞核受体超家族,是配体依赖的转录因子,其调节脂类及脂蛋白代谢,影响脂肪酸的摄取和分解[20-22]。PPARα是PPARs家族成员之一,它的下游基因如ACO和肉毒碱棕榈酰转移酶-1(carnitine palmitoyl transterase-1,CPT-1)等参与脂类分解[20]。本次实验研究结果发现,添加藤黄果提取物的可以导致PPARα和ACO基因表达水平的提高,说明藤黄果提取物处理可促进大鼠肝脏脂肪酸的分解代谢。MCD可以降低丙二酰CoA水平,进而解除对CPT-1的抑制,促进脂肪酸氧化[22-24]。本实验结果表明,添加藤黄果提取物可促进MCD的基因表达,该结果进一步说明藤黄果提取物可加速脂肪酸的氧化,进而减少脂肪的沉积。
AMPK在调节动物机体脂肪酸的合成、胆固醇的合成、促进脂肪酸的氧化等方面均有重要的作用。脂肪代谢过程中的关键因子SREBP-1、ACC、MCD、ATGL等均是AMPK下游的靶蛋白因子。已有研究报道,活化的AMPK通过磷酸化乙酰辅酶A羧化酶抑制其活性,并促进丙二酰辅酶脱羧酶MCD表达及活化,从而降低丙二酰CoA水平,解除对CPT-1的抑制,促进脂肪酸氧化[23-24]。本实验结果表明,高剂量的藤黄果提取物处理可显著提高大鼠肝脏组织中AMPKα1的基因表达水平。脂联素是一种主要由脂肪组织分泌的脂肪细胞因子,它所介导的信号通路中,脂联素首先要与脂联素受体结合,进而传递信号激活下游信号通路,其中AMPK是脂联素信号调节的重要关键因子[25]。本研究结果表明,藤黄果提取物处理虽然对脂联素基因表达没有显著影响,但中、高剂量的藤黄果提取物处理可显著升高肝脏组织中AdipoR-1的表达量。该研究结果提示,藤黄果提取物对大鼠脂肪代谢的调节作用与Adipo-AMPK信号通路密切相关。
综合以上结果分析,日粮中添加藤黄果提取物可能通过激活Adipo-AMPK信号通路,进而抑制脂肪酸合成途径中的关键因子、增强脂肪酸氧化途径中的关键因子基因的表达,最终降低雄性大鼠体内脂肪的沉积。
[1] SUGERMAN H J, WOLFE L G, SICA D A, et al. Diabetes and hypertension in severe obesity and effects of gastric bypass-induced weight loss[J]. Annals of Surgery, 2003, 237(6): 751-758.
[2] STRACZKOWSKI M, KOWALSKA I, STEPIEN A, et al. Insulin resistance in the first-degree relatives of persons with type 2 diabetes[J]. Med Science Monitor, 2003, 9(5): CR186-CR190.
[3] SEIDELL J C. Obesity in Europe[J]. Obesity in Europe-Research Gate, 1995, 3(Suppl 2): 89-93.
[4] SAITO M, UENO M, OGINO S, et al. High dose of Garcinia cambogia is effective in suppressing fat accumulation in developing male Zucker obese rats, but highly toxic to the testis[J]. Food an d Chemical Toxicology, 2005, 43(3): 411-419.
[5] PREUSS H G, BAGCHI D, BAGCHI M, et al. Effects of a natural extract of (-)-hydroxycitric acid (HCA-SX) and a combination of HCA-SX plus niacin-bound chromium and Gymnema sylvestre extract on weight loss[J]. Diabetes Obesity Metabolism, 2004, 6(3): 171-180.
[6] LIM K, RYU S, NHO H S, et al. (-)-Hydroxycitric acid ingestion increases fat utilization during exercise in untrained women[J]. Journal of Nutritional Science and Vitaminology, 2003, 49(3): 163-167.
[7] KRIKETOS A D, THOMPSON H R, GREENE H, et al. (-)-Hydroxycitric acid does not affect energy expenditure and substrate oxidation in adult males in a post-absorptive state[J]. International Journal of Obessity Related Metabolic Disorders, 1999, 23(8): 867-873.
[8] HAYAMIZU K, ISHII Y, KANEKO I, et al. Effects of garcinia cambogia (hydroxycitric acid) on visceral fat accumulation: a doubleblind, randomized, placebo-controlled trial[J]. Current Therapeutic Research-Clinical and Experimental, 2003, 64(8): 551-567.
[9] KIM Y J, KIM K Y, KIM M S, et al. A mixture of the aqueous extract of Garcinia cambogia, soy peptide and L-carnitine reduces the accumulation of visceral fat mass in rats rendered obese by a high fat diet[J]. Genes & Nutrition, 2008, 2(4): 353-358.
[10] ONAKPOYA I, HUNG S K, PERRY R, et al. The use of garcinia extract (hydroxycitric acid) as a weight loss supplement: a systematic review and meta-analysis of randomised clinical trials[J]. Journal of Obesity, 2011, 2011: 509038. doi:10.1155/2011/509038.
[11] ROY S, SHAH H, RINK C, et al. Transcriptome of primary adipocytes from obese women in response to a novel hydroxycitric acid-based dietary supplement[J]. DNA and Cell Biology, 2007, 26(9): 627-639.
[12] ROY S, RINK C, KHANNA S, et al. Body weight and abdominal fat gene expression profi le in response to a novel hydroxycitric acid-based dietary supplement[J]. Gene Expression, 2004, 11(5/6): 251-262.
[13] KOVACS E M, WESTERTERP-PLANTENGA M S. Effects of (-)-hydroxycitrate on net fat synthesis as de novo lipogenesis[J]. Physiology & Behavior, 2006, 88(4/5): 371-381.
[14] 刘家仪, 李杨瑞, 杨丽涛. ATP-柠檬酸裂解酶研究进展[J]. 南方农业学报, 2014, 45(2): 204-208.
[15] LOWENSTEIN J M. Effect of (-)-hydroxycitrate on fatty acid synthesis by rat liver in vivo[J]. Journal of Biological Chemistry, 1971, 246(3): 629-632.
[16] SULLIVAN A C, TRISCARI J, HAMILTON J G, et al. Effect of (-)-hydroxycitrate upon the accumulation of lipid in the rat.Ⅰ. lipogenesis[J]. Lipids, 1974, 9(2): 121-128.
[17] CHEN N, BEZZINA R, HINCH E, et al. Green tea, black tea, and epigallocatechin modify body composition, improve glucose tolerance, and differentially alter metabolic gene expression in rats fed a high-fat diet[J]. Nutrition Research, 2009, 29(11): 784-793.
[18] 樊丹君, 许国强. 固醇调节元件结合蛋白与脂质代谢的研究进展[J].国际内科学杂志, 2007, 34(3): 152-154.
[19] ZIMMERMANN R, STRAUSS J G, HAEMMERLE G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306: 1383-1386.
[20] DESVERGNE B, WAHLI W. Peroxisome proliferator-activated receptors: nuclear control of metabolism[J]. Endocrine Reviews, 1999, 20(5): 649-688.
[21] CHINETTI G, FRUCHART J C, STAELS B. Peroxisome proliferatoractivated receptors (PPARs): nuclear receptors at the crossroads between lipid metabolism and inflammation[J]. Inflammation Research, 2000, 49(10): 497-505.
[22] DUVAL C, CHINETTI G, TROTTEIN F, et al. The role of PPARs in atherosclerosis[J]. Trends in Molecular Medicine, 2002, 8(9): 422-430.
[23] SAHA A K, SCHWARSIN A J, RODUIT R, et al. Activation of malonyl-CoA decarboxylase in rat skeletal muscle by contraction and the AMP-activated protein kinase activator 5-aminoimidazole-4-carboxamide-1-beta-D-ribofuranoside[J]. Journal of Biological Chemistry, 2000, 275(32): 24279-24283.
[24] RANEY M A, YEE A J, TODD M K, et al. AMPK activation is not critical in the regulation of muscle FA uptake and oxidation during low-intensity muscle contraction[J]. American Journal of Physiology-Endocrinology and Metabolism, 2005, 288(3): E592-598.
[25] 郭晓红, 吴立玲, 李丽. 脂联素调节糖脂代谢相关信号通路的研究进展[J]. 生理科学进展, 2010, 41(6): 471-474.
Effect and Mechanism of Garcinia cambogia Extract on Lipid Metabolism in Male Rats
LIU Guanxing, HAN Ningning, MA Haitian*
(Key Laboratory of Animal Physiology and Biochemistry, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
The aim of this study was to investigate the effect of Garcinia cambogia extract on lipid metabolism parameters and lipogenic gene mRNA expression in male rats. The results showed that dietary supplementation of Garcinia cambogia extract could significantly decrease serum triglyceride content in rats (P < 0.05). High dose of Garcinia cambogia extract could significantly reduce triglyceride content in the liver of rats (P < 0.05). No significantly difference was observed in total cholesterol content in serum and liver tissue between Garcinia cambogia extract treatment groups and the control group (P > 0.05). The expression of genes associated with lipid metabolism showed that high-dose Garcinia cambogia extract treatment could significantly inhibit the mRNA expression levels of SREBP1c (P < 0.01) and ACL (P < 0.05),while it could significantly increase the mRNA expression levels of ACO and ATGL (P < 0.05). PPARα and MCD mRNA expression levels were higher in the middle- (P < 0.05) and high-dose Garcinia cambogia extract treatment groups (P < 0.01) than that in the control group. High-dose Garcinia cambogia extract treatment could significantly promote the AMPKα1 and AdipoR-1 mRNA expression levels (P < 0.05), while having no effect on the adiponectin mRNA expression level (P > 0.05). In conclusion, Garcinia cambogia extract can reduce the accumulation of body fat in rats due to the activation of Adipo-AMPK signaling pathway, which can inhibit gene expression related to fatty acid synthesis and increase gene expression related to fatty acid oxidation in the liver of rats.
Garcinia cambogia extract; hydroxycitric acid; lipid metabolism; adenosine 5’-monophosphate (AMP)-activated protein kinase
Q493.2
A
1002-6630(2015)09-0202-07
10.7506/spkx1002-6630-201509038
2014-10-14
刘冠星(1988—),女,硕士研究生,研究方向为动物机能生物化学。E-mail:2012107015@njau.edu.cn
*通信作者:马海田(1974—),男,教授,博士,研究方向为营养生物化学。E-mail:mahaitian@njau.edu.cn
