外源蔗糖对萝卜幼苗品质及代谢酶活性的影响
2015-12-13赵晓帼罗云波
赵晓帼,朱 毅,罗云波
(中国农业大学食品科学与营养工程学院,北京 100083)
外源蔗糖对萝卜幼苗品质及代谢酶活性的影响
赵晓帼,朱 毅*,罗云波
(中国农业大学食品科学与营养工程学院,北京 100083)
以“满堂红”品种的萝卜为材料,探究不同质量浓度的外源蔗糖喷洒处理对不同生长天数的萝卜幼苗营养品质(花青素、叶绿素、类胡萝卜素、总酚和芥子油苷等含量)及代谢酶(过氧化物酶(peroxidase,POD)和苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL))活性的影响。结果表明:对于生长3、5 d和7 d的萝卜幼苗,0.4 g/100 mL和0.6 g/100 mL蔗糖处理均能够显著提高其花青素、叶绿素、类胡萝卜素、总酚、芥子油苷含量及POD、PAL活性(P<0.05),而0.2 g/100 mL蔗糖处理对其营养物质含量及抗氧化性的影响不显著(P>0.05);0.4 g/100 mL和0.6 g/100 mL蔗糖处理在改善其营养价值方面的差别不大。因此,在农业生产中,可采用质量浓度0.4 g/100 mL蔗糖喷洒处理萝卜幼苗来提高其营养价值。
萝卜;幼苗;蔗糖;品质;代谢酶
萝卜是一种重要的十字花科蔬菜,广泛被人类食用[1]。十字花科蔬菜中含有丰富的营养物质,如VC、VE、酚类化合物、类胡萝卜素、花青素、叶绿素和芥子油苷等。有研究报道,十字花科芽苗菜中营养物质(如芥子油苷、类胡萝卜素和酚类化合物)的含量是成熟蔬菜(如萝卜、西兰花、甘蓝等)的15~50 倍[2-4],国内外研究者采用不同的处理方式来提高其营养价值[1,5-9]。蔗糖是调控植物生长发育的信号分子,关于其促进植物营养物质累积的文献已有报道,但是蔗糖喷洒处理对萝卜幼苗品质的影响还未见报道。鉴于此,本实验以“满堂红”品种萝卜为试材,探究了不同质量浓度的外源蔗糖喷洒处理对不同生长天数的萝卜幼苗营养品质及代谢酶活性的影响,以期为农业生产提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
“满堂红”萝卜种子 北京京研盛丰种苗研究所。
2-丙烯基芥子油苷(sinigrin) 美国Sigma公司;Folin-酚试剂、没食子酸、乙醇、愈创木酚、过氧化氢国药集团化学试剂有限公司。
1.2 仪器与设备
DK-98-I恒温水浴锅 天津市泰斯特仪器公司;HZC-250恒温振荡培养箱 江苏太仓实验设备厂;5424R Eppendorf离心机 德国Eppendorf公司;M200 Pro多功能酶标仪 奥地利帝肯公司。
1.3 萝卜苗的栽培
挑选颗粒饱满、无霉变的满堂红萝卜种子用蒸馏水清洗后,置于5 mL/L的NaClO溶液中浸泡30 min。将NaClO溶液沥干并用蒸馏水清洗3~4 次后,置于蒸馏水中浸泡8 h。将浸泡后的种子均匀播撒在30 cm×20 cm的育苗盘内,育苗盘上铺有4 层纱布以防止育苗过程中水分过度流失。将播撒种子后的育苗盘置于23 ℃的培养室中避光催芽2 d后,转移至16 h光照/8 h黑暗的条件下培育生长,昼/夜温度为23 ℃/20 ℃,相对湿度为70%~75%。在培育过程中,每隔8 h分别用蒸馏水(对照)、0.2、0.4、0.6 g/100 mL蔗糖喷洒种子或幼苗。采集生长3、5 d和7 d的萝卜苗,在液氮中快速冷冻后,经封口袋包装置于—80 ℃冰箱中保存,以供后续实验用。
1.4 测定方法
花青素含量参考文献[10]的方法测定,单位是U/g,表示每克鲜质量样品所含的花青素单位数;叶绿素和类胡萝卜素含量参考文献[11]的方法测定;总酚含量参考文献[12]的方法测定;芥子油苷含量的测定采用氯化钯分光光度计法[13-14];苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)活力参考文献[15]的方法测定,以每小时每克样品酶促反应体系吸光度增加0.01为1 个PAL活力单位,记为U;过氧化物酶(peroxidase,POD)活力采用愈创木酚法测定[16],以每克鲜质量样品每分钟吸光度变化量增加1.0为1个POD活力单位,记为U。
1.5 数据统计分析
所有实验重复3 次,营养物质含量及酶活力均平行测定3 次,数据均采用SPSS 16.0(SPSS Inc., Chicago, IL,USA)软件进行邓肯氏多重差异分析,单因素方差分析(analysis of variance,ANOVA)(P<0.05)。
2 结果与分析
2.1 蔗糖对萝卜幼苗花青素含量的影响

图1 不同质量浓度蔗糖对不同生长天数的萝卜苗花青素含量的影响Fig.1 Effects of different concentrations of sucrose on anthocyanin content in radish sprouts
花青素是植物中普遍存在的一类天然色素。在萝卜苗中,花青素主要集中于子叶和茎中,不仅可以作为食用色素,而且对人体还具有一定的抗氧化和抗癌活性功效[10]。在生长过程中,分别采用蒸馏水(对照)、0.2、0.4、0.6 g/100 mL蔗糖溶液喷洒处理萝卜苗,结果见图1,随着生长天数的增加,其花青素含量越来越高。与对照组相比,生长3、5 d和7 d的萝卜苗,0.4 g/100 mL和0.6 g/100 mL蔗糖喷洒处理能显著提高其花青素含量(P<0.05),且随着萝卜苗生长天数的延长,0.4 g/100 mL蔗糖处理对其合成和累积的促进效果越显著(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理比对照组分别提高17.5%和29.2%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高31.0%和38.2%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高68.2%和60.9%,而0.2 g/100 mL蔗糖处理对花青素含量无显著影响(P>0.05)。Guo Rongfang等[17]研究表明,蔗糖可以提高西兰花幼苗中的花青素含量,与本实验结果相一致。有研究报道称,在拟南芥中,蔗糖作为一种信号分子能够促进花青素合成过程中相关基因的表达进而提高花青素的含量[18]。当处理萝卜苗的蔗糖质量浓度提高时,其诱导花青素合成过程中相关基因表达量增加,进而提高花青素的含量。随着生长天数的增加,适宜质量浓度的蔗糖持续诱导相关基因的表达,使得其促进花青素合成的效果越显著。
2.2 蔗糖对萝卜幼苗叶绿素含量的影响

图2 不同质量浓度蔗糖对不同生长天数的萝卜苗叶绿素含量的影响Fig.2 Effects of different concentrations of sucrose on chlorophyll content in radish sprouts
叶绿素是植物体进行光合作用必需的元素。如图2所示,0.4 g/100 mL和0.6 g/100 mL的外源蔗糖处理能显著提高萝卜幼苗叶绿素的含量(P<0.05),且随着生长天数的延长,0.4 g/100 mL蔗糖促进叶绿素积累的效果越明显(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理组叶绿素含量比对照组分别提高7.2%和11.9%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高12.3%和14.3%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高48.2%和38.9%。有研究报道,叶绿体的形成会受到糖的影响,葡萄糖处理能够抑制拟南芥幼苗叶绿体的形成[19],而本实验发现蔗糖处理后萝卜幼苗叶绿素含量显著提高,有利于幼苗进行光合作用,与刘丽萍[20]研究结果一致,此差异可能是由于植物种类和糖种类的不同造成的。随着生长天数的延长,叶片面积逐渐增大,光合作用越明显,适宜质量浓度蔗糖的促进作用越显著。
2.3 蔗糖对萝卜幼苗类胡萝卜素含量的影响
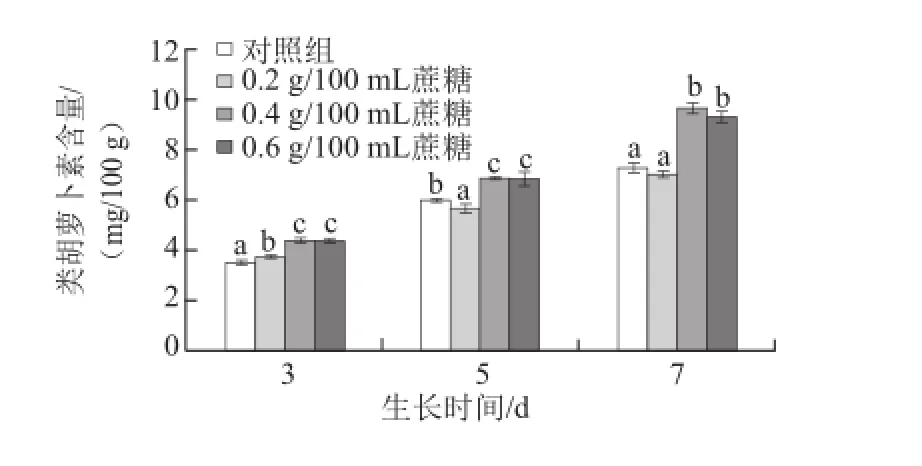
图3 不同质量浓度蔗糖对不同生长天数的萝卜苗类胡萝卜素含量的影响Fig.3 Effects of different concentrations of sucrose on carotenoid content in radish sprouts
类胡萝卜素是一类对人体有较多生理功能的色素。如图3所示,随着萝卜苗生长天数的增加,其类胡萝卜素含量逐渐升高;0.4 g/100 mL和0.6 g/100 mL蔗糖处理均能显著地提高生长3、5 d和7 d的萝卜苗中类胡萝卜素的含量(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理组的类胡萝卜素含量比对照组分别提高24.6%和24.4%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高11.1%和13.7%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高32.4%和27.6%。该结果与叶绿素的变化趋势一致,原因可能在于这两种色素的合成途径较相似[21],且含量呈现正相关关系[22]。
2.4 蔗糖对萝卜幼苗总酚含量的影响

图4 不同质量浓度蔗糖对不同生长天数的萝卜苗总酚含量的影响Fig.4 Effects of different concentrations of sucrose on total phenolic content in radish sprouts
酚类化合物在植物抗氧化体系中具有重要作用[17]。酚类化合物的合成或积累受到多种外界环境条件和外源诱导因子的影响[23-25]。如图4所示,0.4 g/100 mL和0.6 g/100 mL蔗糖处理均能显著提高生长3、5 d和7 d的萝卜苗中总酚含量(P<0.05)。随着天数的延长,0.4 g/100 mL蔗糖促进其合成或积累的效果越明显(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理组的总酚含量比对照组分别提高11.8%和20.4%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高16.5%和17.4%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高38.2%和38.1%。该发现与Guo Rongfang等[17]研究结果一致,可能是由于蔗糖引起的渗透压所致。外源蔗糖会提高萝卜幼苗体内的渗透压,造成细胞失水,影响其新陈代谢,进而提高总酚含量。随着生长天数的增加,适宜质量浓度的蔗糖持续作用于萝卜苗,使得其促进总酚含量提高的效果越明显。
2.5 蔗糖对萝卜幼苗芥子油苷含量的影响
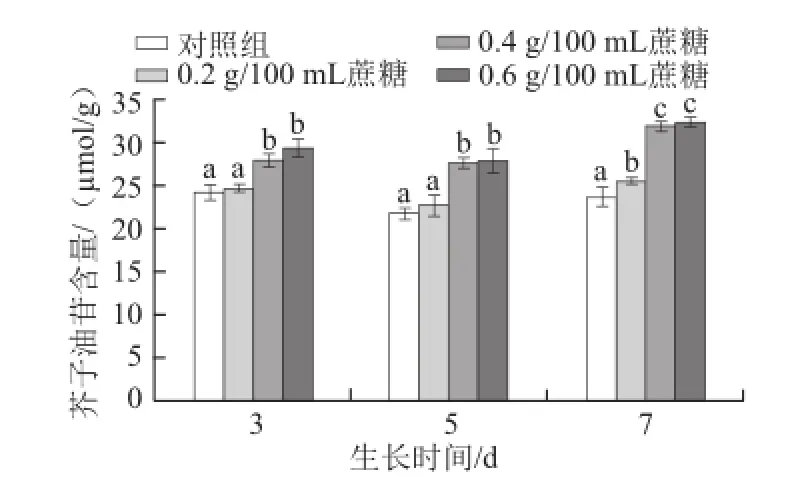
图5 不同质量浓度蔗糖对不同生长天数的萝卜苗芥子油苷含量的影响Fig.5 Effects of different concentrations of sucrose on total glucosinolate content in radish sprouts
芥子油苷作为十字花科蔬菜中广泛存在的次级代谢产物,其对人体有着重要的生理功能,如抗癌和保护细胞等[26]。芥子油苷的合成受到多种因素的调控,如植物激素[25]、光照[27]、采后包装[28]、水分[29-30]和二氧化碳[31]等。如图5所示,对于生长3 d和5 d的萝卜苗,0.4 g/100 mL和0.6 g/100 mL蔗糖能显著提高其芥子油苷含量(P<0.05),而对于生长7 d的萝卜苗,0.2、0.4 g/100 mL和0.6 g/100 mL蔗糖均能显著提高其含量(P<0.05)。随着生长天数的增加,0.4 g/100 mL和0.6 g/100 mL的蔗糖促进芥子油苷合成或积累的效果越明显(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理比对照组分别提高15.0%和21.0%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高26.9%和28.2%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高35.1%和37.0%。Guo Rongfang等[17]研究发现,用相同质量浓度蔗糖和甘露糖醇处理西兰花幼苗,均能提高芥子油苷含量,但两者对其含量的影响差别不大,推断造成此现象的原因可能在于渗透压的作用。外源蔗糖会提高萝卜幼苗体内的渗透压,造成细胞失水,进而提高芥子油苷的含量。而Guo Rongfang等[6]研究发现,蔗糖处理西兰花幼苗可提高芥子油苷合成过程中相关基因的表达量,进而提高芥子油苷含量。
2.6 蔗糖对萝卜幼苗PAL活性的影响
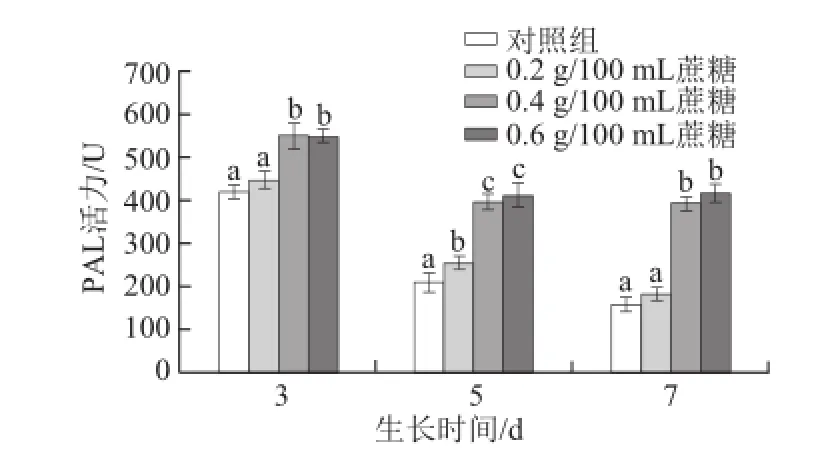
图6 不同质量浓度蔗糖对不同生长天数的萝卜苗PAL活性的影响Fig.6 Effects of different concentrations of sucrose on PAL activity in radish sprouts
研究报道称,苯丙氨酸解氨酶(PAL)是植物体内酚类化合物合成过程中重要的一种酶[32],PAL活性会受到外源茉莉酸甲酯和外界创伤的影响[24-25]。如图6所示,随着生长天数的增加,对照组萝卜苗PAL活性降低;0.4 g/100 mL和0.6 g/100 mL蔗糖处理萝卜苗均能显著提高其PAL活性(P<0.05),且生长天数越长其促进效果越明显(P<0.05)。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理组的PAL酶活力比对照组分别提高30.7%和30.2%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高86.4%和93.7%;7 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高145.8%和159.7%。该结果与总酚含量变化趋势相一致,其原因在于PAL是酚类化合物合成过程中较为重要的酶,PAL活性提高有利于总酚的合成过程中相关基因的表达而使其含量提高[33]。Guo Rongfang等[17]研究发现,用蔗糖处理西兰花幼苗,也可以显著提高其PAL活性。据此可推断,蔗糖可能通过诱导PAL合成或调控过程中相应基因的表达而导致其活性的增强。随着生长天数的增加,适宜质量浓度蔗糖持续作用的累积效应增强,使得其促进PAL活性提高的效果更显著。
2.7 蔗糖对萝卜幼苗POD活性的影响
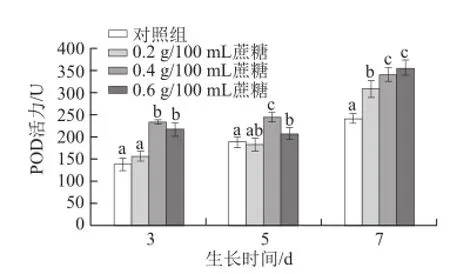
图7 不同质量浓度蔗糖对不同生长天数的萝卜苗POD活性的影响Fig.7 Effects of different concentrations of sucrose on POD activity in radish sprouts
过氧化物酶(POD)是植物体一种重要的组织抗氧化酶。如图7所示,随着生长天数的增加,POD活性逐渐增强。对于生长3 d和5 d的萝卜苗,0.4 g/100 mL和0.6 g/100 mL蔗糖处理均能显著提高其活性(P<0.05),而0.2 g/100 mL蔗糖处理效果不明显(P>0.05)。对于生长7 d的萝卜苗,0.2、0.4 g/100 mL和0.6 g/100 mL蔗糖处理均能显著提高其活性(P<0.05)。对于生长3 d的萝卜苗,蔗糖对其促进效果最好。3 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理组比对照组分别提高68.4%和56.4%;5 d苗:0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高29.6%和10.1%;7 d苗:0.2、0.4 g/100 mL和0.6 g/100 mL蔗糖处理分别提高27.7%、41.2%和47.2%。李小刚等[34]研究发现,用1 mmol/L的蔗糖处理在140 mmol/L NO3—胁迫下的黄瓜幼苗可以提高其POD活性,而当蔗糖浓度达5 mmol/L时,其抗氧化酶活性开始降低。贾晓琳[35]实验结果表明,外源糖可以提高POD相关基因表达,进而提高其活性。与此相反,刘丽萍[20]研究发现,外源蔗糖处理荞麦幼苗,可减低POD活性,造成此差异的原因可能在于植物种类及糖质量浓度的不同。
3 结 论
通过分析不同质量浓度蔗糖对不同生长天数的萝卜幼苗营养物质含量的影响可知:对于生长3、5、7 d的萝卜幼苗,0.4、0.6 g/100 mL蔗糖处理均能够显著提高其花青素、叶绿素、类胡萝卜素、总酚、芥子油苷的含量,而0.2 g/100 mL蔗糖处理对其营养物质含量的影响并不显著。
通过分析不同质量浓度蔗糖对不同生长天数的萝卜幼苗抗氧化酶活性的影响可知:对于生长3、5、7 d的萝卜幼苗,0.4、0.6 g/100 mL蔗糖处理均能够显著提高POD和PAL活力,而0.2 g/100 mL蔗糖处理对其活性影响并不显著。
综上所述,用不同质量浓度蔗糖对不同生长天数的萝卜幼苗,0.4、0.6 g/100 mL蔗糖处理均能显著提高其综合营养价值,且随着生长天数的增加,0.4 g/100 mL蔗糖处理的效果最好。因此,在农业生产中,可采用质量浓度为0.4 g/100 mL的蔗糖喷洒处理萝卜幼苗来提高其营养价值。本研究提供了一种简便、经济的改善萝卜幼苗营养品质的方法。随着人们生活水平的提高和对饮食营养的重视,其在食品领域具有广阔的应用前景。
[1] ZHOU Chenguang, ZHU Yi, LUO Yunbo. Effects of sulfur fertilization on the accumulation of health-promoting phytochemicals in radish sprouts[J]. Journal of Agricultural and Food Chemistry, 2013,61(31): 7552-7559.
[2] BAENAS N, MORENO D A, GARCIA-VIGUERA C. Selecting sprouts of brassicaceae for optimum phytochemical composition[J]. Journal of Agricultural and Food Chemistry, 2012, 60(45): 11409-11420.
[3] SINGH J, UPADHYAY A K, PRASAD K, et al. Variability of carotenes, vitamin C, E and phenolics in Brassica vegetables[J]. Journal of Food Composition and Analysis, 2007, 20(2): 106-112.
[4] KOPSELL D E, KOPSELL D A, RANDLE W A, et al. Kale carotenoids remain stable while flavor compounds respond to changes in sulfur fertility[J]. Journal of Agricultural and Food Chemistry, 2003,51(18): 5319-5325.
[5] PEREZ-BALIBREA S, MORENO D A, GARCIA-VIGUERA C. Improving the phytochemical composition of broccoli sprouts by elicitation[J]. Food Chemistry, 2011, 129(1): 35-44.
[6] GUO Rongfang, YUAN Gaofeng, WANG Qiaomei. Sucrose enhances the accumulation of anthocyanins and glucosinolates in Broccoli sprouts[J]. Food Chemistry, 2011, 129(3): 1080-1087.
[7] YUAN Gaofeng, WANG Xiaoping, GUO Rongfang, et al. Effect of salt stress on phenolic compounds, glucosinolates, myrosinase and antioxidant activity in radish sprouts[J]. Food Chemistry, 2010,121(4): 1014-1019.
[8] PEREZ-BALIBREA S, MORENO D A, GARCIA-VIGUERA C. Glucosinolates in Broccoli sprouts (Brassica oleracea var. italica) as conditioned by sulphate supply during germination[J]. Journal of Food Science, 2010, 75(8): C673-C677.
[9] SCHONHOF I, BLANKENBURG D, MULLER S, et al. Sulfur and nitrogen supply influence growth, product appearance, and glucosinolate concentration of broccoli[J]. Journal of Plant Nutrition and Soil Science, 2007, 170(1): 65-72.
[10] TENG S, KEURENTJES J, BENTSINK L, et al. Sucrose-specific induction of anthocyanin biosynthesis in Arabidopsis requires the MYB75/PAP1 gene[J]. Plant Physiology, 2005, 139(4): 1840-1852.
[11] 王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006: 134-136.
[12] AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols, 2007, 2(4): 875-877.
[13] 刘念, 蒙大庆, 汤天泽, 等. 油菜硫代葡萄糖苷检测技术研究进展[J].湖北农业科学, 2011, 50(7): 1301-1304.
[14] 李培武, 周海燕. 油菜硫代葡萄糖苷检测技术研究进展[J]. 中国油料作物学报, 2008, 30(1): 127-131.
[15] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化试验指导[M]. 北京: 中国轻工业出版社, 2011: 142-144.
[16] 张爱琴, 朱钟. 植物生理学实验[M]. 北京: 北京大学出版社, 1990.
[17] GUO Rongfang, YUAN Gaofeng, WANG Qiaomei. Effect of sucrose and mannitol on the accumulation of health-promoting compounds and the activity of metabolic enzymes in broccoli sprouts[J]. Scientia Horticulturae, 2011, 128(3): 159-165.
[18] SOLFANELLI C, POGGI A, LORETI E, et al. Sucrose-specific induction of the anthocyanin biosynthetic pathway in Arabidopsis[J]. Plant Physiology, 2006, 140(2): 637-646.
[19] TO J P C, REITER W D, GIBSON S I. Chloroplast biogenesis by Arabidopsis seedlings is impaired in the presence of exogenous glucose[J]. Physiologia Plantarum, 2003, 118(3): 456-463.
[20] 刘丽萍. 外源蔗糖对荞麦种子萌发、幼苗生长和黄酮积累及根系耐盐性的影响[D]. 南京: 南京农业大学, 2011.
[21] KOPSELL D A, BARICKMAN T C, SAMS C E, et al. Influence of nitrogen and sulfur on biomass production and carotenoid and glucosinolate concentrations in watercress (Nasturtium offi cinale R. Br.)[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 10628-10634.
[22] REIF C, ARRIGONI E, SCHARER H, et al. Carotenoid database of commonly eaten Swiss vegetables and their estimated contribution to carotenoid intake[J]. Journal of Food Composition and Analysis, 2013,29(1): 64-72.
[23] GIORGI A, MINGOZZI M, MADEO M, et al. Effect of nitrogen starvation on the phenolic metabolism and antioxidant properties of yarrow (Achillea collina Becker ex Rchb.)[J]. Food Chemistry, 2009,114(1): 204-211.
[24] KIM H J, CHEN Feng, WANG Xi, et al. Effect of methyl jasmonate on phenolics, isothiocyanate, and metabolic enzymes in radish sprout (Raphanus sativus L.)[J]. Journal of Agricultural and Food Chemistry,2006, 54(19): 7263-7269.
[25] REYES L F, CISNEROS-ZEVALLOS L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (Solanum tuberosum L.)[J]. Journal of Agricultural and Food Chemistry, 2003, 51(18): 5296-5300.
[26] GUERRERO-BELTRAN C E, CALDERON-OLIVER M, PEDRAZACHAVERRI J, et al. Protective effect of sulforaphane against oxidative stress: recent advances[J]. Exper imental and Toxicologic Pathology,2012, 64(5): 503-508.
[27] BODNARYK R P. Effects of wounding on glucosinolates in the cotyledons of oilseed rape and mustard[J]. Phytochemistry, 1992,31(8): 2671-2677.
[28] JIA Chengguo, XU Chaojiong, WEI Jia, et al. Effect of modified atmosphere packaging on visual quality and glucosinolates of broccoli florets[J]. Food Chemistry, 2009, 114(1): 28-37.
[29] RASK L, ANDREASSON E, EKBOM B, et al. Myrosinase: gene family evolution and herbivore defense in Brassicaceae[J]. Plant Molecular Biology, 2000, 42(1): 93-113.
[30] CHAMPOLIVIER L, MERRIEN A. Effect s of water stress applied at different growth stages to Brassica napus L. var. oleifera on yield,yield components and seed quality[J]. European Journal of Agronomy,199 6, 5(3/4): 153-160.
[31] SCHONHOF I, KLARING H P, KRUMBEIN A, et al. Interaction between atmospheric CO2and glucosinolates in broccoli[J]. Journal of Chemical Ecology, 2007, 33(1): 105-114.
[32] YUAN Youxi, CHIU Liwei, LI Li. Transcriptional regulation of anthocyanin biosynthesis in red cabbage[J]. Planta, 2009, 230(6): 1141-1153.
[33] JAHANGIR M, ABDEL-FARID I B, KIM H K, et al. Healthy an d unhealthy plants: the effect of stress on the meta bolism of Brassicaceae[J]. Environmental and Experimental Botany, 2009,67(1): 23-33.
[34] 李小刚, 宋云鹏, 王静, 等. 外源蔗糖对NO3—胁迫下黄瓜幼苗生长及抗氧化酶活性的影响[J]. 山东农业科学, 2011(7): 30-34.
[35] 贾晓琳. 外源糖在心里美萝卜幼苗花青素代谢中的作用初探[D]. 新乡: 河南师范大学, 2013.
Effect of Exogenous Sucrose on Quality and Metabolic Enzyme Activities of Radish Sprouts
ZHAO Xiaoguo, ZHU Yi*, LUO Yunbo
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Radish (cv. Mantanghong) sprouts were adopted as the experimental material and sprayed with sucrose at different concentrations. The variations of physiological indexes (anthocyanin, chlorophyll, carotenoid, total phenolic,total glucosinolate, phenylalanine ammonia-lyase activity and peroxidase activity) of 3-, 5- and 7-day-old sprouts were investigated. Results showed that the contents of anthocyanin, chlorophyll, carotenoid, total phenolic and total glucosinolate were significantly (P < 0.05) increased by 0.4 and 0.6 g/100 mL sucrose treatment for 3-, 5- and 7-day-old sprouts, but not influenced (P > 0.05) by 0.2 g/100 mL sucrose. There was no difference between 0.4 and 0.6 g/100 mL sucrose treatment. Therefore, the nutritional value of radish sprouts could be increased by spraying 0.4 g/100 mL sucrose.
radish; sprouts; sucrose; quality; metabolic enzyme
TS255.1
A
1002-6630(2015)09-0007-05
10.7506/spkx1002-6630-201509002
2014-06-30
国家自然科学基金青年科学基金项目(31101263)
赵晓帼(1989—),女,硕士研究生,研究方向为食品科学。E-mail:zhaoxg_runner@163.com
*通信作者:朱毅(1973—),女,副教授,博士,研究方向为果蔬采后保鲜与生物活性物质功效。E-mail:zhuyi@cau.edu.cn
