响应面法优化假丝酵母Y6产γ-氨基丁酸发酵工艺
2015-12-13郑鸿雁赵炜彤昌妍希
郑鸿雁,赵炜彤,昌妍希
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.内蒙古医科大学药学院,内蒙古 呼和浩特 010100)
响应面法优化假丝酵母Y6产γ-氨基丁酸发酵工艺
郑鸿雁1,赵炜彤1,昌妍希2
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.内蒙古医科大学药学院,内蒙古 呼和浩特 010100)
从火龙果果实表面上筛选出一株发酵产γ-氨基丁酸(γ-aminobutyric acid,GABA)假丝酵母菌菌株Y6(Candida sp.)。用反相高效液相色谱测定发酵液中GABA含量。响应面试验确定其最适培养基成分为:蔗糖23 g/L、麸皮65 g/L、L-谷氨酸6 g/L、磷酸吡哆醛0.5 mmol/L。最适培养条件为初始 pH 4.5、培养温度28 ℃、转速200 r/min、培养时间3.5 d。结果表明:优化之后GABA的产量提高了72%。
γ-氨基丁酸;假丝酵母;响应面法;培养基成分
γ-氨基丁酸(γ-aminobutyric acid,GABA),又称氨酪酸,是一种非蛋白质组成的天然氨基酸,分布非常广泛[1],在动物[2]、植物和微生物中均有γ-氨基丁酸存在[3-6]。GABA是哺乳动物中枢神经系统一种主要的抑制性神经递质[7],具有许多重要的生理功能,如降血压[8]、安定神经[9]、增强记忆[10]、抗焦虑[11],尤其对更年期的失眠、压抑和自身失调疗效良好[12]。随着GABA的生理功能不断研究和阐明[13],已经发展成为一种新型的功能性因子[14],正逐渐应用于医药、食品及农业等行业中[15-17]。目前GABA主要通过微生物发酵方法进行生产[18],大肠杆菌是发现较早的具有谷氨酸脱羧酶活性的微生物,利用大肠杆菌发酵法制备的GABA一般用于化工生产,很少用于食品工业,因此制约了GABA的生产和开发[19]。本研究以筛选自火龙果果实表面的假丝酵母菌株Y6为研究对象,通过单因素试验和响应面法对其产GABA进行发酵工艺条件优化,提高GABA产量。用麸皮作为发酵培养基中的氮源,为规模化利用廉价农副产品生产保健品奠定了基础,对于GABA的发酵生产具有参考意义。总之,国内学者的研究工作主要集中在筛选高产GABA的菌株上,但是其规模化生产的成本太高,因此降低γ-氨基丁酸的发酵培养成本是限制我国生产γ-氨基丁酸的瓶颈问题,突破该瓶颈势在必行。
1 材料与方法
1.1 菌株、培养基与试剂
假丝酵母(Candida sp.)Y6:分离自火龙果果实表面,购于长春市欧亚超市。菌种经生工生物工程(上海)股份有限公司分子生物学鉴定。
基础发酵培养基:葡萄糖30 g、麸皮40 g、L-谷氨酸5 g、磷酸吡哆醛0.12 g、K2HPO41 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、FeSO4·7H2O 0.01 g,蒸馏水1 000 mL。
γ-氨基丁酸标准品 上海楷洋生物技术有限公司。
1.2 仪器与设备
Z-36HK高速低温冷冻离心机 德国Hermle公司;DL-CJ-2N超级洁净工作台、空气浴振荡箱 北京东联哈尔仪器制造有限公司;Shimadzu LC-20A高效液相色谱仪(SPD-20A紫外检测器,LC-20AT泵,CTO-10AS VP柱温箱,LC-solution工作站) 日本岛津公司。
1.3 方法
1.3.1 菌株Y6发酵基础培养条件
按2%的接种量接种在装有100 mL无菌发酵培养基(初始pH 6.0)的250 mL三角瓶中,26 ℃、200 r/min条件下恒温旋转培养2.0 d。
1.3.2 GABA含量的测定
用邻苯二甲醛(o-phthaldialdehyde,OPA)柱前衍生紫外检测反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法测定发酵液中GABA含量。液相色谱条件:色谱柱:Venusil-AA氨基酸分析专用柱(5 μm)。流动相:流动相A为25 mmol/L的乙酸钠,用4%的乙酸调pH值至5.9;流动相B为纯乙腈。流速为1 mL/min,梯度洗脱程序如表1所示,柱温40 ℃,进样量20 μL,检测波长:332 nm。取发酵液5 000 r/min离心15 min取上清液,稀释到一定浓度。发酵液20 μL于样品瓶中,加入OPA衍生液100 μL,涡旋振荡5 s,静置2 min后,过0.45 μm滤膜,取20 μL进样。定量采用GABA标准曲线,取0.01、0.02、0.04、0.06、0.08、0.10 mg/mL GABA标准溶液分别邻苯二甲醛衍生后进行液相色谱测定。以色谱图中峰面积为纵坐标,以待测样品质量浓度(mg/mL)为横坐标绘制标准曲线,回归方程为y=8.9×107x+1 155.9(R2=0.999 8)。采用RP-HPLC检测GABA所得的峰面积,根据标准曲线换算成GABA产量。
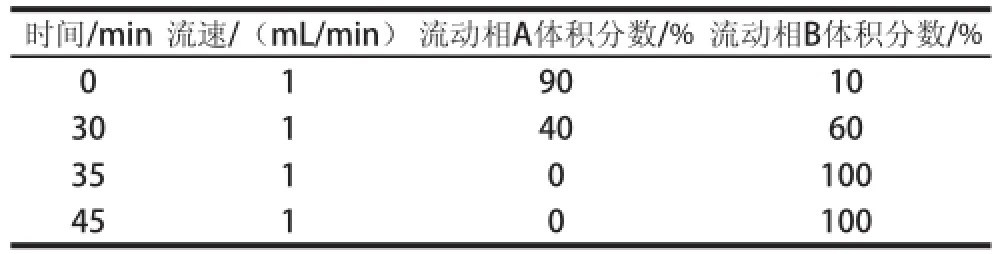
表1 梯度洗脱程序表Table 1 Gradient elution program
1.3.3 发酵培养基优化
1.3.3.1 单因素试验
选择不同碳源、碳源质量浓度、麸皮添加量、L-谷氨酸和磷酸吡哆醛作为影响假丝酵母Y6产GABA发酵培养基的主要因素。不同碳源种类有葡萄糖、麦芽糖、蔗糖、果糖(30 g/L),选取最适碳源进行发酵试验。各因素的水平梯度设置分别为最适碳源质量浓度15、20、25、30、35 g/L,麸皮添加量40、50、65、70、80 g/L,L-谷氨酸3、4、5、6、7、8、9 g/L,磷酸吡哆醛0.3、0.4、0.5、0.6、0.7 mmol/L。
1.3.3.2 响应面法优化培养基
根据单因素试验结果,选取蔗糖质量浓度、麸皮添加量、L-谷氨酸添加量、磷酸吡哆醛添加量4 个因素为自变量,单因素试验得出的各最佳条件为中心点,以GABA为响应值,进行响应面试验设计,确定发酵培养基最优培养基组分含量。每个试验重复3 次,取其平均值。
1.3.4 发酵条件优化
1.3.4.1 单因素试验
选择初始pH值、培养温度、摇床转速、培养时间作为影响假丝酵母Y6产GABA发酵条件的主要因素,通过单因素试验结果选取响应面试验的因素和水平。各因素的水平梯度设置分别为时间2.0、2.5、3.0、3.5、4.0、4.5、5.0 d,温度22、24、26、28、30、32、34 ℃,初始pH 4.0、4.5、5.0、5.5、6.0,摇床转速120、140、160、180、200、220 r/min。
1.3.4.2 响应面法优化培养条件
根据单因素试验结果,选取初始pH值、培养温度、摇床转速、培养时间4 个因素为自变量,单因素试验得出的各最佳条件为中心点,以GABA为响应值,进行响应面试验设计,确定最优发酵条件。每个试验重复3 次,取其平均值。
1.3.5 模型验证
通过响应面法优化假丝酵母菌Y6产GABA发酵条件进行发酵试验,比较模型预测值和试验值,验证模型的有效性。
1.4 数据分析
采用Design Expert 7.0软件设计四因素三水平响应面分析试验,试验结果采用Design Expert 7.0软件进行数据处理和分析,确定最佳试验条件。
2 结果与分析
2.1 发酵培养基的确定
2.1.1 培养基单因素试验结果

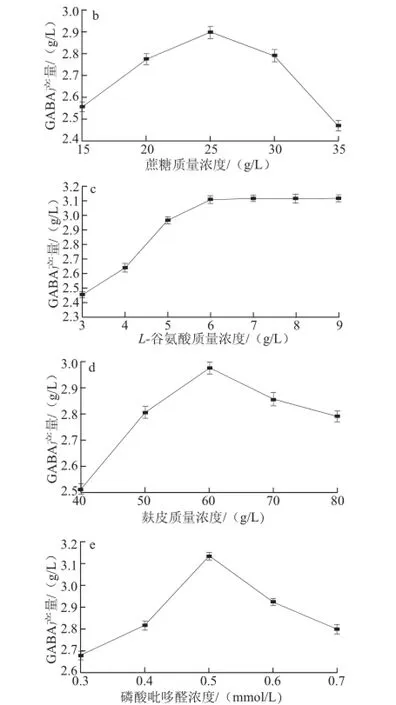
图1 培养基对GABA产量的影响Fig.1 Effect of medium components on GABA production
由图1a可知,不同的碳源种类对GABA产量有差异,以蔗糖作为发酵培养基碳源时,GABA产量明显高于其他碳源,所以把蔗糖选作最适碳源。在确定碳源种类的基础上,进一步确定蔗糖质量浓度大小,由图1b可知,随着蔗糖质量浓度的增大,GABA产量增加,当蔗糖质量浓度为25 g/L时,GABA产量达到最大。但随着蔗糖质量浓度继续增大,GABA产量降低,分析原因有可能是碳源质量浓度过大,会使菌体大量繁殖,影响GABA的积累。L-谷氨酸脱羧后生成GABA,可作为其前体物,由图1c可知,随着L-谷氨酸的增加,GABA产量迅速增大,当L-谷氨酸质量浓度为6 g/L时,GABA产量达到3.100 g/L,但继续增加L-谷氨酸,GABA产量没有明显增大,可能是因为L-谷氨酸转化率已经达到最大。麸皮是廉价农副产品,把它作为培养基的氮源,可以降低成产成本,增大麸皮的利用价值,由图1d可知,随着麸皮添加量的增大,GABA产量增加,麸皮添加量在60 g/L时,GABA产量最高,在麸皮超过60 g/L时,GABA产量略有降低,磷酸吡哆醛是谷氨酸脱羧酶的辅酶,在发酵培养基加入它有促进谷氨酸脱羧酶的作用,由图1e可知,磷酸吡哆醛的最佳浓度为0.5 mmol/L。
2.1.2 培养基响应面优化

表2 发酵培养基响应面试验设计及结果Table 2 Response surface central composite design and experimental results for the optimization of medium components

表3 发酵培养基回归模型方差分析Table 3 Analysis of variance of regression model for medium components
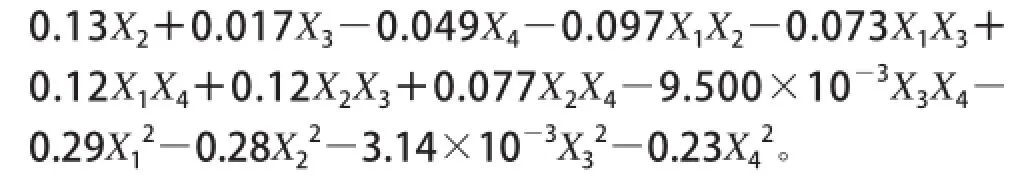
由方差分析得出P值,模型极显著,模型的失拟项不显著,回归决定系数R2=0.950 4,修正决定系数= 0.900 7,说明方程拟合性较好,可以应用于对培养基优化的分析预测。根据结果进行分析:一次项X1、X4显著,X2极显著,二次项极显著,交叉项X1X2显著,X1X4、X2X3极显著。由表3可知,影响GABA产量的因素大小排序依次是麸皮质量浓度、蔗糖质量浓度、磷酸吡哆醛浓度、L-谷氨酸质量浓度。

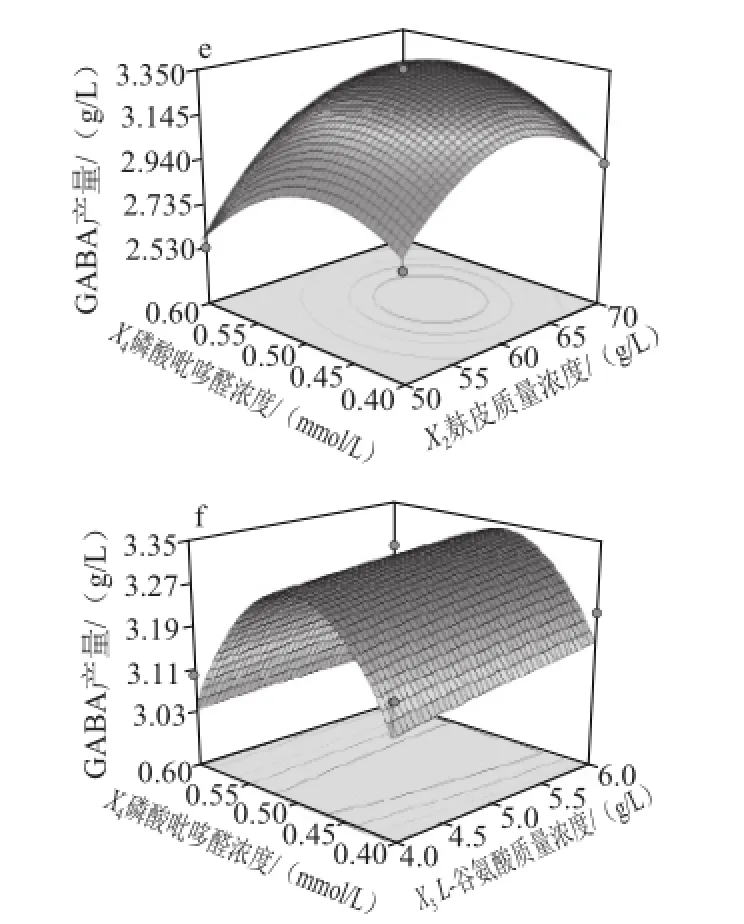
图2 培养基交互因素响应面图及等高线图Fig.2 Response surface and contour plots showing the effects of medium components on GABA production
发酵培养基交互因素响应面立体分析见图2。数据分析表明回归模型存在最大值,发酵培养基最优配方为:蔗糖23 g/L、麸皮65 g/L、L-谷氨酸6 g/L、磷酸吡哆醛0.5 mmol/L,此条件下理论预测最大值为3.453 g/L。验证实验此条件下GABA产量为3.450 g/L,基本与预测值一致,证明了模型的可靠性。
2.2 发酵培养最适条件的确定
2.2.1 发酵条件单因素试验结果
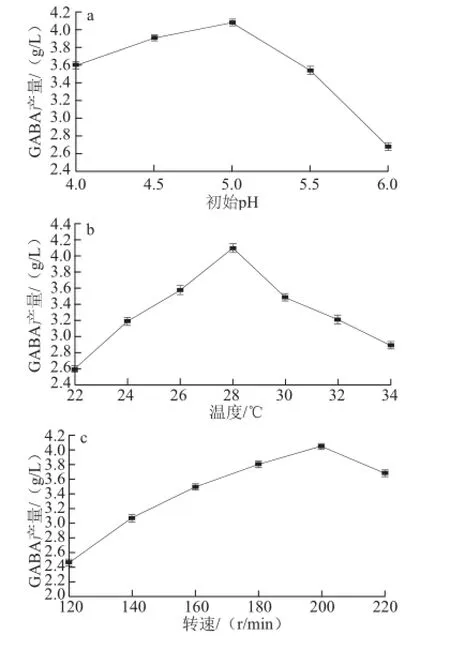

图3 发酵培养条件对GABA产量的影响Fig.3 Effect of fermentation conditions on GABA production
由图3a可知,发酵培养基初始pH值在4.0~5.0的范围内,GABA产量在增大,当pH值大于5.0时,GABA产量明显下降,表明培养假丝酵母Y6的最适pH值在5.0附近。由图3b可知,温度为28 ℃,GABA产量最高,低于或高于28 ℃,都不利于菌株产GABA,说明28 ℃左右是假丝酵母Y6产GABA较为适宜的温度。由图3c可知,摇床转速从120 r/min增加到200 r/min的过程中,GABA产量不断增大,在转速高达220 r/min时,GABA产量略有降低。由图3d可知,在发酵时间为2.0 d时,GABA产量为2.500 g/L,随着发酵时间的延长,GABA产量逐渐增加。发酵时间在3.5 d时达最高,为4.100 g/L。但多于3.5 d时,GABA产量略有减少,选择3.5 d为发酵培养时间。
2.2.2 发酵条件响应面优化

表4 发酵条件响应面试验设计及结果Table 4 Response surface central composite design and experimental results for the optimization of fermentation conditions
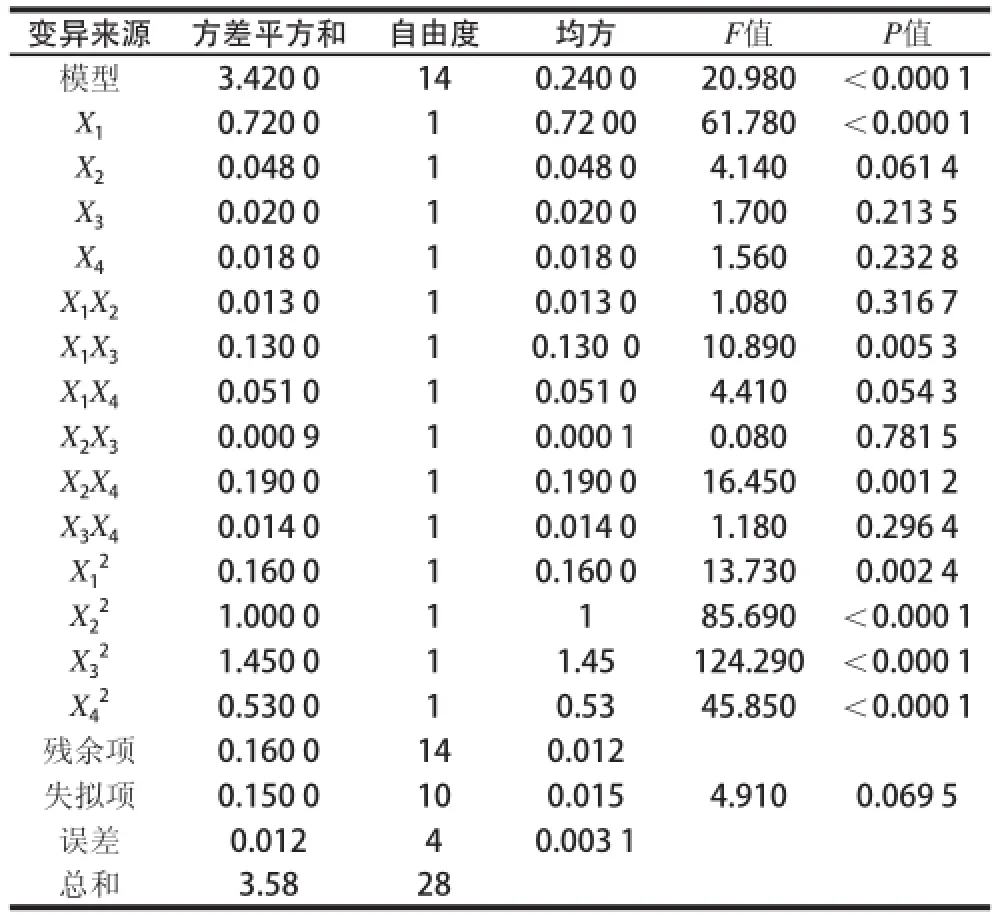
表5 发酵条件回归模型方差分析Table 5 Analysis of variance of regression model for fermentation conditions
试验方案及试验结果见表4,回归分析见表5。根据试验结果,利用响应面分析软件对数据进行分析,以GABA产量为响应值,得到回归方程表达为:
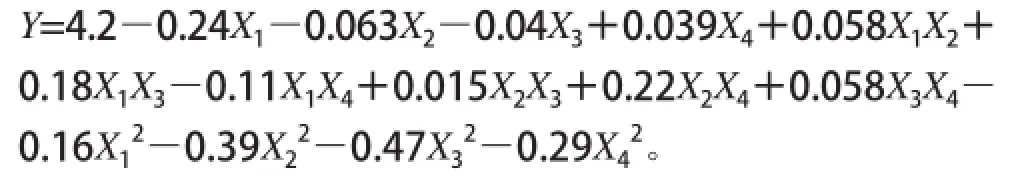
由方差分析得出P值,模型极显著,模型的失拟性不显著,回归决定系数R2=0.955 9,修正决定系数说明方程拟合性较好,可以应用于对发酵条件优化的分析预测。根据结果进行分析:一次项X1极显著,二次项极显著,交叉项极显著。由表5可知,影响GABA产量的因素由大到小排序依次是初始pH值、培养温度、摇床转速、培养时间。
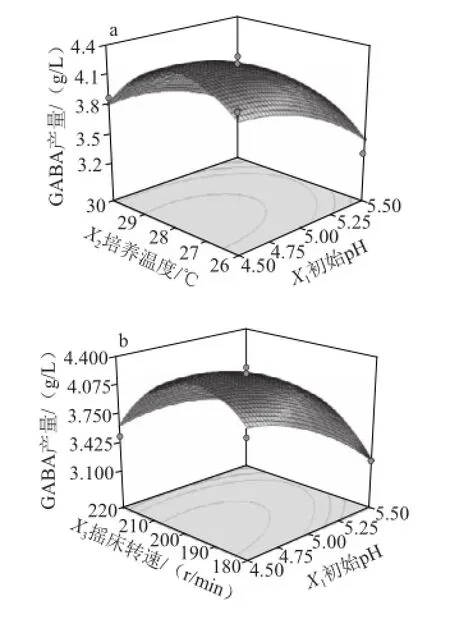
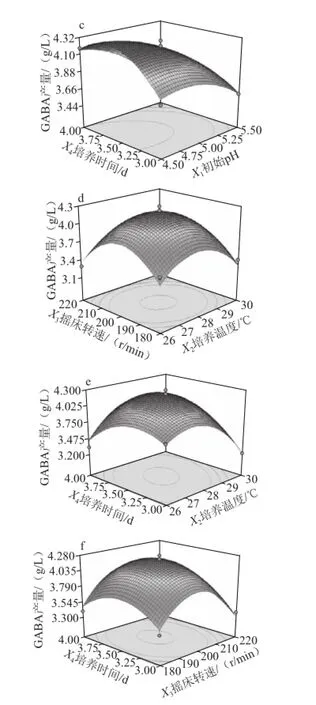
图4 发酵条件交互因素响应面图Fig.4 Response surface and contour plots showing the effects of fermentation conditions on GABA production
发酵条件交互因素响应面立体分析见图4。数据分析表明回归模型存在最大值,发酵最优条件为:初始pH 4.5、培养温度28 ℃、转速200 r/min、培养时间3.5 d,此条件下理论预测最大值为4.333 g/L。进行验证实验,此条件下GABA产量为4.300 g/L,基本与预测值一致。
与采用其他氮源发酵生产GABA相比,利用麸皮作为氮源突破发酵成本高的缺陷,降低其生产成本,增加麸皮及农副产品的附加值,实现农副产品环境友好的高附加值转化,在实际应用中具有更加广阔的发展空间。除酵母菌外,含有谷氨酸脱羧酶的大肠杆菌、霉菌、乳酸菌等也可用于GABA的生产[20]。罗少华等[21]以明胶为载体,戊二醛为交联剂,采用包埋-交联复合固载法固定大肠杆菌细胞用于制备γ-氨基丁酸,虽然具有较高的转化率,但安全性较差。边鑫等[22]利用突变株米曲霉3.800接入大豆-水的培养基中发酵产GABA为0.874 g/L。江南大学黄桂东等[23]从黄酒发酵过程中分离得到的一株具有产GABA能力的植物乳杆菌MJ0301进行了发酵培养基的优化,产量为1.590 g/L。本实验在发酵培养基中添加了辅酶磷酸吡哆醛,并且通过响应面优化了发酵培养基组分及发酵条件,有效地提高了发酵GABA的产量,最终GABA产量高达4.300 g/L。
3 结 论
本研究通过单因素试验和响应面试验方法,以GABA产量为指标,采用反相高效液相色谱邻苯二甲醛柱前衍生法对发酵液中GABA含量进行测定,优化了假丝酵母菌Y6产GABA发酵培养基及其发酵条件。确定了假丝酵母Y6发酵产GABA的最优培养基配方:蔗糖23 g/L、麸皮65 g/L、L-谷氨酸6 g/L、磷酸吡哆醛0.5 mmol/L,最适发酵条件:初始 pH 4.5、培养温度28 ℃、转速200 r/min、培养时间3.5 d。在此条件下,GABA产量达4.300 g/L,较优化之前的2.500 g/L提高了72%。用响应面法优化假丝酵母Y6产GABA的发酵工艺条件是有效可行的。然而产量提高与多种因素有关,除了对菌种发酵条件的优化以外,利用现代分子生物技术改变GAD的酶活性来提高产γ-氨基丁酸的产量有待进一步研究。
[1] 白松, 林向阳, 阮榕生. γ-氨基丁酸的分布和制备[J]. 现代食品科技,2008, 21(2): 202-205.
[2] 郭晓娜, 朱永义, 朱科学. 生物体内γ-氨基丁酸的研究[J]. 氨基酸和生物资源, 2003, 25(2): 70-72.
[3] FOUGERE F, RULIER D, STREETER J G. Effects of salt stress on aminoacid, organic acid, and carbohydrate composition of roots, bacteroids,and cytosol of alfalfa[J]. Plant Physiology, 1991, 96: 1228-1236.
[4] KATHIRESAN A, MIRANDA J, CHINNAPPA C C, et al. γ-Aminobutyric acid promotes stem elongation in Stellaria longipes: the role of ethylene[J]. Plant Growth Regulation, 1998, 26(2): 131-137.
[5] SERRAJ R, SHELP B J, SINCLAIR T R. Accumulation of γ-aminobutyric acid in nodulated soybean in response to drought stress[J]. Physiologia Plantarum, 1998, 102(1): 79-86.
[6] 蒋振晖, 顾振新. 高等植物体内γ-氨基丁酸合成、代谢及其生理作用[J]. 植物生理学通讯, 2003, 39(3): 249-254.
[7] 李小茜, 何建成. γ-氨基丁酸与帕金森病、左旋多巴诱发异动症的研究进展[J]. 医学研究杂志, 2013, 42(3): 6-8.
[8] 赵长琦, 李广民, 王军. 中药红芪中降压有效成分γ-氨基丁酸的薄层扫描测定[J]. 西北大学学报: 自然科学版, 1995, 25(3): 277-278.
[9] 朱晓立, 裘晖. γ-氨基丁酸的生物学功能及其在食品上的应用[J]. 食品工程, 2008(2): 34-37.
[10] 孙兵, 郝洪谦, 郑开俊. γ-氨基丁酸对猫睡眠时相的影响[J]. 天津医科大学学报, 1996, 2(4): 34-35; 38.
[11] 李瑞芝, 郭建友, 李昌煜, 等. 焦虑症γ-氨基丁酸受体机制与药物干预研究进展[J]. 中国药理学通报, 2010, 26(9): 1135-1138.
[12] 方廉, 罗荣生. GABA对离体卵巢颗粒细胞孕酮的影响[J]. 细胞生物学杂志, 1994, 16(3): 137-139.
[13] 杨胜远, 陆兆新, 吕风霞, 等. γ-氨基丁酸的生理功能和研究开发进展[J]. 食品科学, 2005, 26(9): 541-546.
[14] 许建军, 江波, 许时婴. γ-氨基丁酸: 一种新型的功能食品因子[J]. 食品工业科技, 2003, 24(l): 109-111.
[15] BOWN A W, SHELP B J. The metabolism and function of γ-aminobutyric acid[J]. Plant Physiology, 1997, 115: 1-5.
[16] 唐传核. 富含γ-氨基丁酸(GABA)大米胚芽及其在食品中应用[J]. 粮食与油脂, 1999, 12(4): 31-32.
[17] 马倩, 夏桂枝, 任榕娜, 等. γ-氨基丁酸在小儿难治性癫痫患者脑组织中的表达及临床意义[J]. 中国医学创新, 2013, 15(10): 1-4.
[18] 杨晶晶, 曲媛, 崔秀明. γ-氨基丁酸的制备方法与含量测定研究进展[J].食品工业科技, 2014, 35(3): 351-356.
[19] 沈俞, 刘均忠, 刘茜, 等. 复合载体固定化大肠杆菌制备γ-氨基丁酸[J].精细化工, 2008, 25(5): 459-462.
[20] 金红星, 田楠, 成文玉, 等. 微生物发酵合成γ-氨基丁酸的研究进展[J].安徽农业科学, 2012, 40(11): 6385-6386; 6470.
[21] 罗少华, 邵伟, 仇敏. 包埋-交联法固定大肠杆菌细胞制备γ-氨基丁酸的研究[J]. 中国酿造, 2011, 30(11): 142-145.
[22] 边鑫, 吴非. 高产γ-氨基丁酸霉菌菌株的筛选及诱变育种[J]. 食品科学, 2012, 33(21): 213-216.
[23] 黄桂东, 毛健, 姬中伟, 等. 一株产γ-氨基丁酸植物乳杆菌MJ0301培养基的优化[J]. 食品科学, 2013, 34(17): 165-170. doi: 10.7506/ spkx1002-6630-201317036.
Optimization of Medium Components and Culture Conditions for Enhanced Yield of γ-Aminobutyric Acid by Candida sp. Y6 by Response Surface Methodology
ZHENG Hongyan1, ZHAO Weitong1, CHANG Yanxi2
(1. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China; 2. Pharmacy College, Inner Mongolia Medical University, Hohhot 010100, China)
In this study, we optimized medium components and culture conditions of Candida sp. Y6, a γ-aminobutyric acid (GABA)-producing strain isolated from the surface of pitaya, using response surface methodology (RSM). The content of GABA in fermentation broth was analyzed by reversed phase high performance chromatography (RP-HPLC). The optimal fermentation medium was found to consist of 23 g/L sucrose, 65 g/L wheat bran, 6 g/L L-glutamate, and 0.5 mmol/L pyridoxal phosphate, and the optimal culture conditions were initial medium pH 4.5 and 28 ℃ for 3.5 d with a shaking speed of 200 r/min. Under the optimal conditions, the yield of GABA was increased 72% when compared with that before optimization.
γ-aminobutyric acid; Candida sp.; response surface methodology; medium components
TS201.3
A
1002-6630(2015)09-0130-06
10.7506/spkx1002-6630-201509024
2014-07-29
郑鸿雁(1968—),女,副教授,硕士,研究方向为功能食品、微生物菌种筛选及发酵工艺。E-mail:zhenghongyan6811@163.com
