银杏叶提取物对脊髓损伤后大鼠肠道功能的影响①
2015-12-13李欣芮罗兰杨拯王强宋强陈勇黄倩聂欢陈建敏
李欣芮,罗兰,杨拯,王强,宋强,陈勇,黄倩,聂欢,陈建敏
银杏叶提取物对脊髓损伤后大鼠肠道功能的影响①
李欣芮,罗兰,杨拯,王强,宋强,陈勇,黄倩,聂欢,陈建敏
目的观察银杏叶提取物舒血宁对脊髓损伤后大鼠肠道功能变化的影响。方法36只Sprague-Dawley大鼠,运用随机数字表法随机分为A组、B组和C组,每组12只。采取Allen法(10 g×25 mm)损伤大鼠T10脊髓节段。造模成功30 min后,A组腹腔注射甲基强的松龙30 mg/kg,此后每天1次;B组腹腔注射舒血宁1.75 mg/kg,此后每天1次;C组腹腔注射等体积生理盐水。术后1 d、3 d、7 d随机抽取各组动物4只,进行大鼠肠肌电慢波活动测试,测定血清中超氧化物歧化酶(SOD)和丙二醛(MDA)的含量,HE染色观察肠组织形态。结果术后3 d、7 d,A、B组肌电慢波振幅和频率值均高于C组(P<0.05),血清内SOD活性均高于C组(P<0.05),MDA含量均明显低于C组(P<0.01)。A、B组回肠绒毛损伤较C组轻(P<0.05),炎症渗出不显著,出血点少且出血面积局限,C组绒毛变钝或有裂隙,伴有大量炎性细胞浸润,黏膜表面大量炎性渗出物。结论舒血宁通过其抗氧化功能,促进损伤脊髓后的肠道功能障碍恢复。
银杏叶提取物;脊髓损伤;丙二醛;超氧化物歧化酶;肠道功能障碍
[本文著录格式]李欣芮,罗兰,杨拯,等.银杏叶提取物对脊髓损伤后大鼠肠道功能的影响[J].中国康复理论与实践,2015, 21(4):397-401.
CITEDAS:Li XR,Luo L,Yang Z,et al.Effect of ginkgo biloba extract on intestinal function after spinal cord injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(4):397-401.
脊髓损伤(spinal cord injury,SCI)是一种中枢神经系统的严重损伤,患者会出现脊髓损伤部位以下的躯体运动、感觉和自主神经等功能障碍[1]。肠道功能障碍属于脊髓损伤后继发的自主神经功能障碍,现已成
为脊髓损伤患者治疗过程中面临的主要问题之一[2-3],主要表现为便秘、屏障功能减弱或者丧失、大便失禁、自主反射失调等[4]。同时,肠道是人体内最大的内毒素储存库。脊髓损伤后肠道功能障碍,大量内容物在肠道潴留,造成肠道内毒素移位和内毒素血症,进而引起全身炎症反应综合征以及多器官功能障碍甚至衰竭[5]。脊髓损伤改善恢复肠道功能非常重要[6]。
银杏叶提取物(Ginkgo biloba extract,EGb)作为传统中药,其中有黄酮甙类、银杏内酯、白果内酯等有效成分,现已证明有清除自由基、抗血小板活化、抗氧化应激和抗炎等重要作用[7],近年来已用于治疗中枢神经系统疾病[8]。
本实验通过测定大鼠血清中超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量,研究EGb的抗氧化作用对脊髓损伤后大鼠肠黏膜的保护作用;通过测定脊髓损伤后大鼠小肠平滑肌慢波电活动以及常规小肠组织HE染色评分,观察EGb对脊髓损伤后大鼠肠道功能障碍的疗效。
1 材料与方法
1.1 材料
舒血宁注射液(EGb):石药银湖制药有限公司,批号:1041206081。注射用甲泼尼龙琥珀酸钠、戊巴比妥钠:上海国药集团化学试剂有限公司。葡萄糖注射液:安徽双鹤药业有限责任公司,批号:100829 6K。氯化钠注射液:贵州科伦药业有限公司,批号:B 121003 U。注射用青霉素钠:石药集团中诺药业有限公司,批号:016130114。SOD试剂盒:南京建成生物工程研究所,批号:20130106。MDA试剂盒:南京建成生物工程研究所,批号:20130108。Eclipse E200光学显微镜:尼康仪器有限公司。KD-BM生物组织包埋机:浙江省金华市科迪仪器设备有限公司。LEICA RM2016切片机:LEICA公司。TC-120系列智能程控生物组织自动脱水机:湖北孝感市泰维电子设备有限公司。
1.2 实验动物
健康成年Sprague-Dawley大鼠36只,雌雄各半,体重180~220 g,由四川省医学科学院四川省人民医院实验动物研究所提供,许可证号:SCXK(川) 2013-15。采用随机数表法随机将大鼠分为A组、B组和对照组C组,每组12只。
1.3 实验方法
1.3.1 模型建立
术前对大鼠进行常规行为学测试,确认其运动功能正常后,1.5%戊巴比妥钠30 mg/kg腹腔注射麻醉。密切观察大鼠麻醉后呼吸频率、趾蹼反射、睫毛反射和肌肉放松程度。
待大鼠完全麻醉后,俯卧位固定,背部去毛,常规消毒铺巾。以T10棘突为中心在大鼠背部正中做一长约2 cm的切口,显露椎板和棘突。确定T10位置,用手术刀紧靠棘突两边切开背部肌肉,小心去除T10椎骨上的肌肉,注意保护旁边血管。用有齿镊剥离T10棘突和椎间软组织,无齿镊剥开锥板,暴露脊髓。
用自制数字式脊髓损伤动物模型制备仪打击大鼠脊髓T10节段,打击强度为10 g×25 mm。打击后即见大鼠双后肢和躯体发生不同程度抽搐,鼠尾痉挛性摆动,随后完全松弛,脊髓部位血管明显充血。模型制备成功。
打击完毕后逐层缝合切口,立即腹腔注射葡氯钠2 ml(1∶1)补液,和青霉素纳1 ml(8×104U)预防感染。动物清醒后放回饲养笼中单笼饲养。
术后3 d内,每天早上腹腔注射葡氯钠与青霉素钠。术后大鼠可自由饮水、进食、笼内走动;饲养环境保持适宜的温度和湿度,周围噪声控制在一定水平;定时清洁笼具,并保持大鼠身体干燥;每天挤压膀胱排尿3次,至大鼠恢复自主排尿。
1.3.2 治疗方法
造模成功30 min后,A组腹腔注射甲基强的松龙30 mg/kg,B组腹腔注射舒血宁1.75 mg/kg,C组注射等量生理盐水,此后每天1次。
1.4 评定方法
于造模术后1 d、3 d、7 d,随机取各组动物4只进行以下测试。
1.4.1 肠平滑肌肌电慢波活动
大鼠1.5%戊巴比妥钠30 mg/kg腹腔注射麻醉后开腹,在距回盲瓣2 cm回肠处平行安置一对银丝电极,两电极相距约0.5 cm,一端固定于肠壁浆肌层,参考电极夹于皮下,石蜡绝缘纱布覆盖腹腔;另一端经导线引出,生物电放大器引入到BL-420F生物机能实验系统。10 min后开始记录。扫描速度1.00 s/div,电增益500 mV,时间常数3 s,高频滤波20 Hz。连续记录30 min。
对每只大鼠慢波数据样本剪接基线平稳的波形,
随机截取6个时间段,对所比较分析的波形取相同的下限,分别计算每只大鼠慢波的频率和振幅的均值。
1.4.2 血清SOD和MDA测定
测完慢波后,暴露腹主动脉,取血3 ml,静置30 min后,3000 r/min离心15 min,取上清液,-20℃保存备用。分别采用黄嘌呤氧化法和硫代巴比妥酸法测定大鼠血清中SOD的活性和MDA的含量。具体操作方法按试剂盒说明进行。
1.4.3 肠组织HE染色
处死大鼠,迅速取回盲瓣上2 cm处小肠组织2 cm,生理盐水轻柔冲洗肠内容物,无菌滤纸吸干。置0.4%多聚甲醛固定24 h,石蜡包埋,切片,常规HE染色,光镜下观察组织形态学改变,并根据Chiu肠黏膜损伤评分标准进行评定。
1.5 统计学分析
2 结果
2.1 一般情况
术后1 d,大鼠静卧少动,无明显进食和饮水活动;双后肢无力,肌张力下降为零,不能进行负重;不能进行自主排尿,需经人工按摩膀胱辅助排尿。
术后3 d,大鼠少量进食和饮水,双后肢的运动功能较开始有所恢复,肌张力缓慢上升;部分大鼠出现腹部膨隆,疑为尿潴留或腹腔积水,绝大多数大鼠能进行自主排尿;除极个别大鼠出现血尿外,其余大鼠尿液均正常。
术后7 d,大鼠伤口痊愈,未见感染、化脓;双后肢运动有力;所有大鼠均可进行自主排尿。
试验期间,B组死亡1只,C组死亡2只,死亡原因不详,疑为膀胱破裂、多器官衰竭和腹腔积水。及时补充同批次大鼠,使每组大鼠样本量不变。
2.2 肠平滑肌肌电慢波活动
术后1 d,各组大鼠小肠平滑肌肌电慢波频率和振幅无显著性差异(P>0.05),表现为波形整体较低矮,且多不稳定。术后3 d,A组、B组小肠平滑肌振幅和频率较C组增强(P<0.05)。术后7 d,A组振幅较C组提高(P<0.05),B组频率较C组提高(P<0.05)。见表1、表2。
2.3 血清SOD活性
术后1 d,各组的SOD活性无显著性差异(P> 0.05);术后3 d、7 d,A、B两组的SOD活性均高于C组(P<0.05)。见表3。
2.4 血清MDA含量
术后1 d,各组MDA含量无显著性差异(P>0.05);术后3 d、7 d,A、B两组的MDA含量均高于C组(P<0.05)。见表4。
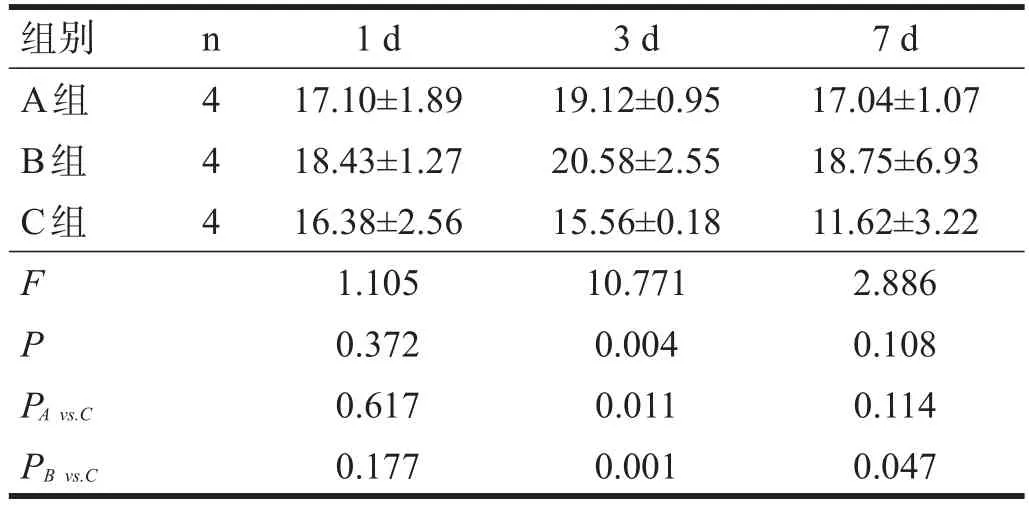
表1 各组大鼠小肠平滑肌慢波频率比较(Hz)
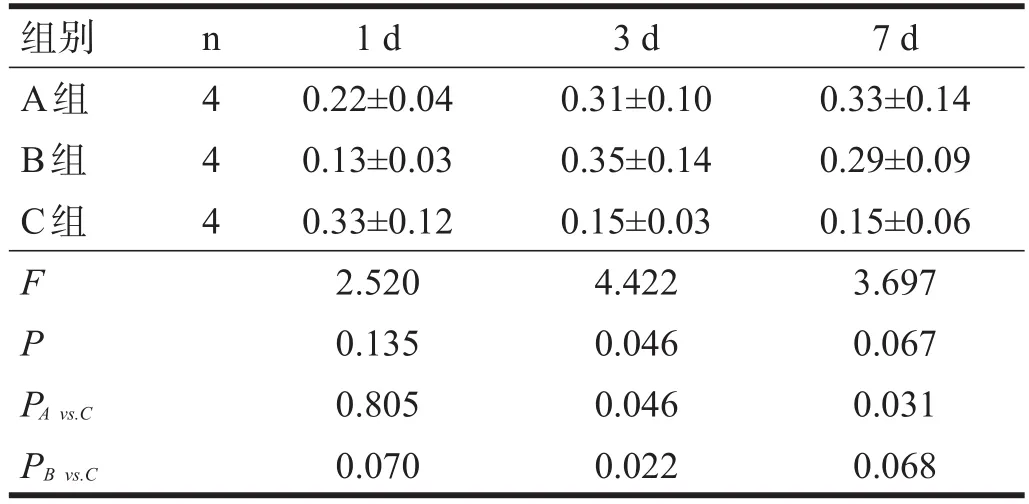
表2 各组大鼠小肠平滑肌慢波振幅比较(mV)
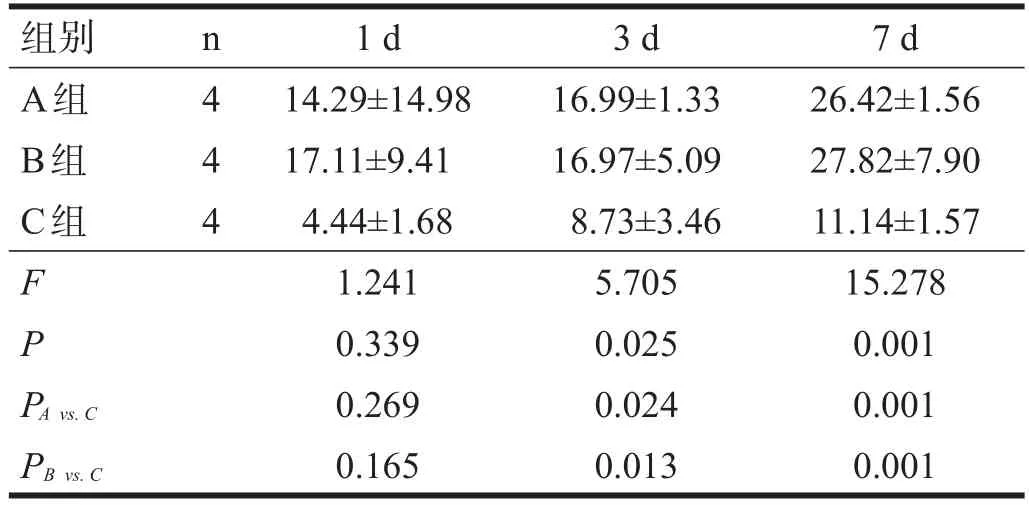
表3 各组大鼠血清中SOD活性比较(U/ml)
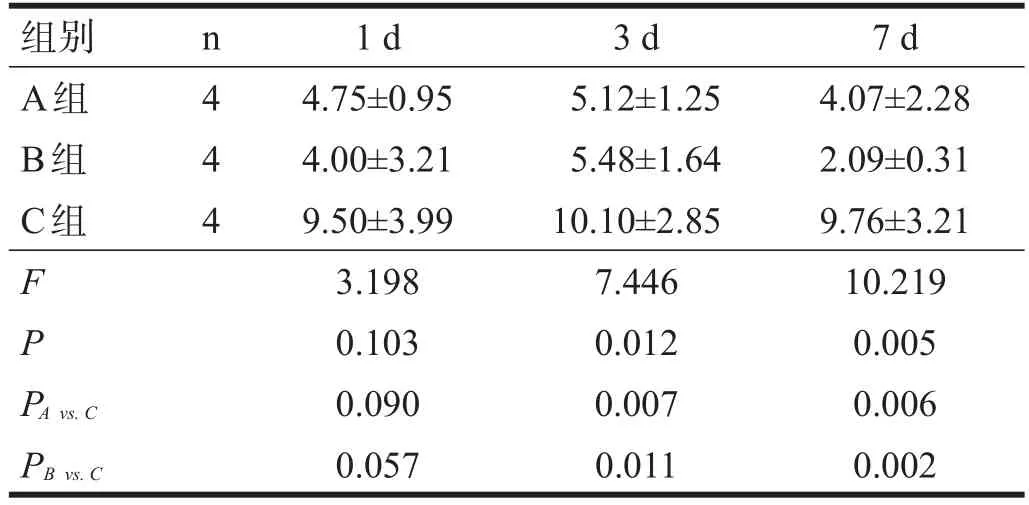
表4 各组大鼠血清中MDA含量比较(nmol/ml)
2.5 肠组织HE染色
术后1 d,各组大鼠肠绒毛均变钝、变短,局部
黏膜下层偶有血管暴露,部分肠管可见炎性细胞浸润,少见固有层消化崩解,出血或形成溃疡。除B组肠组织损伤较C组轻外(P<0.05),各组大鼠肠组织损伤程度无显著性差异(P>0.05)。
术后3 d,A、B组肠黏膜损伤均明显较C组轻(P<0.01)。A、B组黏膜整体较好,表面渗出物少,炎细胞浸润不明显;而C组固有层多出现空洞,黏膜与黏膜下层多见分离,黏膜表面有大量渗出物,高倍镜下可见中性粒细胞等炎细胞浸润。
术后7 d,A、B组肠黏膜损伤均较C组轻(P< 0.05)。A、B组仅部分肠组织有少量出血点,炎细胞浸润不明显。见表5、图1。
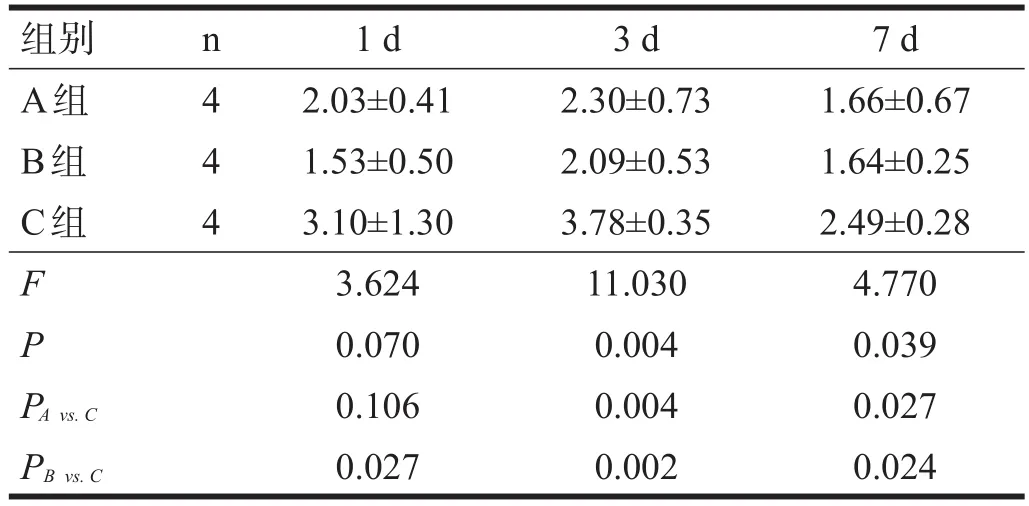
表5 各组大鼠肠组织HE染色评分比较
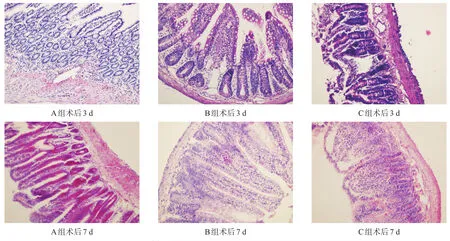
图1 各组大鼠术后肠组织(HE染色,200×)
3 讨论
脊髓损伤包括原发性和继发性。原发性脊髓损伤一般是指伤后4 h内脊髓受到的直接、机械性压迫以及局部出血、电解质从受损的神经元内溢出,神经元发生变性、坏死[9-10]。继发性脊髓损伤是指在原发性脊髓损伤的基础上发生的二次损伤,其特点为多因素参与、损伤严重、涉及面积广泛、属于序列性组织自毁性破坏,往往呈现综合性,相互关联、相互促进,如血管因素导致损伤区的缺血、脂质过氧化产生大量自由基损坏细胞膜的生理特性、兴奋性氨基酸的毒性作用、钙超载、炎症反应以及细胞凋亡等[11-12]。
脊髓损伤会给患者造成很大的心理负担和身体疼痛,行走能力、大便控制、小便控制、性功能障碍等困难[13]。肠道功能障碍是脊髓损伤的重要并发症。肠道功能紊乱可导致患者出现很多问题:独立排便障碍、便秘、腹胀、大便失禁、排便耗时明显延长、饮食受限、户外活动受限、精神压力增大乃至寿命缩短等[14-15]。
银杏又称白果,应用历史悠久。在中国主要用于治疗肺虚咳喘和心脏疾患,其他国家广泛应用于心血管系统疾病[16]。SOD能清除氧自由基,减少自由基对细胞的毒副作用。MDA为脂质过氧化产物,其含量降低意味着细胞抗氧化能力升高。
EGb能有效提高大鼠血清中SOD活性和降低MDA含量。肠管内有丰富的血液供应,氧化应激发生时产生的大量自由基通过血流到达肠壁内,尤其是
小肠黏膜,严重破坏正常小肠黏膜上皮细胞,使其发生变性、坏死。HE切片染色表现出黏膜上皮脱落,绒毛变短,黏膜下和固有层炎细胞浸润,或有空洞形成等。
Kobuchi等用小鼠巨噬细胞线RAW264.7证明,EGb可以直接清除脂多糖(LPS)加干扰素γ诱发的NO产生,同时抑制诱导性一氧化氮合成酶(iNOS)的活性及其mRNA表达。由于在肠道功能障碍中,NO可能损伤平滑肌细胞蛋白质、核酸、脂质膜,通过氧化作用损伤细胞膜,还可使胃肠平滑肌细胞产生抑制性接点电位(IJ-P),从而抑制肠道平滑肌收缩,肠平滑肌电活动测试表现为波形振幅减低,频率减慢,波形不规则等[17-18]。EGb减少NO的含量,影响平滑肌细胞功能,可以有效改善肠道功能障碍[19]。
本研究显示,大鼠在脊髓损伤后给予EGb治疗,能有效提高大鼠血清中SOD活性,降低MDA含量,肠组织HE染色小肠绒毛排列整齐,其表面少糜烂或者溃疡,小肠黏膜亦无明显出血和炎细胞浸润,对脊髓损伤后的肠道起保护作用;慢波电活动均较稳定,能保护肠道平滑肌活性。
综上所述,EGb不仅能够通过减少脂质过氧化反应和抗氧化作用保护肠黏膜,而且还能通过减少NO的含量保护肠道平滑肌,改善肠道功能。
EGb的抗氧化作用和减少脂质过氧化反应的具体过程以及相关的分子学机制还有待深入研究,EGb如何减少肠道NO含量亦需进一步的实验验证。EGb在脊髓损伤治疗中发挥作用的相关机制有待进一步研究。
[1]Milicevic S,Bukumiric Z,Nikolic AK,et al.Demographic characteristics and functional outcomes in patients with traumatic and nontraumatic spinal cord injuries[J].Vojnosanit Pregl,2012,69(12):1061-1066.
[2]刘浩,白春宏.脊髓损伤病人肠道管理[J].创伤外科杂志, 2014,16(1):79-81.
[3]岳军忠,徐青.脊髓损伤后结肠运动与胃动素、P物质、血管活性肠肽[J].中国康复理论与实践,2010,16(8):755-757.
[4]龙志华,高飞,张锋良,等.大鼠脊髓损伤后P物质与神经源性肠道功能障碍的关系[J].中国康复理论与实践,2014,20(8): 718-722.
[5]Sigurdsen E,Torhaug T.Spinal cord injury and bowel function[J].Tidsskr Nor Laegeforen,2012,132(9):1107-1110.
[6]Bai CH,Li SY,An H.Influence of S3 electrical stimulation on gastrointestinal dysfunction after spinal cord injury in rabbits[J].Chin J Traumatol,2014,17(5):267-274.
[7]毛燕飞,孙璐璐,廖兴志,等.舒血宁对肠缺血再灌注大鼠肝脏保护作用的研究[J].实用医学杂志,2011,27(4):584-586.
[8]陈建敏,谢少华,杨拯,等.银杏叶提取物抗氧化作用对大鼠脊髓损伤后运动功能恢复的影响[J].中国康复理论与实践, 2013,19(12):1124-1127.
[9]肖晓芬,史晶,滑蓉蓉,等.脊髓损伤神经源性肠道功能障碍的护理干预效果研究[J].中国医药导报,2014,11(1):122-124.
[10]Whiteneck GG,Gassaway J,Dijkers MP,et al.Inpatient and postdischarge rehabilitation services provided in the first year after spinal cord injury:findings from the SCIRehab study[J]. Arch Phys Med Rehabil,2011,92(3):361-368.
[11]李达,郑季南,林淑瑜,等.脊髓损伤患者神经功能恢复的治疗研究新进展[J].临床军医杂志,2014,42(6):620-623.
[12]姚冬梅,杨拯,黄叶,等.银杏叶提取物预防继发性脊髓损伤机制研究[J].辽宁中医药大学学报,2010,12(5):248-250.
[13]刘浩.骶神经刺激对脊髓损伤大鼠肠道机械屏障保护机制的初步探讨[D].河北:河北医科大学,2014.
[14]Ebert E.Gastrointestinal involvement in spinal cord injury:a clinical perspective[J].J Gastrointestin Liver Dis,2012,21(1): 75-82.
[15]白春宏,刘浩,李双英,等.骶神经电刺激对脊髓损伤大鼠肠黏膜机械屏障的保护作用[J].中国应用生理学杂志,2014,30 (5):471-474.
[16]辛杰,张忠礼,张培良,等.银杏叶提取物对实验性脊髓损伤后诱导型一氧化氮合成酶表达的影响[J].中国矫形外科杂志, 2007,15(22):1735-1737.
[17]Kobuchi H,Droy-Lefaix MT,Christen Y,et al.Ginkgo biloba extract(EGb 761):inhibitory effect on nitric oxide production in the macrophage cell lineRAW264.7[J].Biochem Pharmacol,1997,53(6):897-903.
[18]Ao Q,Sun XH,Wang AJ,et al.Protective effects of extract of Ginkgo biloba(EGb 761)on nerve cells after spinal cord injury in rats[J].Spinal Cord,2006,44(11):662-667.
[19]杜鹃,唐影,高莉,等.血管活性肠肽参与银杏叶提取物对结肠运动的抑制作用[J].浙江中医杂志,2008,43(11):656-657.
Effect of Ginkgo Biloba Extract on Intestinal Function after Spinal Cord Injury in Rats
LI Xin-rui,LUO Lan,YANG Zheng,WANG Qiang,SONG Qiang,CHEN Yong,HUANG Qian,NIE Huan,CHEN Jian-min
Chengdu Medical College,Chengdu,Sichuan 610500,China
Objective To observe the effect of Ginkgo biloba extract(EGb)on intestinal function after spinal cord injury(SCI)in rats. Methods 36 Sprague-Dawley rats were randomly divided into group A(n=12),group B(n=12)and group C(n=12).SCI model was established with Allen's mode(10 g×25 mm)at T10.30 minutes later,group A was intraperitoneally injected with methylprednisolone 30 mg/kg every 24 hours;group B was injected with Shuxuening injection(EGb)1.75 mg/kg every 24 hours;group C were injected with equal volume of saline.The slow wave of intestinal smooth muscle was measured,the activity of superoxide dismutase(SOD)and the content of malondialdehyde(MDA)in serum were determined 1 day,3 days and 7 days after modeling,while intestinal tissue was tested with HE staining.Results The amplitude and frequency of the myoelectric slow wave increased in the groups A and B 3 and 7 days after modeling compared with those in the group C(P<0.05);meanwhile,the activity of SOD increased and content of MDA decreased in the groups A and B (P<0.05).The HE scores decreased in the groups A and B compared with those in the group C(P<0.05),which presented that the inflammatory exudation was mild,the hemorrhagic spot was few and the area was limited.The intestinal villous of the group C was blunt with large infiltration of inflammatory cells and inflammatory exudate on the mucosal surface.Conclusion EGb can improve the recovery of intestinal function in rats spinal cord injury through antioxidant.
Ginkgo biloba extract;spinal cord injury;malondialdehyde;superoxide dismutase;gastrointestinal dysfunction
10.3969/j.issn.1006-9771.2015.04.007
R651.2
A
1006-9771(2015)04-0397-05
2014-10-08
2014-11-26)
1.成都医学院大学生创新实验计划项目(No.CXXS201307);2.成都医学院实验室开放项目(No.Kf201401)。
成都医学院基础医学实验教学中心,四川成都市610500。作者简介:李欣芮(1993-),女,汉族,四川宜宾市人,本科生。通讯作者:杨拯(1980-),男,汉族,四川苍溪县人,硕士,高级实验师,主要从事脊髓损伤和胃肠道动力障碍疾病的治疗与机制研究。E-mail:yzixjj@ 163.com。
