琥珀酸S-美托洛尔缓释片的研制及体外释放特征探讨
2015-12-13刘阿敏李德刚狄潘潘李晓祥
丁 斌,刘阿敏,李德刚,狄潘潘,李晓祥
(1.安徽中医药大学,安徽 合肥 230038;2.安徽省新星药物开发有限责任公司,安徽合肥 230088)
美托洛尔为选择性β1受体阻滞剂,是用于治疗高血压等心血管疾病的经典药物[1],其包括两个对映异构体S-美托洛尔与R-美托洛尔,S-美托洛尔与 β1受体的亲和力是 R-美托洛尔的500倍[2],S-美托洛尔具有心脏选择性,即使高剂量也不会对β2受体产生阻滞作用,与其他药物几乎无药物相互作用。抗高血压药物缓释制剂与普通制剂相比可以减少服药次数,长时间维持合适的血药浓度避免出现峰谷现象[5],提高药物的安全性、有效性。国内研究美托洛尔缓释片均为消旋体,目前还没有S-美托洛尔缓释片产品上市,也没有相关研究报道。骨架缓释片技术成熟、工艺简单、释药合理,将琥珀酸S-美托洛尔制成24 h骨架缓释片,必将为临床提供一种更加有效、安全的抗高血压缓释制剂。
1 仪器与材料
1.1 药品与试剂 琥珀酸S-美托洛尔原料(安徽省新星药物开发有限责任公司制备,批号:20130402,含量:99.91%,纯度:99.74%),琥珀酸S-美托洛尔对照品(安徽省新星药物开发有限责任公司制备,批号:20130103,含量:99.90%,纯度:99.92%),羟丙基甲基纤维素(HPMC,规格 K15M、K100M,上海昌为医药辅料技术有限公司),微晶纤维素、可压性淀粉、乳糖、微粉硅胶、硬脂酸镁(安徽山河药用辅料股份有限公司),试剂均为分析纯。
1.2 仪器 高效液相色谱仪(SPD-10AVP检测器、LC-10ATVP泵,日本岛津),ZRS-8GD型智能溶出试验仪(天津天大天发科技有限公司),AB135-S型电子天平(德国梅特勒公司),DP30型单冲压片机(北京国药龙立科技有限公司),片剂硬度测定仪(上海黄海药检仪器厂),UV-2450型紫外可见分光光度计(日本岛津)。
2 方法与结果
2.1 琥珀酸S-美托洛尔24 h缓释片的制备 原料、骨架材料及填充剂分别过100目筛,按处方量称取、混匀,湿法制粒,以90%的乙醇溶液制备软材,过24目筛制粒,于60℃干燥,30目筛整粒,加入处方量的硬脂酸镁和微粉硅胶,混匀,采用8 mm浅凹冲模压片,压力控制在9 kg左右。
2.2 琥珀酸S-美托洛尔含量的测定
2.2.1 对照品的配置 精密称取已干燥的琥珀酸S-美托洛尔标准品52 mg,置于100 mL容量瓶中,用pH=6.8的磷酸缓冲溶液溶解并定容,摇匀,精密量取1 mL定容至10 mL得浓度为52 mg·L-1的对照品溶液,备用。
2.2.2 波长的选择 取上述配制的对照品溶液,以pH=6.8的磷酸缓冲溶液为空白溶液,按照中国药典UV法(紫外分光光度法)测定项下操作,在200~400 nm波长范围内扫描吸收图谱见图1。
由图谱可知在222和280 nm附近有最大吸收,但是由于在222 nm处为末端吸收,故选择280 nm作为检测波长。按处方比例称取辅料,同法操作,在此波长下辅料无吸收干扰。
2.2.3 色谱条件 参考美国药典关于琥珀酸美托洛尔的标准,最终选择色谱柱:Luna C8柱(4.6 mm×250 mm,5 μm),流动相:乙腈—磷酸盐缓冲液(pH=3)20∶80,流速:1.0 mL·min-1,柱温:35℃,波长:280 nm。
2.2.4 检测限、定量限的测定 取上述13.2 mg·L-1浓度的对照液,并将其逐步稀释进样,峰高为基线噪音10倍的浓度为最低定量限浓度,峰高为基线噪音3倍的浓度为最低检测限浓度。结果表明,最低检测限浓度为0.021 mg·L-1,最低定量限浓度为 0.072 mg·L-1。
2.2.5 线性范围 精密称取对照品13.2 mg置于100 mL容量瓶中,加溶出介质至刻度,摇匀,得浓度132 mg·L-1的储备溶液。分别精密量取 0.05、0.25、0.5、0.75、1.0、1.2 mL 于 10 mL 容量瓶中,加溶出介质定容后分别进样200 μL,以峰面积(A)对进样量浓度(C)进行线性回归,得回归方程:A=50 739C+897.94(R2=0.999 6、r=0.999 8),结果表明琥珀酸 S-美托洛尔在 0.66 ~15.8 mg·L-1范围内线性关系良好。
2.2.6 系统精密度试验 取上述对照品溶液(13.2 mg·L-1)在上述色谱条件下,重复进样6次,计算得RSD(相对标准偏差)=0.44%,表明仪器精密度良好。
2.2.7 溶液稳定性试验 取上述对照品溶液(13.2 mg·L-1),室温放置分别于 0、2、4、6、8、12、24、48 h进样,记录峰面积,计算得峰面积RSD=1.2%,表明溶液在48 h稳定性良好。
2.2.8 准确度试验 精密称取对照品 0.66、10.56、15.84 mg(相当于对照品质量的 5%、80%、120%)分别置于100 mL量瓶中加介质定容,再分别从中精密量取1 mL于10 mL量瓶中加介质稀释到刻度,各配制3份,摇匀,进样,结果表明回收率为 100.19%,RSD=0.77%。
2.3 琥珀酸S-美托洛尔释放度检测法 取上述方法制备的缓释片,参照释放度测定法(中国药典2010版二部附录 XD第一法)采用桨法:50 r·min-1,温度:(37 ±0.5)℃,释放介质为 pH=6.8 的磷酸缓冲液,于 0.5、1、2、4、6、8、10、12、16、20、24 h取样10 mL,经0.45 μm滤膜过滤,并及时补充同等体积介质,取续滤液备用。采用HPLC法测定释放量,用外标法计算累计释放度[6-7]。
2.4 影响琥珀酸S-美托洛尔释放因素考察 本研究采用相似因子法对释放度曲线进行相似性判断,相似因子系数f2可反映释放度差异,f2在50~100之间说明两曲线相似,f2=100说明曲线重合,相似因子系数f2越小,释放曲线间差异越大,相似因子系数计算公式:
2.4.1 不同规格HPMC对释放度的影响 分别取相同粒度不同规格的HPMC(K15M和K100M)以及K15M和K100M的混合骨架材料(质量比1∶1),用量均占总质量40%,分别制备缓释片,取6片测定释放度,释放曲线如图2。
采用相似因子法对释放曲线两两之间进行相似性判定,K15M组为曲线A,混合骨架组为曲线B,K100M为曲线C,A与 B之间 f2=43.14,A与 C之间 f2=32.49,B 与 C 之间 f2=51.92 结果表明不同规格的HPMC对释放影响较大,低黏度HPMC释放较快,易造成前期突释,高黏度释放不完全,20 h仅释放77%。
2.4.2 混合HPMC比例对释放度的影响 取K15M和K100M的混合骨架材料,质量比分别为2∶1、1∶1、1∶2 制备缓释片,释放曲线如图3。
采用相似因子法对释放曲线两两之间进行相似性判定,K15M与K100M 质量比2∶1组 A,1∶1组为曲线为曲线B,1∶2组为曲线C,A与B之间f2=46.98,A 与 C 之间 f2=37.25,B 与 C 之间 f2=57.54,由结果可知骨架材料混合比例不同对释放度影响较大,高黏度HPMC含量过高会导致前期释放较慢后期释放不完全。
2.4.3 HPMC用量对释放度的影响 取K15M和K100M的混合骨架材料(质量比1∶1),用量分别占总处方质量20%、40%、60%制备缓释片,释放曲线如图4。
由结果可知不同含量HPMC对释放度影响较大,A曲线20%量与B曲线40%量、C曲线60%量的 f2分别为43.73 和39.57,B 与C 的 f2=69.57 说明两片剂释放行为相似,由图4可知一定范围内随着HPMC含量提高释放速率明显减小,但是HPMC的含量增大到一定程度后,进一步增大HPMC含量,药物的释放速率减慢程度趋缓。
2.4.4 填充剂种类对释放度的影响 以乳糖、微晶纤维素(MCC)、预胶化淀粉作为填充剂用量均为片剂的50%制备缓释片,释放曲线如图5。
其中乳糖组为曲线A,预胶化淀粉组为曲线B,MCC组为曲线C,A与B之间f2=44.36,A与C之间 f2=52.57、B 与 C 之间 f2=72.89,预胶化淀粉组与乳糖组差异明显,乳糖组释放较快,MCC组与预胶化淀粉组无明显差异,但是预交化淀粉组辅料蓬松,片剂压力较小,综合考虑选择MCC作为填充剂效果最好。
2.4.5 压力对释放度的影响 选择混合骨架材料(质量比1∶1)以及MCC为填充剂考察压力对释放度影响[8],采用6、9、12 kg 压力压片,释放曲线如图6。
其中6 kg组为曲线A,9 kg组为曲线B,12 kg组为曲线 C,A与 B之间 f2=46.01,A与 C之间f2=37.24,B 与 C 之间 f2=58.75,说明压力对释放度有影响,但是随着压力增加,其对释放速率的影响减小。
2.5 处方工艺的优化
2.5.1 正交设计 在前期单因素考察的基础上确定了进行正交试验的影响因素及水平[10],选择对药物释放影响较大的3个因素,即HPMC的规格种类、HPMC的用量以及压力作为影响因素A、B、C,每个因素分别取3个水平,以MCC为填充剂使片重保持恒定。根据L9(34)正交表确定处方组成,按照制备工艺制备缓释片。正交试验的因素水平见表1。
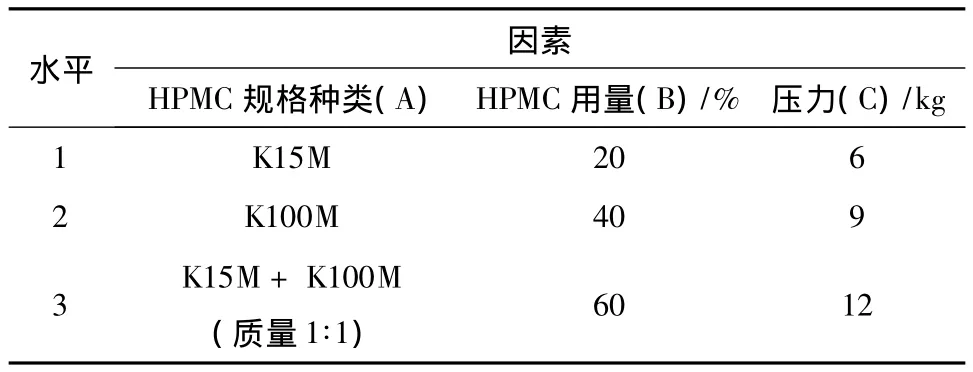
表1 因素水平表
参考中国药典2010版二部附录XIXD缓控释制剂指导原则的规定,采用综合评分法,同时参考美国药典对琥珀酸美托洛尔缓释片在1、4、8、20 h四个点的体外释放度的要求确定四个点释放标准:1 h累计释放百分率为10%;4 h累计释放百分率为30%;8 h累计释放百分率为50%;20 h累计释放百分率应该大于80%,故总分的计算公式为:Y=Q20-[(Q1-10)2+(Q4-30)2+(Q8-50)2]1/2,其中[(Q1 -10)2+(Q4 -30)2+(Q8 -50)2]1/2,以综合评分Y值与释放度指标共同描述其体外释放情况,综合考察指标Y值越大,药物缓释越接近理想。
2.5.2 方差分析与结论 极差R反映各因素对指标的影响程度,R值越大表明影响越明显。可见3种因素的影响程度为:A>C>B,即HPMC规格>压力>HPMC用量,表3结果表明,HPMC的规格对琥珀酸S-美托洛尔缓释片释放度的影响有统计学意义。各因素的最佳组合为A3B2C2,最佳处方工艺为K15M和K100M规格HPMC混合骨架,用量比1∶1,质量占总质量40%,MCC为填充剂,采用湿法制粒,压力控制在9 kg左右。
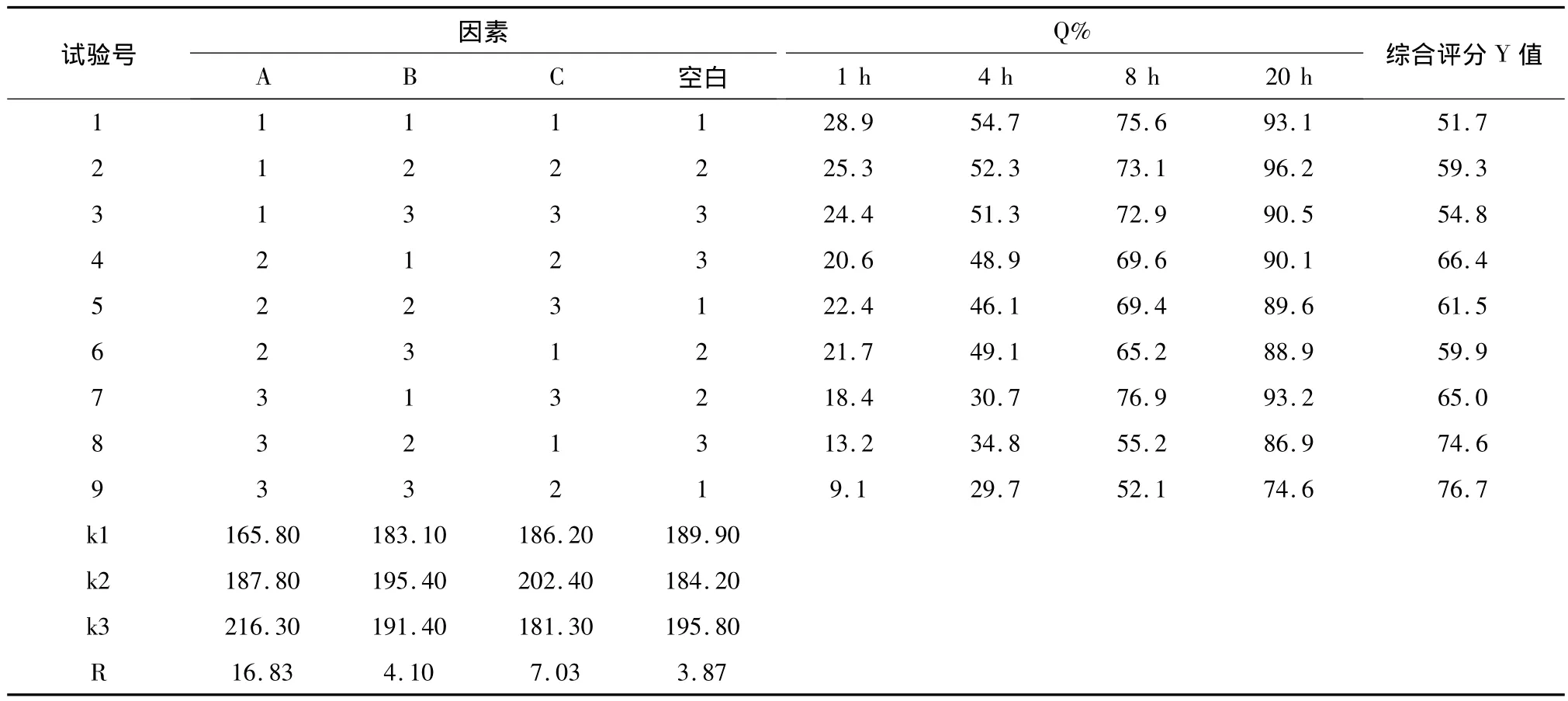
表2 正交设计试验结果
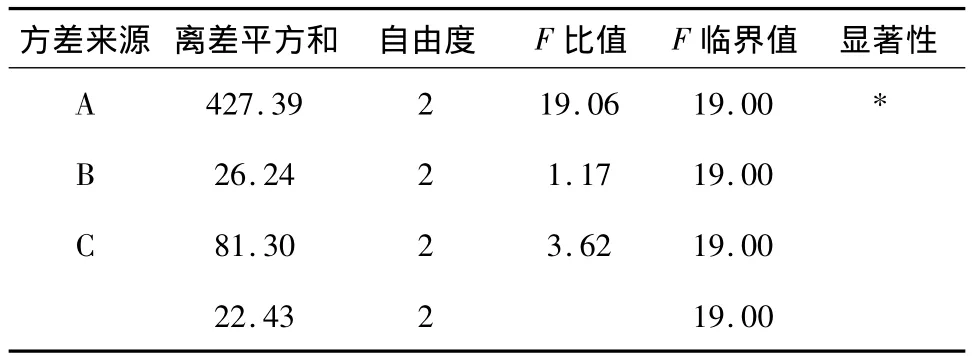
表3 方差分析(α=0.05)
2.6 琥珀酸S-美托洛尔骨架缓释片释药模型拟合采用零级释药方程、一级释药方程、Higuchi、Ritger-Peppas释药方程对自制的琥珀酸S-美托洛尔缓释片累积释放率进行数学拟合[11],根据拟合方程各时间点的累计释放率与实测值进行比较,计算相关系数r,相关系数r越接近1越佳,拟合结果见表4。
当 n<0.45时为 Fick扩散,n>0.89时为骨架溶蚀,由结果可知琥珀酸S-美托洛尔缓释片Ritger-Peppas模型拟合结果最优 n=0.546 6,0.45 <n<0.89为非Fick扩散即扩散与骨架溶蚀协同作用。
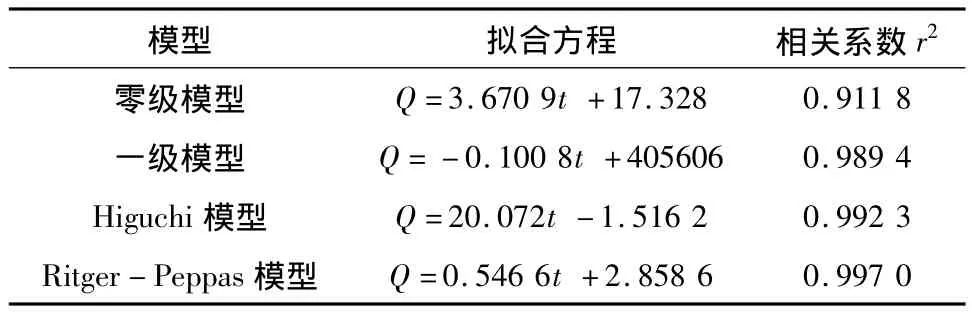
表4 琥珀酸S-美托洛尔缓释片释药模型拟合结果
3 讨论
缓释制剂的释放特征受缓释材料HPMC等影响,其相对分子质量越大黏度也越大,侧链溶胀越快,就越能形成高强度的凝胶,从而使药物释放减慢[11]。研究发现单一规格的HPMC不能满足本研究释放要求,故采用混合骨架材料,利用低黏度HPMC形成水化层速度快的特点控制前期的释放,配合形成水化层速度较慢的高黏度HPMC,控制药物后期释放,达到处方设计要求。
在制备亲水凝胶骨架片过程中所用的压力也会影响药物的释放,在一定范围内随着压力的增加,骨架的松密度增大,孔隙度减小,HPMC分子受束缚而无法伸展形成凝胶层,导致释放减慢。但是随着压力的增加这种影响将变得有限,因为HPMC一旦形成均匀连续的凝胶层,压力和孔隙度对聚合物溶胀和药物释放的影响将不再显著。本研究将制片压力控制在9 kg左右最为合适。
琥珀酸S-美托洛尔是药效更高、副作用更小的单一对映体手性药物,研制的琥珀酸S-美托洛尔24 h骨架缓释片与进口片体外释放相似,药物释放以非Fick扩散为主[12],缓释特征理想、处方合理、工艺稳定可行。
[1]牛小伟,许 涵,贺生亮,等.卡维地洛与美托洛尔比较治疗原发性高血压效果的系统评价[J].中国循证医学杂志,2013,13(8):963-970.
[2]Sharma P,Contractor P,Guttikar S,et al.Development of a sensitive and rapid method for quantitation of(S)-(-)-and(R)-(+)-metoprolol in human plasma by chiral LC-ESI-MS/MS[J].Journal of Pharmaceutical Analysis,2014,4(1):63 - 79.
[3]姜海东,由丽娜,马秋野.倍他乐克联合通心络胶囊治疗冠心病心绞痛临床研究[J].安徽医药,2013,17(8):1392 -1393.
[4]Desai PB,Srivastava AK.Adsorptive stripping differential pulse voltammetric determination of metoprolol at Nafionon-CNT-nano-composite film sensor[J].Sensors and Actuators,2013,1(76):632 -638.
[5]赵 静,韩卫星,胡华青.中老年高血压患者动态血压的昼夜节律分析[J].安徽医药,2013,17(12):2089 -2090.
[6]李小芳,舒 予,刘 玲,等.穿心莲总内酯骨架缓释片的制备及释放度测定[J].中成药,2014,36(3):634 -637.
[7]蔡红梅.盐酸文拉法辛缓释胶囊含量测定及释放度试验研究[J].广东药学院学报,2013,29(4):364 -365.
[8]陈 志,李传响.制片压力对不同厂家尼群地平片溶出度的影响[J].安徽医药,2014,18(7):1220 -1221.
[9]桂 彬,林巧平,许向阳,等.影响亲水凝胶骨架系统中药物释放因素[J].药学进展,2012,36(5):216 -223.
[10]杨满琴,谢若男,刘德春,等.正交试验优选十一味活血酊醇提工艺[J].安徽医药,2013,17(6):937 -938.
[11]杜 聪,贾晓辉,沈 青.HPMC水凝胶溶胀性能的影响因素研究[J].纤维素科学与技术,2011,19(1):47 -51.
[12]梁泽华,尹丽娜,张雅雯,等.积雪草总苷缓释片体外释药模型考察[J].成都中医药大学学报,2014,37(2):13 -14.
