吉非替尼对肺鳞癌患者免疫功能的影响及其近期临床疗效
2015-12-13张曙光
张 丹,杨 光,张曙光
(中国医科大学附属第一医院胸外科,辽宁沈阳 110031)
经过传统的化疗方案治疗晚期或转移性非小细胞肺癌(non-small-cell carcinoma,NSCLC)患者的中位性生存期一般只有8~12月时间,且存在的副反应较大,很多患者因不能耐受传统化疗方案而放弃治疗,因此需要寻找一种新的化疗方案[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)在很多种肿瘤细胞中存在表达量升高,该生长因子及其受体在调节细胞生长、增殖、分裂、分化、恶变、凋亡等方面起着重要作用,很多肿瘤都有EGFR的过度表达,因此EGFR是肿瘤治疗的重要作用靶点[2]。表皮生长因子受体—酪氨酸激酶(epidermal growth factor receptor-tyro-sine kinase,EGFR-TKI)目前已广泛应用于多种肿瘤的临床治疗中,吉非替尼(易瑞沙)是一种经过批准可以用于NSCLC治疗的二、三线化疗药物,是一种特异性较高的EGFR抑制剂[3],是一种口服型小分子 TKI,2003年5月经美国食品药品监督管理局(FDA)批准上市,于2004年底批准在中国上市[4]。以往针对吉非替尼对NSCLC患者的研究往往只针对于改善生存质量与生存期方面的研究,IPASS在亚洲人群中的流行病学研究表明,与紫杉醇、铂类等传统化疗药物相比,吉非替尼在无进展生存期、缓解率、生存质量改善方面均有统计学意义[5],但是目前对吉非替尼改善NSCLC患者免疫功能方面的研究却较少,本研究中,我们将针对吉非替尼对中晚期肺鳞癌患者免疫功能与临床疗效进行分析。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 选取2011年5月—2014年6月在中国医科大学附属第一医院胸外科收集的84例经病理组织学证实为初次治疗的晚期(ⅢB~Ⅳ期)肺鳞癌患者,且行EGFR基因学检测后证实为突变型,符合吉非替尼治疗标准,患者均经胸部CT检查证实肺部有肿物后进行病理学检查,头颅CT检查提示无头颅转移。随机分为两组:对照组、观察组,每组均为42例,年龄38~74岁,体重指数23~26 kg·m-2,且两组的基因突变率、性别、年龄、病理分期、病理分型、血清肿瘤标记物浓度等方面均无统计学差异(P>0.05),见表1~3。病例纳入依据:(1)根据病理学组织学证实为肺鳞癌的患者,且行EGFR基因学检测后证实为突变型,符合吉非替尼治疗标准;(2)患者自愿参与且经过院医学伦理委员后批准。病例排除依据:(1)Karnofsky评分在70分以下;(2)治疗前血、尿、便常规、凝血四项、肝肾功能出现严重异常;(3)合并严重心脑血管疾病、糖尿病、甲亢等代谢系统及内分泌系统疾病患者;(4)心电图检查出现严重异常改变;(5)1月内有外伤史、手术史,出现肉眼可见咳血;(6)出现中枢神经系统的转移;(7)影像学(CT/MRI)检查提示有重要血管及其周围侵蚀;(8)既往有烟酒等不良嗜好。
1.1.2 主要药品及试剂 吉非替尼片为英国阿斯利康制药有限公司产品、商品名:易瑞沙、规格:每片250 mg、批号:J20100014;顺铂注射液为云南个旧生物药业有限公司产品、规格:每支10 mg、批号:Q20100312;紫杉醇注射液为北京悦康药业集团有限公司产品、规格每支10 mg、商品名为:复能、批号:G20120231;维生素B12片为山西云鹏制药有限公司产品、规格:每片25μg、批号:F20110213;叶酸片为斯利安药业有限公司产品、商品名斯利安、规格:每片0.4 mg、批号:J2021303;CD3、CD4、CD8 细胞免疫检测采用FACSCalibur流式细胞仪;IgG、IgM、IgA体液免疫指标检测采用美国BD公司提供的TriTEST CD3PE/CD4双色荧光试剂盒。
1.1.3 主要仪器 美国雅培公司AxSYM型全自动免疫发光分度仪;美国雅培公司FACSCalibur流式细胞仪;中国海尔公司NFS-221S型超低温冰箱。
1.2.4 统计学分析 采用SPSS10.0统计软件对数据进行统计学分析。计数资料组间比较采用卡方检验或秩和检验;计量资料用(±s)表示,不同组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验,以P<0.05为具有统计学差异。
第一个步骤由小组内部展示与交流,针对本学习小组的共同探讨研究活动,结合所整合积累的各种信息资源进行分析、整理、讨论,在本组中获得知识与经验的共识。
在所有恶性肿瘤中,肺癌的发病率与死亡率均居首位,其中NSCLC约占肺癌发病率的80%以上,当确诊时已经有70%以上的患者进入晚期[7]。传统的铂类药物联合化疗是一线治疗方案,特异性较差,作用于分裂期的肿瘤细胞同时杀伤大量分裂旺盛的正常组织细胞,对人体正常组织损伤性较大,患者不良反应较大,依从性低,张波等[8]通过给予晚期非小细胞肺癌患者口服吉非替尼证实了吉非替尼治疗组较传统培美曲塞治疗组的副反应发生率低,大大改善了患者的生存质量。但本实验结果显示治疗过程中两组患者治疗过程中两组不良反应比较差异无统计学意义(P>0.05),与杨玉贤等[9]实验结果相同。
2.1 两组肺鳞癌患者治疗前临床资料与免疫功能比较 治疗组肺鳞癌患者治疗前临床资料、免疫功能与对照组均无统计学差异(P>0.05),结果见表1~3。
2.3 两组肺鳞癌患者治疗后临床疗效比较 治疗后观察组CR、PR、ORR、DCR均高于对照组,差别较大。SD、PD均低于对照组,见表4。
1.2 方法
2 结果
1.2.2 免疫指标的测定 抽取静脉血5 mL,注入玻璃试管中,静置10 min,以3 000 r·min-1离心 l0 min,分离血清在-70℃超低温冰箱内保存待测,采用流式细胞仪细胞计数仪检测外周血T细胞亚群(CD3、CD4、CD8)水平及免疫散射比浊法检测免疫球蛋白(IgG、IgM、IgA),用 (±s)表示。
1.4 排除标准 ①恶性肿瘤晚期;②严重感染;③严重心力衰竭及肝脏功能损害;④糖尿病酮症酸中毒;⑤妊娠;⑥1型糖尿病;⑦根据病史及检查证实有原发性急慢性肾小球肾炎,以及有高血压肾病、紫癜性肾炎、系统性红斑狼疮性肾炎、乙型肝炎相关性肾炎、肿瘤相关性肾病等继发性肾小球疾病。
1.2.1 病例的分组与处理 84例经病理组织学证实为初次治疗的晚期(ⅢB~Ⅳ期)肺鳞癌患者,随机数字表法分为两组(观察组与对照组),每组42例,两组患者入院第1天后即开始给予常规治疗,观察组在常规治疗基础上给予口服吉非替尼片250 mg·d-1。常规治疗方案:两组患者均在入院前1周开始口服维生素B12片,100μg·d-1,连续应用3 d,叶酸在入院前 1 周开始补充,1.2 mg·d-1,连续应用至化疗结束后21 d,静脉滴注紫杉醇150 mg·m-2,治疗2 d后联合顺铂静脉滴注30 mg·m-2,连续滴注2 d,每组都以21 d为一个周期,连续治疗2个周期(42 d)后观察两组治疗前后外周血清肿瘤标记物的浓度、临床疗效,外周血清肿瘤标记物的浓度测定为治疗第42天后抽取静脉血进行测定,用(±s)表示,所取标本均在1周内测定,并记录两组患者的不良反应。本临床研究由于科室硬件设施与经费的原因对实验人群未行EGFR基因检测。
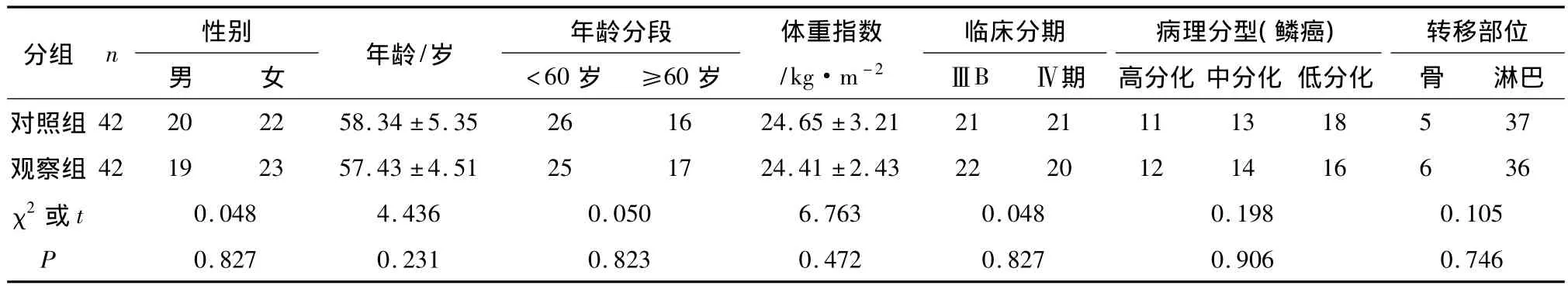
表1 两组患者治疗前临床资料比较/n(%)
表2 两组患者治疗前后细胞免疫功能比较(±s)
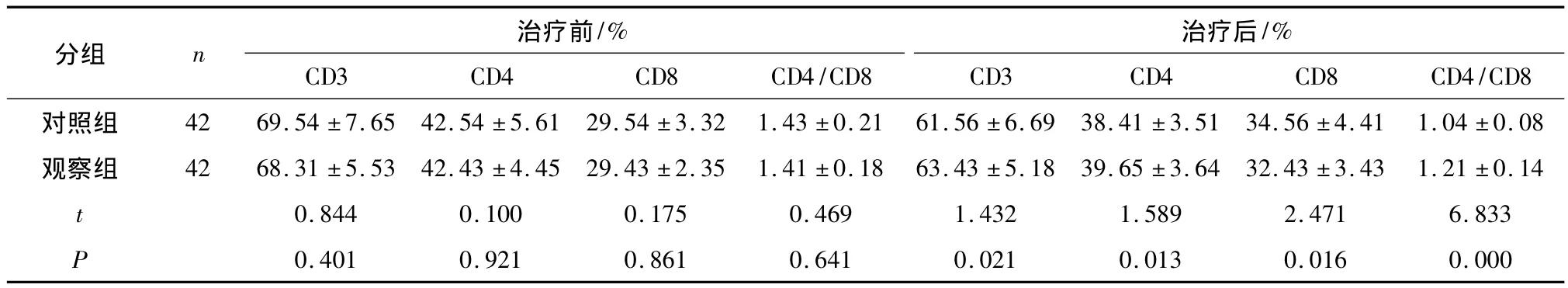
表2 两组患者治疗前后细胞免疫功能比较(±s)
分组 n 治疗前/%CD3 CD4 CD8 CD4/CD8治疗后/%CD3 CD4 CD8 CD4/CD8对照组 42 69.54 ±7.65 42.54 ±5.61 29.54 ±3.32 1.43 ±0.21 61.56 ±6.69 38.41 ±3.51 34.56 ±4.41 1.04 ±0.08观察组 42 68.31 ±5.53 42.43 ±4.45 29.43 ±2.35 1.41 ±0.18 63.43 ±5.18 39.65 ±3.64 32.43 ±3.43 1.21 ±0.14 t 0.844 0.100 0.175 0.469 1.432 1.589 2.471 6.833 P 0.401 0.921 0.861 0.641 0.021 0.013 0.016 0.000
表3 两组患者治疗前后体液免疫功能比较(±s)

表3 两组患者治疗前后体液免疫功能比较(±s)
分组 n 治疗前/g·L-1 IgG IgM IgA治疗后/g·L-1 IgG IgM IgA对照组 42 13.53 ±1.24 1.75 ±0.16 2.56 ±0.15 11.43 ±1.31 1.42 ±0.12 2.12 ±0.17观察组 42 13.45 ±1.16 1.71 ±0.16 2.49 ±0.38 12.45 ±1.09 1.56 ±0.21 2.23 ±0.31 t 0.305 1.146 1.110 3.879 3.751 2.016 P 0.761 0.255 0.272 0.000 0.000 0.048
2.2 两组肺鳞癌患者治疗后免疫功能比较 治疗后两组患者血清 CD3、CD4、IgG、IgM、IgA 浓度与CD4/CD8较治疗前有所降低,CD8较治疗前有所升高;治疗后观察组患者血清 CD3、CD4、CD4/CD8、IgG、IgM、IgA浓度明显高于对照组,差异有统计学意义。观察组CD8较对照组低,差异有统计学意义(P<0.05);观察组临床疗效优于对照组(P<0.05),结果见表 2,3。
1.2.3 近期临床疗效评价标准 根据实体肿瘤的近期临床疗效评价标准可以分为:完全缓解(CR)、部分缓解(PR)、病变稳定(SD)、病变进展(PD),(CR+PR)/总例数×100%是客观有效率(ORR);(CR+PR+SD)/总例数 ×100%是疾病控制率(DCR),连续化疗2个周期(42 d)后,行胸部64排螺旋CT平扫+增强对病灶进行测量,以评价疗效[6]。治疗过程中观察两组不良反应情况。
“田田网”是2015年由武汉三新集团研发的面向全国出版机构、图书馆藏机构的正版数字资源B2B交易平台,是一个集版权控制、新书发布、销售,图书馆采购和读者借阅服务、荐购为一体的综合服务平台[4]。平台引入了大数据、云计算技术,采用国际领先的 DRM 双版权控制系统,全程控制电子书内容传播,率实践了纸电同步的采购理念。

表4 两组患者临床近期疗效比较/n(%)
2.4 不良反应 对照组主要为恶心21例(50.0%),恶心、呕吐 14 例(33.3%),骨髓抑制 10例(23.8%);观察组恶心 20 例(47.6%),恶心、呕吐14 例(33.3%),骨髓抑制 9 例(21.4%)。两组不良反应比较差异无统计学意义(P>0.05)。
3 讨论
总之,在实施“微型探究”教学中,教师要善于在知识形成的“关键点”,在运用数学思想方法解决问题策略的“关节点”,在学生思维的“最近发展区”内,提出恰当的、具有思考价值的问题串,引发学生的思考与探索,启迪学生思维的深层参与,促进学生理解数学,高效学习,实现数学意识和数学核心素养不断得以提升!
在《冷水水表检定规程》中[1],指出正常使用条件下,水表的检定周期为2年。但在实际应用中,检定工作可能没有如期进行,一般是企业或用户感到计量不准确后,才把水表送至技术机构进行检定。检定周期超限后,难以保证水表的计量精度,就会出现计量误差现象。
EGFR是癌基因的表达产物,与癌症的发生、发展及其肿瘤细胞的转移与浸润密切相关,目前临床将EGFR作为实体肿瘤诊断与治疗的重要指标[9]。过去针对肺鳞癌的治疗手段中主要包括四大类:化学药物疗法、放射疗法、手术疗法、生物疗法,但这四大类方法均不能很好的抑制肿瘤细胞的转移与增殖,且治疗过程中患者均存在不同程度的副反应,耐受性及依从性均较差[10]。吉非替尼本身是一种特异比较高的EGFR-TKI抑制剂,能选择性抑制EGFR-TKI信号传导,将肿瘤细胞阻滞于G1期,诱导肿瘤细胞发生凋亡、减少肿瘤组织新生血管的产生,进而减少肿瘤组织血供,从而达到抑制肿瘤细胞转移的功能,吉非替尼通过和其他化疗药物的联合应用可发挥协同效应[11]。不仅仅针对于肺癌的联合治疗,章晓萍等[12]研究证实:吉非替尼联合顺铂能很好的抑制食管癌细胞的增殖。
肺癌患者都存在不同程度的免疫失衡,而既往针对吉非替尼对免疫系统调节的研究较少,细胞免疫是T淋巴细胞参与的一种重要免疫反应,T细胞亚群(CD3、CD4、CD8),恶性肿瘤患者往往免疫功能受到严重的抑制,放化疗、手术创伤均能加重免疫抑制,表现为外周血中CD3、CD4减少,这两个亚群均参与机体特异性细胞免疫反应,抑制淋巴细胞亚群CD8增多,CD4/CD8比例降低[13]。B细胞是机体内参与体液免疫的一种重要淋巴细胞,其水平高低与血清抗体水平密切相关,银杏叶提取物能很好的提高机体血清抗体浓度,IgG、IgM是人体内重要的免疫球蛋白,在体液免疫过程中发挥重要作用[14]。本实验结果显示治疗后两组患者血清CD3、CD4、IgG、IgM、IgA浓度与 CD4/CD8较治疗前有所降低(P<0.05),CD8较治疗前有所升高(P<0.05)与徐校成等[15]实验结果相同;治疗后观察组患者血清 CD3、CD4、CD4/CD8、IgG、IgM、IgA 浓度明显高于对照组(P<0.05),观察组CD8较对照组低(P <0.05),与杨玉贤等[9]实验结果相同,但是普通化疗药物联合吉非替尼调节肺癌患者免疫力的作用机制还有待进一步探索。
治疗后观察组CR、PR、ORR、DCR均高于对照组,差异均有统计学意义(P<0.05),SD、PD均低于对照组,差异均有统计学意义(P<0.05),与杨玉贤等[9]实验结果相同。
综上所述吉非替尼联合传统化疗药物能很好的提高肺癌患者机体免疫功能并能提高临床疗效且不良反应较少,调节免疫力的具体机制尚不明确,可能与吉非替尼治疗组患者的近期临床疗效较好,改善了患者的营养与精神状态有关。
[1]王孟昭,钟 巍,张 力,等.吉非替尼单药维持治疗晚期非小细胞肺癌的疗效和安全性分析[J].中华肿瘤学杂志,2008,30(3):221-224.
[2]Scartozzi M,Bearzi I,Berardi R,et al.Epidermal growth foctor receptor(EGFR)downstream signalling pathway in primary colorectal tumours and related metastatic sites:optimising EGFR-targeted treatment options[J].Br JCancer,2007,97(1):92- 97.
[3]Mok T,Wu YL,Zhang L,et al.A small step towards personalized medicine for non- small cell lung cancer[J].Discov Med,2009,8(43):227-231.
[4]董 标,张远东,丁作林,等.表皮生长因子受体非突变型非小细胞肺癌分子靶治疗有效1病例报道及相关文献复习[J].安徽医药,2014,18(9):1742-1743.
[5]Saijo N,Takeuchi M,Kunitoh H.Reasons for response differences seen in the V15- 32,INTERSET and IPASS trials[J].Nat Rev Clin Oncol,2009,6(5):287- 294.
[6]杨晓利,王 峰,何 炜,等.贝伐单抗联合培美曲塞加顺铂一线治疗Ⅳ期非小细胞肺癌的临床观察[J].西安交通大学学报(医学版),2013,34(4):554-556.
[7]徐 添,赵洪瑜,严 煜,等.晚期非小细胞肺癌 Buckley-James模型生存分析[J].中华流行病学杂志,2010,31(10):1179-1183.
[8]张 波,韩铮波,姜丹丹,等.晚期肺癌患者靶向药物治疗对其生命质量的影响[J].临床误诊误治杂志,2013,26(12):84-86.
[9]杨玉贤,丘希辉,陈志明,等.晚期非小细胞肺癌吉非替尼治疗性别与疗效相关性分析[J].中华肿瘤防治杂志,2011,18(16):1277-1280.
[10]孙立新.肺癌抗体靶向治疗与新型工程抗体药物的研究[J].北京协和医学院学报,2012,22(3):538-540.
[11]Bencardino K,Manzoni M,Delfanti S,et al.Epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of nonsmall- cell lung cancer:results and open issue[J].Intern Emerg Med,2007,2(1):3-12.
[12]章晓萍,李青麟.吉非替尼联合顺铂对食管癌细胞增殖的影响[J].海峡医药,2012,24(8):240-242.
[13]鲍 健,孙媛媛,葛 磊,等.化疗联合 CIK输注对晚期NSCLC患者 T细胞亚群及生存的影响[J].安徽医药,2014,18(12):2356-2359.
[14]李晓辉,李军民,冯秋霞,等.围手术期肠内营养支持对食管癌患者术后免疫功能的影响[J].中国医学创新,2011,8(8):57-59.
[15]徐校成,吕颖颖,徐佳灵.晚期非小细胞肺癌患者化疗对免疫功能的影响[J].中华医院感染杂志,2015,25(6):1312-1314.
