HPLC法同时测定大鼠血浆中CYP450酶探针药物氯唑沙宗、甲苯磺丁脲和咪达唑仑浓度
2015-12-13朱冬春孙旭群许杜娟
朱冬春,程 钢,孙旭群,苏 涌,吴 娟,夏 泉,许杜娟
(1.安徽医科大学药学院,安徽合肥 230032;2.安徽医科大学第一附属医院药剂科,安徽合肥 230022)
大多数药物进入机体后,在细胞色素 P450(CYP450)酶催化下发生代谢解毒或者代谢活化,这些需要CYP450酶代谢的药物同时使用,通过影响CYP450酶活性,有可能产生相互干扰[1],发生药物间相互作用,影响疗效导致用药不良反应[2]。探针药物法即通过考察特异性探针药物的代谢变化,反映相应 CYP450酶的活性,进而评价药物对CYP450酶的影响[3],对预测可能的药物相互作用有重要价值[4]。CYP450酶由多种亚型组成,传统的单探针药物法,采用一种探针药物,每次反映一个或一组代谢酶的活性,效率较低,很难满足现代研究快速、方便以及经济性的要求;“Cocktail”探针药物法是通过考察多个特异性探针药物的代谢,同时评价多种代谢酶亚型的活性变化,具有快速、经济等特点,成为研究药物相互作用的重要途径[5-9]。CYP2E1、CYP2C9和 CYP3A4是 CYP450酶系中3种重要的亚型,占肝脏CYP450酶总量的一半以上,其活性与多种药物的疗效甚至某些疾病的发生密切相关[10-12],其中氯唑沙宗是广泛认可的 CYP2E1探针药物,甲苯磺丁脲在体内几乎由CYP2C9介导的单一途径代谢,咪达唑仑也是评价CYP3A4代谢活性最为常用的探针药物,此3种探针药物给药后体内的血药浓度变化特征,可分别反映CYP2E1、CYP2C9和CYP3A4此3种代谢酶亚型的活性[13-14]。但氯唑沙宗、甲苯磺丁脲和咪达唑仑的血药浓度同时测定,文献报道多使用质谱方法,操作复杂,成本较高[15-18],本实验尝试建立快速、方便的高效液相色谱法,同时测定3种探针药物氯唑沙宗、甲苯磺丁脲和咪达唑仑血浆浓度,为考察3种探针药物在体内的药代动力学变化,以及进一步研究药物相互作用提供参考。
1 实验材料
1.1 仪器 Agilent 1100型高效液相色谱仪(包括自动进样系统、四元梯度洗脱泵、在线脱气机、柱温箱、DAD检测器和色谱工作站,美国Agilent公司);XW-80A旋涡混合器(上海医科大学仪器厂);HYC-362A药品保存箱(海尔集团);DW-FL270超低温冷藏箱(中科美菱);TGL-185台式高速冷冻离心机(长沙平凡仪器仪表有限公司);METYLER XP-205电子天平(上海Mettler-Toledo有限公司);FA2004上皿电子天平(上海精科天平);MG-2200型氮吹仪(日本Tokyo RIKAKIKAI)。
1.2 试药 地西泮(批号:1159302)、咪达唑仑(批号:171265-201001)、氯唑沙宗(批号:100364-201302)标准品均购自中国药品生物制品检定所,甲苯磺丁脲(批号:C17589900)德国Dr.Ehrenstorfer公司;甲醇为色谱纯(Tedia Company,美国),灭菌注射用水购于四川科伦药业,其余试剂为分析纯。
1.3 动物 健康雄性清洁级 SD大鼠,体重200~240 g,安徽医科大学实验动物中心提供。饲养温度20~25℃,湿度50% ~60%。给予普通饲料,自由饮水,适应性喂养1周后禁食12 h,眶静脉取血,5 000 r·min-1离心,取上清液制得空白血浆。
2 方法与结果
2.1 色谱条件 色谱柱:Dikma Diamonsil C18柱(4.6 mm ×250 mm,5 μm),流动相:甲醇与 pH3.45磷酸二氢铵(0.05 mol·L-1)按 61∶39(V/V)比例配制,流速:1 mL·min-1,进样量40 μL,柱温35℃,波长230 nm,带宽4 nm。
2.2 对照品溶液和内标溶液的制备 精密称取氯唑沙宗、甲苯磺丁脲、咪达唑仑以及内标地西泮标准品各25 mg,分别置于25 mL的量瓶中,加甲醇制成1 g·L-1对照品储备溶液。取1 g·L-1的地西泮溶液1 mL,加入50 mL容量瓶中甲醇定容,得到20 mg·L-1的内标工作溶液;各取配制好的1 g·L-1氯唑沙宗、甲苯磺丁脲、咪达唑仑对照品溶液2.5 mL,加入25 mL容量瓶中甲醇定容,即得100 mg·L-1的混合探针甲醇储备溶液。
2.3 血浆样品的制备与处理 取对照品的甲醇溶液,氮气吹干,加入大鼠血浆100μL,涡旋震荡2 min,即制备成相应浓度的血浆样品。在血浆样品100μL中加入内标溶液10μL(地西泮20 mg·L-1),涡旋涡旋震荡 2 min,加入三氯甲烷 1.6 mL,涡旋 3 min,12 000 r·min-1离心10 min,吸除上层,取下层有机相1.2 mL于另一试管中,氮气吹干,100μL流动相涡旋3 min复溶,进样40μL。
2.4 方法学考察
2.4.1 系统适用性 制备含氯唑沙宗、甲苯磺丁脲和咪达唑仑各2 mg·L-1的对照品混合溶液,氮气吹干后加100μL流动相涡旋3 min复溶,按“2.1”项下方法进样测定,考察标准品色谱图。取含氯唑沙宗、甲苯磺丁脲和咪达唑仑各2 mg·L-1的对照品混合溶液,按“2.3”项下方法血浆处理操作,制备并处理含3种探针药物各2 mg·L-1的血浆样本,按“2.1”项下方法进样测定,考察血浆样品色谱图。另取空白血浆,不加内标,按“2.3”项下血浆处理方法操作,考察空白血浆色谱图。
结果氯唑沙宗、甲苯磺丁脲、咪达唑仑以及内标地西泮保留时间稳定,药物色谱峰与相邻杂质色谱峰分离良好,色谱结果详见图1。
2.4.2 标准曲线的制备 制取不同浓度的3种探针药物混合甲醇溶液100μL,氮气吹干后加入空白血浆100μL,制备成氯唑沙宗、甲苯磺丁脲和咪达唑仑浓度为 0.1、0.2、0.5、1、2、5、10、20、50 mg·L-1的系列血浆样品,按“2.3”项下方法进行血浆处理操作,HPLC进样测定,测峰面积,以对照品浓度(C)为纵坐标,对照品峰面积与内标峰面积比为横坐标(A),绘制标准曲线并进行线性回归。结果氯唑沙宗标准曲线方程为 C=6.404A+0.033,r=0.999 5,甲苯磺丁脲标准曲线方程为C=8.762A-0.063,r=0.999 5;咪达唑仑标准曲线方程为 C=2.215A+0.023,r=0.999 5。氯唑沙宗、甲苯磺丁脲和咪达唑仑均在0.1~50 mg·L-1的范围内线性关系良好。见图2。
2.4.3 定量下限 取含氯唑沙宗、甲苯磺丁脲与咪达唑仑0.1 mg·L-1的3种探针药物对照品溶液100μL,氮气吹干后加入空白血浆100μL。平行制备3份,按“2.3”项下方法血浆处理,后将3份所得样品混匀,按“2.1”项下色谱条件平行进样分析5次,氯唑沙宗、甲苯磺丁脲和咪达唑仑实测浓度分别为(0.118 ±0.011)、(0.113 ±0.011)和(0.116±0.006)mg·L-1。3种成分准确度均在真实浓度的80%~120%之间,且相对标准偏差(RSD)小于20%,因此 0.1 mg·L-1氯唑沙宗、甲苯磺丁脲和咪达唑仑的对照品溶液,符合生物样品的定量分析要求。
2.4.4 精密度试验 取对照品混合溶液制备低、中、高3 种不同浓度(0.4、2、20 mg·L-1)的氯唑沙宗、甲苯磺丁脲和咪达唑仑血浆样品,按“2.3”项下方法样品处理,再按“2.1”项下方法色谱测定。一日内测定5次,在连续的5 d内分别进行平行试验一次,测定各成分在的色谱峰面积与内标峰面积,分别按“2.4.2”项下各标准曲线计算实测浓度,利用Excel软件求算RSD,结果在低、中、高浓度下,氯唑沙宗、甲苯磺丁脲和咪达唑仑精密度 RSD为4.78% ~9.78%,符合生物样本测定要求。具体结果见表1。
2.4.5 回收率试验 各取对照品制成低、中、高不同浓度的氯唑沙宗、甲苯磺丁脲和咪达唑仑(0.4、2、20 mg·L-1)的血浆样本,每个浓度5个平行样本,按“2.3”项下方法样品处理,再按“2.1”项下方法色谱测定。按标准曲线计算氯唑沙宗、甲苯磺丁脲和咪达唑仑浓度,实测值与加入值的比值计算回收率。结果3种探针药物的总回收率在92.71% ~109.79%范围内,符合生物样本测定要求。结果见表1。
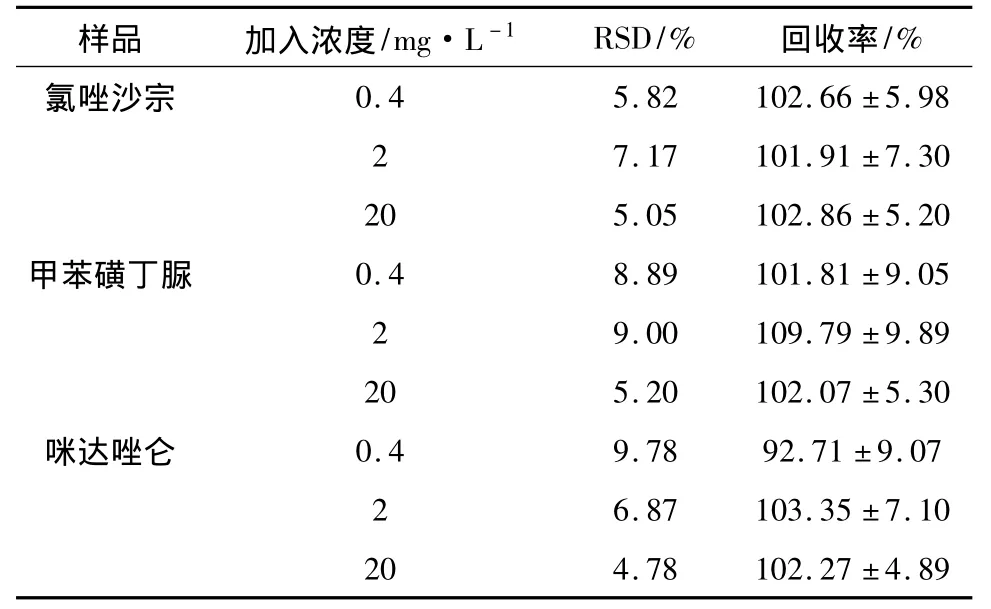
表1 大鼠血浆中3种探针药物HPLC法测定的精密度与回收率(n=10)
2.5 稳定性试验 考察3种探针药物在保存条件下的稳定性,氯唑沙宗、甲苯磺丁脲和咪达唑仑的血浆样品在-20℃中冷冻保存,在10、30 d测定样品中药物浓度,结果样品浓度无明显变化;对照品的甲醇溶液在2~8℃避光冷藏,考察其浓度变化,结果该条件下样品溶液6个月浓度无变化。血浆样品在室温(25±3)℃下放置以及处理后放置24h内稳定。测定结果表明,各样品在相应保存条件下稳定性良好。
3 讨论
血浆药物浓度常用检测方法有气相色谱法、液相色谱法、色谱—质谱联用法等,其中高效液相色谱法操作相对简单,成本较低,使用更为广泛。本研究选用反相高效液相色谱法(RP-HPLC)联用紫外检测器,探索血浆样本药物浓度的分析方法。对3种探针药物进行全波长扫描,各探针药物在230 nm均有较大紫外吸收。参考药典以及文献中氯唑沙宗、甲苯磺丁脲和咪达唑仑的分析方法[19-20],并结合其化学结构,理化性质等特点,最终选用甲醇和 0.05 mol·L-1的磷酸二氢铵(pH3.45)溶液作为3种探针药物的色谱流动相,其比例在61∶39时各探针药物、内标与杂质分离良好。
合适的血浆样品前处理对建立准确、可靠的HPLC方法至关重要[21]。常见如有机溶剂沉淀法、液液萃取法和固相萃取法等处理方法。相对于蛋白沉淀法、液液萃取法制备样品内源性杂质少,能更好消除基质效应的影响,且易浓缩处理,适用于低浓度的生物样品分析[22]。本实验采用16倍体积氯仿作为萃取溶剂,氯唑沙宗、甲苯磺丁脲和咪达唑仑取得的提取回收率和重现性均符合要求。
本方法操作简便,灵敏度高,快速可靠,适用于同时测定3种CYP450酶亚型探针药物氯唑沙宗、甲苯磺丁脲和咪达唑仑的大鼠血浆药物浓度,可为评价大鼠体内CYP2E1、CYP2C9和CYP3A4同工酶活性,以及为药物相互作用研究提供分析方法学参考。
[1]Verbeurgt P,Mamiya T,Oesterheld J.How common are drug and gene interactions?Prevalence in a sample of 1143 patients with CYP2C9,CYP2C19 and CYP2D6 genotyping[J].Pharmacogenomics,2014,15(5):655-665.
[2]朱 倩,李 俊,汤文建.中药对细胞色素P450酶活性影响及研究方法进展[J].安徽医药,2013,17(9):1457-1461.
[3]Tralau T,Luch A.“Drugs on oxygen”:an update and perspective on the role of cytochrome P450 testing in pharmacology[J].Expert Opinion on Drug Metabolism & Toxicology,2012,8(11):1357-1362.
[4]Samer CF,Lorenzini KI,Rollason V,et al.Applications of CYP450 testing in the clinical setting[J].Molecular Diagnosis & Therapy,2013,17(3):165-184.
[5]Huang Y,Zheng SL,Zhu HY,et al.Effects of aescin on cytochrome P450 enzymes in rats[J].Journal of Ethnopharmacology,2014,151(1):583-590.
[6]Morcos PN,Chang L,Kulkarni R,et al.A randomised study of the effect of danoprevir/ritonavir or ritonavir on substrates of cytochrome P450(CYP)3A and 2C9 in chronic hepatitis Cpatients using a drug cocktail[J].Eur J Clin Pharmacol,2013,69(11):1939-1949.
[7]Gao J,Shi Z,Zhu S,et al.Influences of processed rhubarbs on the activities of four CYP isozymes and the metabolism of saxagliptin in rats based on probe cocktail and pharmacokinetics approaches[J].Journal of Ethnopharmacology,2013,145(2):566-572.
[8]Han YL,Li D,Ren B,et al.Evaluation of impact of Herba Erigerontis injection,a Chinese herbal prescription,on rat hepatic cytochrome P450 enzymes by cocktail probe drugs[J].Journal of Ethnopharmacology,2012,139(1):104-109.
[9]Zheng L,Lu Y,Cao X,et al.Evaluation of the impact of Polygonum capitatum,a traditional Chinese herbal medicine,on rat hepatic cytochrome P450 enzymes by using a cocktail of probe drugs[J].Journal of Ethnopharmacology,2014,158(Pt A):276-282.
[10]韩 露,陈 真.CYP2E1在酒精性肝病中的作用[J].安徽医药,2014,18(6):997-1001.
[11]濮之晨,汪五三,徐 喆,等.基因多态性对他莫昔芬治疗乳腺癌的影响与个体化用药进展[J].安徽医药,2013,17(7):1083-1086.
[12]孙俊英,章 秋.安徽地区绝经后妇女细胞色素P450基因CYP19多态性与骨密度相关性研究[J].安徽医药,2010,14(5):548-550.
[13]Wang X,Peng Y,Jing X,et al.In vitro and in vivo assessment of CYP2C9-mediated herb-herb interaction of Euphorbiae Pekinensis Radix and Glycyrrhizae Radix[J].Frontiers in Pharmacology,2014,5:186.
[14]Mooiman KD,Maas-Bakker RF,Hendrikx JJ,et al.The effect of complementary and alternative medicines on CYP3A4-mediated metabolism of three different substrates:7-benzyloxy-4-trifluoromethyl-coumarin,midazolam and docetaxel[J].The Journal of Pharmacy and Pharmacology,2014,66(6):865-874.
[15]Uchida S,Tanaka S,Namiki N.Simultaneous and comprehensive in vivo analysis of cytochrome P450 activity by using a cocktail approach in rats[J].Biopharmaceutics & Drug Disposition,2014,35(4):228-236.
[16]Wohlfarth A,Naue J,Lutz-Bonengel S,et al.Cocktail approach for in vivo phenotyping of 5 major CYP450 isoenzymes:development of an effective sampling,extraction,and analytical procedure and pilot study with comparative genotyping[J].Journal of Clinical Pharmacology,2012,52(8):1200-1214.
[17]Zientek M,Youdim K.Simultaneous determination of multiple CYP inhibition constants using a cocktail-probe approach[J].Methods in Molecular Biology,2013,987:11-23.
[18]Pillai VC,Strom SC,Caritis SN,et al.A sensitive and specific CYP cocktail assay for the simultaneous assessment of human cytochrome P450 activities in primary cultures of human hepatocytes using LC-MS/MS[J].Journal of Pharmaceutical and Biomedical A-nalysis,2013,74:126-132.
[19]夏 军,谢文明,樊宝才,等.HPLC法同时测定大鼠血浆中氯唑沙宗和咪达唑仑的浓度[J].药学与临床研究,2012,20(2):172-174.
[20]呼自顺,徐 津,李 芹,等.“鸡尾酒”探针药物法评价苦参对大鼠CYP450不同亚型体内代谢活性的影响[J].中国医院药学杂志,2013,33(21):1775-1778.
[21]Vuckovic D.Current trends and challenges in sample preparation for global metabolomics using liquid chromatography-mass spectrometry[J].Analytical and Bioanalytical Chemistry,2012,403(6):1523-1548.
[22]冯健男,杜守颖,白 洁,等.生物样品前处理的研究进展[J].中国中药杂志,2014,39(21):4143-4148.
