多孔利福平PLGA微球的制备工艺研究
2015-12-12钦富华赵黛坚
钦富华,蔡 雁,赵黛坚
(1.浙江医药高等专科学校,浙江宁波 315100;2.浙江省宁波市第九医院,浙江 宁波 315020)
抗结核药在临床防治结核病的过程中起着重要作用。目前该类药物主要以口服或注射等全身给药为主,普遍存在肝脏、胃肠道的不良反应。且因长期给药导致多重耐药结核分枝杆菌的出现,使肺结核疫情再度呈现恶化趋势[1-3]。为了解决该问题,研究者提出抗结核药物以吸入的方式给药,经细支气管—肺途径将药物直接输送至靶部位,提高药物疗效,降低不良反应及耐药性的产生。其中生物可降解的微球被认为是具有良好前景的吸入给药载体。
采用生物可降解材料制备的微球具有良好的生物相容性和药物释放性能,常用的材料包括壳聚糖、聚乳酸(polylactic acid,PLA)、聚乳酸—羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]等[4-6]。要使药物有效地到达靶部位,必须提高微球在肺部的沉积率,传统的实心微球因空气动力学性质不适宜而大部分滞留于口咽部,达到肺部的量有限。因此,研究人员设计了低密度多孔PLGA微球(密度小于0.4 g·cm-3,平均几何粒径大于5.0 μm)[7],并证实其不仅提高了肺部的沉积且减少了肺部巨噬细胞的吞噬。近年来,多孔微球成为肺部给药系统研究的热门载体[8-9]。本研究采用利福平(rifampicin,RFP)为模型药物,生物可降解的PLGA为载体材料,对多孔微球的制备工艺进行考察。低密度多孔PLGA微球或可成为新的递送载体,提高利福平的肺靶向性,增加其抗结核疗效并降低毒副作用。
1 仪器与试药
Dionex U3000高效液相色谱仪(美国戴安公司);扫描电子显微镜(日本日立公司);电子分析天平(梅特勒—托利多仪器有限公司);XSP-8CA生物显微镜(上海光学仪器厂);Scientz-10N冷冻干燥机(宁波新芝生物科技股份有限公司);JY 92-ZD超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
利福平原料(上海金穗生物科技有限公司,批号JS10801);利福平对照品(中国食品药品检定研究院,110757-200206);PLGA 75∶25,PLGA 50∶50(山东医疗器械研究所);碳酸氢铵(上海试四赫维化工有限公司);甲醇、乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 乳化溶剂扩散法多孔RFP/PLGA微球的制备[10]称取一定量的NH4HCO3溶于0.1%聚乙烯醇(PVA)溶液作为内水相;另称取500 mg PLGA和50 mg RFP溶于适量二氯甲烷中作为有机相;将1 mL内水相加入到有机相中,短时探头超声成初乳,冰浴冷却后加入到外水相25 mL一定浓度的PVA溶液中,高速均质1 min成复乳,将复乳转移至200 mL 0.5%的PVA溶液中,低速(300 rpm)搅拌4 h使溶剂挥发,微球固化完全,离心收集微球,水洗后冷冻干燥24 h即得。
2.2 微球粒径及表面孔径的测定 光镜下随机计数200个微球的粒径,计算其平均值。采用扫描电子显微镜观察微球的表面形态,记录同一批球中5个微球表面孔道直径,取平均值,计算得到平均孔径。
2.3 微球包封率的测定 取微球约20 mg,精密称定,置25 mL容量瓶中,加乙腈溶解并定容至刻度,0.45 μm微孔滤膜过滤后HPLC法测定微球中的药物含量。包封率=(微球中药物测得量/微球理论载药量)×100%。
色谱条件:Agilent Zorbax SB-C18(4.6 mm×150 mm,5 μm)色谱柱;乙腈—0.075 mol·L-1KH2PO4溶液(40∶60)为流动相;检测波长为254 nm;流速1 mL·min-1,柱温 30℃,进样量 20 μL。
2.4 单因素考察对微球表观形态及包封率的影响
2.4.1 PLGA种类的影响 固定PLGA的浓度、发泡剂浓度、均质速度和外水相PVA浓度,分别采用PLGA 75∶25和 PLGA 50∶50 制备载药多孔微球,考察微球的形态和包封率。结果见表1和图1。

表1 PLGA种类对微球表观形态及包封率的影响
结果表明,采用不同的PLGA种类制备的微球在表面形态上有差异。以PLGA 75∶25为材料制备的微球孔道结构呈蜂窝状,内部和表面分布比较均匀,而采用PLGA 50∶50制备的微球则多为内部中空,且孔道尺寸相对较大。其原因可能是两种材料自身在密度及溶解后有机相的黏度大小上存在差异,导致气泡的聚集和逸出的速度不同。相比较而言,采用PLGA 75∶25制备的微球粒径和孔道尺寸更为均匀,因此后续考察均采用PLGA 75∶25为材质。
2.4.2 PLGA浓度的影响 固定发泡剂浓度、均质速度和外水相PVA浓度,考察不同的PLGA浓度对微球形态和包封率的影响,结果见表2和图2。

表2 PLGA浓度的影响结果
结果显示,微球的粒径随PLGA浓度的增加而增大,而表面孔径则变小。其原因主要是PLGA浓度增大,有机相的黏度变大,乳化分散的难度加大,同时气泡聚集和逸出的速度降低;PLGA浓度过低或者过高均影响微球的圆整性,过低微球难以支撑而破碎,过高则不圆整。随着PLGA浓度的增加,微球的包封率也相应增大,可能是所制备的微球比表面积减小,药物的扩散量减小,故包封率提高。但综合微球的形态和表面孔道的分布情况,本研究确定PLGA的浓度为10%。
2.4.3 发泡剂浓度的影响 固定PLGA浓度、均质速度和外水相PVA浓度,考察不同的发泡剂浓度对微球形态和包封率的影响,结果见表3和图3。
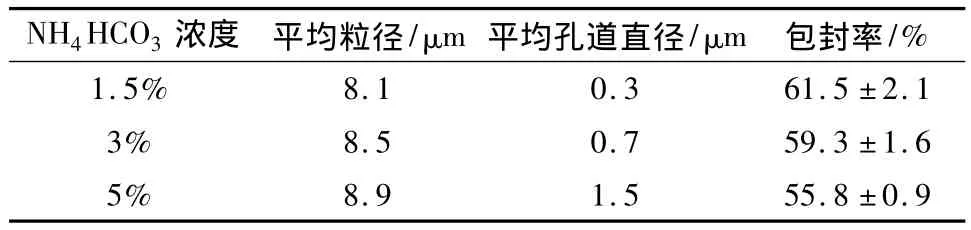
表3 发泡剂浓度的影响结果
结果显示内水相发泡剂浓度增加,微球粒径变化不大,孔道则明显增大。发泡剂浓度是影响微球多孔性的最主要因素,发泡剂浓度过低,孔道不明显,但浓度也不宜过大,否则会导致微球整体结构塌陷。实验中采用5%的NH4HCO3制备得到的微球已有部分呈现坍塌状态。因此本研究选择了3%的发泡剂浓度,微球的整体和孔道结构均较为理想。
2.4.4 均质速度 固定PLGA浓度、发泡剂浓度和外水相PVA浓度,考察不同的均质速度对微球形态和包封率的影响,结果见表4和图4。
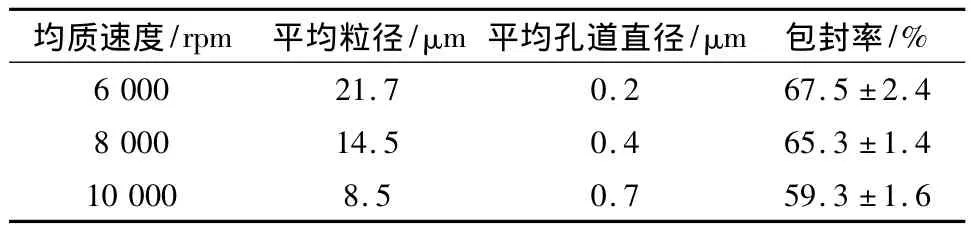
表4 均质速度的影响结果
结果显示,均质速度主要影响微球的粒径大小,均质速度越大,微球粒径越小。同时实验过程中发现,均质速度达到一定程度后,微球粒径的大小变化不明显。均质速度同时也影响表面孔道的形成,速度越快,发泡剂的发泡速度和气泡的逸出也越快,孔道因此越明显。
本研究主要以制备密度小于0.4 g·cm-3,平均几何粒径大于5.0 μm的微球粒子为目标,经后续相应参数的测定,选定均质速度为10 000 rpm。
2.4.5 外水相PVA浓度的影响 固定 PLGA浓度、发泡剂浓度和均质速度,考察不同的外水相PVA浓度对微球形态和包封率的影响,结果见表5。

表5 外水相PVA浓度的影响结果
结果表明,随着PVA浓度的增加,微球的粒径有减小趋势,但变化不明显;表面孔径影响不大,但也有减小的倾向。综合考虑,本研究确定外水相PVA的浓度为2%。
2.5 多孔RFP/PLGA微球的制备工艺确定 根据上述单因素考察结果,确定多孔微球的优化工艺条件如下:PLGA浓度为10%、发泡剂浓度为3%,均质速度为10 000 rpm,外水相PVA浓度为2%。将按上述条件制备的多孔微球进行相关参数的测定和体外释放行为的考察,结果见表6和图5。结果显示所制备的多孔微球具有较低的密度和适宜的空气动力学直径,有利于微球沉积于肺的较深部位,且微球具有较高的初始释放速率和持续释放能力。
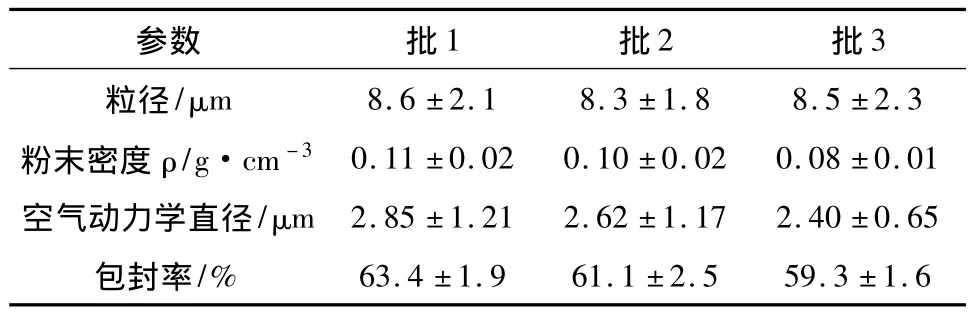
表6 多孔微球的相关参数
3 讨论
目前多孔PLGA微球的制备方法包括乳化溶剂扩散法、相分离法、喷雾干燥法、超临界流体技术等,其中以乳化溶剂扩散法最为常用。该法制得的微球形态圆整,粒径分布均匀,药物的包封效率高。在多孔微球的制备过程中常需加入致孔剂来形成微球的多孔结构,以NH4HCO3效果最佳,微球结构圆整,孔道结构明显且包封率较高。因此本研究选择NH4HCO3为发泡剂,乳化溶剂扩散法制备多孔PLGA微球。
吸入微球的空气动力学直径大小是影响药物在呼吸道及肺部的沉积的重要因素之一,是影响药效发挥的关键因素,常用质量平均空气动力学直径来表征。测定方法包括现代光学仪器法、飞行时间空气动力学粒径分布测定法和惯性撞击器法等[11]。其中惯性撞击器法利用惯性撞击的原理,按粒径大小将微球分级,能对空气动力学直径在不同大小范围内的微球予以定量,是目前最常用、最经典的方法。但其测定需要专用的撞击器,本研究因缺乏相应设备,采用了测定微球密度和粒径大小,再根据经验公式进行计算的方法进行代替[12]。空气动力学直径da=dg,其中ρ是实际粒子密度,dg是实际粒子的几何平均粒径。
目前肺吸入缓释制剂的释放曲线尚未有统一的标准,本研究在查阅文献的基础上[13-14],采用膜透析法考察了多孔微球的体外释放行为。具体操作为:取微球约20 mg,置透析袋中,加1 mL pH 7.4的PBS;将透析袋扎紧后置试管中,加入10 mL pH 7.4的PBS作为释放介质,37℃恒温振摇(100 r·min-1);定时取样10 mL,立即补充等量新鲜释放介质。样品经微孔滤膜过滤后HPLC分析,计算累积释放率并绘制释放曲线。结果显示多孔微球的初始释放速度较快,24 h可达60%左右,后续释放平缓。其原因可能是初始释放以扩散为主,多孔微球的比表面积大,释放快;后期以PLGA的生物降解为主,药物释放速度慢。这种释放行为即可使药物在靶部位快速达到有效浓度,又能缓慢释放药物,维持更长的作用时间。
[1]蔡鑫君,徐颖颖,张相彩.抗结核药肺部给药系统的研究进展[J].中国临床药学杂志,2010,19(5):325-328.
[2]缪志伟.抗结核药物所致不良反应发生情况及相关危险因素分析[J].安徽医药,2013,17(1):168-169.
[3]贾平平,余利岩,岑 山.抗结核一线药物及结核分枝杆菌的耐药分子机制[J].中国抗生素杂志,2011,36(7):487-491.
[4]Arnold MM,Gonnan EM,Schieber LJ,et al.NanoCipro encapsulation in monodisperse large porous PLGA microparticles[J].Journal of Controlled Release,2007,121(1/2):100-109.
[5]Ungaro F,Bianca R,Giovino C,et al.Insulin-loaded PLGA/cyclodextrin large porous particles with improved aerosolization properties:In vivo deposition and hypoglycaemic activity after delivery to rat lungs[J].Journal of Controlled Release,2009,135(1):25-34.
[6]Doana TV,Coueta W,Olivier JC.Formulation and in vitro characterization of inhalable Rifampicin-loaded PLGA microspheres for sustained lung delivery[J].International Journal of Pharmaceutics,2011,414(1/2):112-117.
[7]Edwards DA,Hanes J,Caponetti G,et al.Large porous particles for pulmonary drug delivery[J].Science,1997,276(5320):1868-1871.
[8]赵 趁,陈爱政,王士斌,等.超临界二氧化碳流体技术制备多孔微球研究进展[J].科学通报,2012,57(36):3459-3466.
[9]钦富华,胡 英,高建青.多孔PLGA微球的应用研究进展[J].广东药学院学报,2012,28(3):351-355.
[10]Oh YJ,Lee J,Seo JY,et al.Preparation of budesonide loaded porous PLGA microparticles and their therapeutic efficacy in a murine asthma model[J].J Control Release,2011,150(1):56-62.
[11]韩 飞,赵志冬,王跃生,等.肺部吸入制剂评价方法的研究进展[J].中国实验方剂学杂志,2012,18(11):303-306.
[12]陈 润,吴琼珠,平其能.肺部给药微粒研究近况[J].药学进展,2008,32(11):499-504.
[13]林 丽,黄 华,张 涛,等.伊潘立酮长效缓释微球的制备及体外释药特性研究[J].第三军医大学学报,2014,26(3):274-277.
[14]戎 堃,刘彬丽,李木子,等.不锈钢膜乳化法制备PLGA微球的初步研究与评价[J].中国中药杂志,2014,39(7):1229-1233.
