脱敏魔芋粉制备集成技术初探及其对魔芋粉理化性质的影响
2015-12-10孟凡冰王小燕范定涛
孟凡冰,王小燕,范定涛,钟 耕,3,4,*
(1.西南大学食品科学学院,重庆 400716;2.重庆西大魔芋科技开发有限公司,重庆 400700;3.西南大学食品科学与工 程国家级本科实验教学中心,重庆 400716;4.四川魔力科技有限公司,四川 绵阳 621000)
脱敏魔芋粉制备集成技术初探及其对魔芋粉理化性质的影响
孟凡冰1,2,王小燕1,范定涛1,钟 耕1,3,4,*
(1.西南大学食品科学学院,重庆 400716;2.重庆西大魔芋科技开发有限公司,重庆 400700;3.西南大学食品科学与工 程国家级本科实验教学中心,重庆 400716;4.四川魔力科技有限公司,四川 绵阳 621000)
为了有效脱除魔芋粉中的生物碱,从而扩大其应用范围,本研究开发出超微粉碎、酶处理、微波辅助乙醇萃取等集成技术。结果表明,魔芋粉目数在160目时,经过以上集成技术处理,其生物碱基本脱除干净,且处理后的魔芋粉溶胀性、亮度值相对于对照组有提高,黏度稳定性几乎不变。其形成的水凝胶网络结构稳定、抗剪切变形能力强。说明此技术可以用于制备脱敏魔芋粉,且还可以改善魔芋粉的部分理化性质。
魔芋粉;脱敏;技术集成;理化性质
魔芋(Amorphophallus konjac Koch)为天南星科(Araceae)魔芋属(Amorphophallus Blume)的多年生草本植物,其球茎中葡甘聚糖含量可达干质量的60%左右。魔芋葡甘聚糖是由葡萄糖和甘露糖以β-1,4-糖苷键连接起来的高分子多糖,也是水溶性的膳食纤维[1-3]。它以魔芋粉的形式存在,易吸水形成胶体,具有良好的亲水性、胶凝性、增稠性、黏结性、可逆性、悬浮性、成膜性和赋味性等。魔芋葡甘聚 糖食用后在胃中不被分解消化,而在肠道中被消化并能促进肠系酶类的分泌与活化,具有清理肠道、防止肥胖、提高耐糖力、改善胆固醇代谢等功效[4],是一种理想的低热、低脂肪物质。因此,魔芋葡甘聚糖在现代食品、医药、农业以及化工等领域有着广阔的应用前景。特别是魔芋葡甘聚糖良好的生物相容性、吸湿性、保水性和可降解性,不仅可以制成对皮肤有良好润滑和保湿作用的洗液、霜剂和面膜,而且其形成的面膜机械强度和舒适感明显优于其他的膜材料,深受广大消费者的喜爱[5]。然而,由于魔芋中存在能引起人们过敏反应的生物碱,利用未经过脱除生物碱的魔芋粉为原料生产的洗液、霜剂和面膜等产品对人体有引发过敏反应的危险[6-7]。虽然不是很普遍,且不同个体的反应程度也不一样,但已严重影响到了魔芋粉在日化和医药行业中的应用。
Tono等[8]的相关研究表明,采用常规的乙醇洗涤法并不能完全消除魔芋粉中的生物碱。因此,魔芋粉中生物碱的脱除还是一个技术难题。目前,多数研究集中在生物碱的分离和提纯[9],如龙德清[10]、杨海涛[7]等利用酸性醇回流和单纯微波提取的方法对生物碱进行提取,没有对生物碱脱除效果做具体验证。其他关于魔芋粉生物碱提取的文献报道,也没有对提取后魔芋粉性质变化进行研究。关于魔芋粉生物碱脱除具体技术的相关报道也只有本实验室钟耕等[11]的专利报道。本实验在此专利技术的基础上,进一步改进工艺,集成超微粉碎技术、酶处理技术、微波处理技术,以求更大程度上脱除生物碱,同时对其理化性质进行详细的检测分析,尽量不影响或者改善魔芋粉理化性质,以期为魔芋粉的工业化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
纯化魔芋微粉(符合NY/T 494—2010 《魔芋粉》对应项要求) 四川魔力科技有限公司;所使用化学试剂,除特殊说明外,均为分析纯;α-淀粉酶 上海如吉生物科技发展公司。
1.2 仪器与设备
SHB-Ⅲ循环水真空泵 郑州市博科仪器设备有限公司;HH-4数显恒温水浴锅 金坛市富华仪器有限公司;UV-2450紫外-可见分光光度计 日本Shimadzu公司;MAS-Ⅱ微波快速制样系统 上海新仪公司;DZF-6020真空干燥箱 海精宏实验设备有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;SIM-F140AY65制冰机 日本三洋公司;1-15 PK SIGMA冷冻离心机德国Sigma公司;DNJ-5S 上海越平科学仪器有限公司;Ultra Scan PRO测色仪 美国Hunter Lab公司;DHR-1TA流变仪 美国TA公司;WX-95 II型超微振动磨机 郑州粉碎机有限公司;DHG-9070A鼓风干燥箱上海齐欣科学仪器有限公司;FA2004A电子分析天平上海恒平科学仪器有限公司;PHS-3C pH计 上海盛磁仪器有限公司。
1.3 方法
1.3.1 超微粉碎处理
未经过超微粉碎但是能过80目筛的魔芋微粉样品分成两份,一份作为对照组,另一份置于振动磨机中,超微粉碎处理40 min。然后将样品经三次元振动筛筛分过滤,收集过120 目(120 目筛下物,160 目筛上物)、160目(160 目筛下物,200 目筛上物)、200 目(200 目筛的筛下物)经超微粉碎处理样品[7,12]。
1.3.2 α-淀粉酶酶解处理
经过前期预实验,160 目魔芋粉在葡甘聚糖含量、黏度、白度等方面测定值较好,本实验选择该粒度范围的魔芋微粉进行酶解处理,分析酶解对其性质影响。准确称取500 g 160 目筛样品于1 000 mL烧杯中,将配制好的1%酶液(酶活力为38.39 U/g魔芋粉)于喷壶中,均匀喷洒到魔芋微粉样品中并搅拌均匀,置于(60±5)℃的恒温水浴锅中,酶处理2.5 h,取出,微波灭酶后,在50 ℃的温度条件下,真空干燥4 h,研磨,过160 目筛,即得α-淀粉酶酶解处理样品[7,12]。
1.3.3 生物碱提取
将对照组样品、160 目未经酶处理和经1.3.2节处理的魔芋粉样品(约为400 g)分别放置于锥形瓶中,按照料液比1∶10,加入体积分数95%的乙醇(用2%盐酸调节pH 2~3左右),振荡摇匀,预浸泡一定时间。在温度50℃、功率300 W的条件下,微波辅助提取12 min。真空抽滤,滤渣重复提取3 次。然后,分别将3 种原料经过95%乙醇微波提取后的第3次生物提取液进行收集,蒸发浓缩至1 mL左右。即得生物碱提取浓缩液。用毛细管吸取适量的魔芋生物碱浓缩液,将其点样于预先活化的硅胶薄层层析板上。在层析缸中加入氯仿和甲醇体积比为9∶1的展开剂,用适量的氨蒸气饱和。然后将硅胶薄层层析板置于层析缸中,展开30 min后取出晾干。喷碘-碘化钾,显色观察[1,10]。以95%的乙醇溶液作空白对照。
1.3.4 不同方式处理后魔芋粉理化性质的测定
经过预实验验证,魔芋粉经过超微粉碎和α-淀粉酶处理,然后微波提取生物碱,有助于生物碱的浸出,但是对于魔芋粉经过处理后理化性质的改变还需要进一步进行实验验证,本部分就处理前后魔芋粉部分理化性质进行检测。
1.3.4.1 魔芋粉的溶解性
参照Du X uezhu等[13]的方法对比魔芋粉溶解性的变化,准确称取0.10 g(记为M)魔芋粉样品,将其溶于预先盛有24.90 mL碎冰的锥形瓶中,在0 ℃的冰浴条件下,剧烈搅拌大约1 h,直至碎冰完全融化。然后,在4 000 r/min的转速条件下,将样品溶液低温 冷冻离心20 min,分离可溶性和不溶性部分。称取10.00 g上清液于称 量瓶中,在105 ℃的温度条件下干燥直至质量恒定,称质量(记为m)。重复实验3 次,取平均值。根据以下公式计算溶解度:
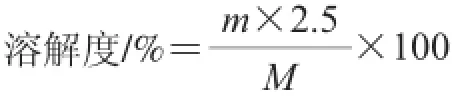
式中:m为10 g上层溶液中可溶性部分的质量/g;M为 魔芋粉样品的质量/g。
1.3.4.2 魔芋粉的溶胀性和黏度稳定性
参照行业标 准方法[14],准确称取1.00 g魔芋粉样品于烧杯中,加入蒸馏水,配制成质量分数1.0%溶液。在(30±0.5)℃的温度条件下,搅拌溶液,每10 min测定一次黏度,直到黏度达到最大值,即峰值黏度。以魔芋粉水溶液的黏度达到最大值所需时间评价魔芋粉的溶胀性。然后,每隔1 d测定1 次,连续测定7 次。黏度稳定性被定义为魔芋粉水溶液黏度维持相对稳定的持续时间[15]。
1.3.4.3 魔芋粉的色泽
将干燥的魔芋粉样品装入比色皿中,使用测色仪测定魔芋粉样品的亮度(L*)。重复实验5次,取平均值[16]。
1.3.4.4 魔芋葡甘聚糖含量的测定
按照NY/T 494—2010[14]描述的方法测定魔芋葡甘聚糖含量。
1.3.4.5 魔芋粉流变学特性的测定
准确称取1.00 g魔芋粉样品于烧杯中,加入预先冷却到0 ℃以下质量分数0.1%的KCl溶液中,配制成质量分数1.0%的魔芋粉溶液,磁力搅拌1 h,直至样品完全溶解。然后,在4 500 r/min的转速条件下,离心30 min,脱气。在动态黏弹性测定之前,将样品水溶液置于4 ℃的冰箱中平衡相同时间。
在应力变化为0.001~1 000 MPa范围内,频率为1 Hz,进行动态振荡实验,以确定线性黏弹性区域。在振荡模式条件下,线性黏弹性区域范围内进行动态振荡实验。在温度(25±0.1)℃、频率0.1~100 Hz范围条件下,进行动态频率扫描。在频率1 Hz、温度25~95 ℃范围条件下,进行动态温度扫描,升温和冷却速率为2.0 ℃/min[13,17]。 1.4 数据处理
所测数据结果表示为平均数±标准差(±s)形式。使用软件SPSS 20.0对数据进行方差分析。显著性检验为LSD、Duncan、Tukey honest检验,显著水平为P<0.05。
2 结果与分析
2.1 生物碱脱除实验
由图1可知,对照组经95%乙 醇微波提取后,浓缩液仍含有一定量的生物碱;经过超微粉碎不经过酶解的生物碱含量相对较少,但仍有少许生物碱未脱除;而经过超微粉碎结合α-淀粉酶作用后,乙醇微波提取液里的生物碱已经基本脱除干净。这可能是因为超微粉碎增加了原料的比表面积,从而更加利于生物碱的溶出[18]。而经过α-淀粉酶解处理后,包裹在生物碱外面的成分被分解,从而使生物碱更加容易被脱除干净[19]。

图 1 魔芋粉提取生物碱的硅胶薄层层析显色Fig.1 Thin-layer chromatography of alkaloids from konjac fl our on silica gel
2.2 不同方法处理后魔芋粉理化性质测定
2.2.1 魔芋粉溶解性测定
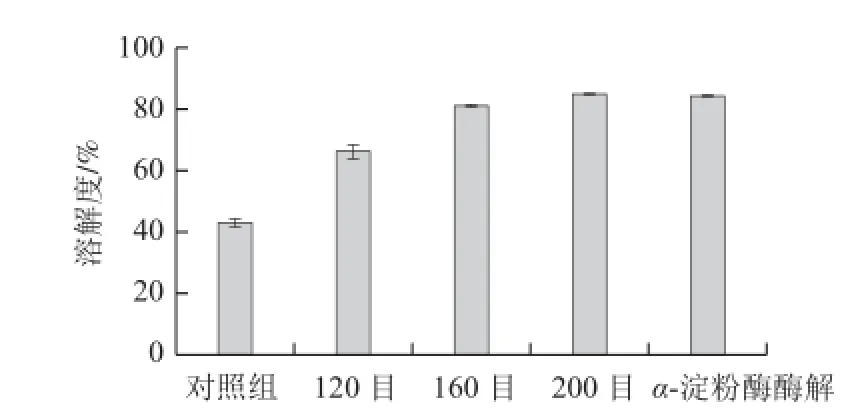
图 2 不同方法处理对魔芋粉溶解性的影响Fig.2 Effect of different treatments on the solubility of konjac fl our
由图2可知,魔芋粉经过超微粉碎处理后,与对照组相比,其溶解性显著提高。而且,魔芋粉经过超微粉碎后,其溶解性随粉碎目数的增加而逐渐增加,水平差异极显著(F=938.49,P<0.01)。当魔芋粉的粉碎目数达到200目时,其溶解度达85.32%,与对照组的43.03%相比,有了显著的提高。在超微粉碎过程中,由于机械力的作用,魔芋粉被粉碎成粒径更小的颗粒。从而导致表面能增加,比表面积增大,空隙率增加,活性点增多[20]。因此,具有良好的分散性和溶解性。
160目魔芋微粉经过α-淀粉酶酶解处理后,与未酶解的160目筛魔芋粉相比,溶解性也有了一定的提高。其溶解度从酶解处理前的80.98%提高到处理后的84.52%,水平差异显著(F=17.84,P<0.05)。因为魔芋微粉中除了含有魔芋葡甘聚糖外,还含有少量的淀粉。可能淀粉分子将魔芋葡甘聚糖包裹其中,在一定程度上会阻碍其有效利用,采用α-淀粉酶酶解处理使魔芋葡甘聚糖分子释放出来,另一个可能的原因是魔芋葡甘聚糖分子中含有大量游离的羟基,经过酶解处理后,更多的羟基可能暴露出来,与水中的氢键结合,溶解度增加。
2.2.2 魔芋粉溶胀性和黏度稳定性测定
在工业上,魔芋粉水凝胶的溶胀性和黏度稳定性是评价魔芋粉质量的重要指标。溶胀过程包括两个阶段:魔芋葡甘聚糖分子间氢键的断裂,以及魔芋葡甘聚糖分子与水分子之间氢键的重新建立[21]。
2.2.2.1 魔芋粉溶胀性测定

图 3 不同方法处理对魔芋粉溶胀性的影响Fig.3 Effect of different treatments on the swelling power of konjac fl our
由图3可知,魔芋粉经过超微粉碎处理后,与对照组相比,溶胀时间缩短,溶胀性有了一定的提高。溶胀时间从对照组的60 min缩短到120 目和160 目的40 min、200目的30 min。由于魔芋粉经过超微粉碎后,表面能增加,比表面积增大,空隙率增加,因此在水溶液中有更好的分散性。然而,当超微粉碎处理过度时,对其黏度有一定的影响。当超微粉碎目数达到200 目时,其黏度下降很快,仅为10 450 mPa•s。可能是由于超微粉碎过程中,魔芋葡甘聚糖分子由于温度升高和机械力的作用发生了降解,导致溶胀黏度下降。而魔芋微粉经过α-淀粉酶酶解处理后,与对照组相比,溶胀性提高,与未酶解160 目魔芋粉相比,其溶胀性几乎不变。
2.2.2.2 魔芋粉黏度稳定性测定

图 4 不同方法处理对魔芋粉黏度稳 定性的影响Fig.4 Effect of different treatments on the viscosity stability of konjac fl our
由图4可知,魔芋粉经过不同方法处理后,其黏度稳定性几乎没有发生变化。在2 d内,黏度变化不大,黏度稳定性良好。当放置时间超过2 d后,黏度开始下降,黏度稳定性降低。
2.2.3 魔芋粉颜色测定
由表1可知,魔芋粉经过超微粉碎处理后,其亮度较对照组有了显著地提高。随超微粉碎目数的增加,其亮度逐渐提高,水平差异极显著(F=503.119, P<0.01)。亮度值从对照组的72.87±0.43提高到200目条件下的81.13±0.11。一般情况下,粉末的亮度取决于粒径的大小,粒径小的粉末亮度通常高于粒径大的粉末[22]。魔芋微粉经过α-淀粉酶酶解处理后,与未酶解的160目魔芋粉相比,其亮度也有了一定的提高。其亮度值从酶解处理前的79.28±0.85提高到处理后的82.75±0.51,水平差异极显著(F=61.871,P<0.01)。

表 1 不同处理方法对魔芋粉颜色的影响Table 1 Effect of different treatments on the color of konjac fl our
2.2.4 魔芋粉中葡甘聚糖含量的测定
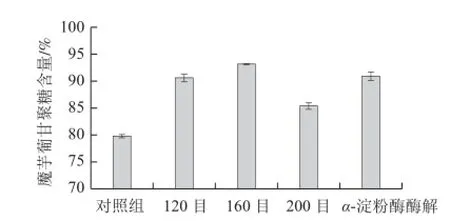
图 5 不同方法处理对魔芋葡甘聚糖含量的影响Fig.5 Effect of different treatments on the konjac glucomannan content
由图5可知,魔芋粉经过超微粉碎处理后,与对照组相比,魔芋葡甘聚糖的含量都有一定程度的提高。随超微粉碎目数增加,魔芋葡甘聚糖含量先增加后降低,水平差异极显著(F=529.126,P<0.01)。在160目时,魔芋葡甘聚糖的含量达到最大,为93.12%,而后又降低到200目的85.29%。可能是因为在超微粉碎处理前,魔芋葡甘聚糖分子以聚集态形式存在于魔芋球茎异细胞中,经过超微粉碎后,魔芋球茎异细胞由于受到机械作用力被破坏,大量的魔芋葡甘聚糖释放出来,故其魔芋葡甘聚糖含量增加。超微粉碎后,过筛目数再次降低时,导致魔芋葡甘聚糖含量降低原因可能是易粉碎杂质易过200目筛而减少了不易粉碎过筛的魔芋葡甘聚糖的比例。
魔芋粉经过α-淀粉酶酶解处理后,与酶解前160目魔芋粉相比,魔芋葡甘聚糖的含量由93.07%降低到90.93%。魔芋葡甘聚糖测定方法是将魔芋粉中的多糖经完全水解后测定单糖的含量,进而计算葡甘聚糖的含量。魔芋粉中除了含有葡甘聚糖外,还含有少量淀粉、膳食纤维等[23],魔芋粉经α-淀粉酶处理后,淀粉等多糖转化为单糖,在脱敏过程中这些单糖被去除,因此含有α-1,4-链多糖的存在会干扰测定结果,使得经α-淀粉酶酶解的魔芋粉中葡甘聚糖含量较未经酶解样品的葡甘聚糖含量低。
2.2.5 魔芋粉流变学特性测定

图 6 魔芋粉的应力-复合模量函数Fig.6 Complex modulus as a function of stress for konjac fl our
在工业生产中,魔芋粉的熔融流变学性质是选择加工设备和确定加工条件的重要参数。在进行动态流变学性质测定之前,首先要确定其线性黏弹性区域。在线性黏弹性区域范围内,复数弹性模量G*不随振荡应力或者应变的变化而变化[24]。在频率为1 Hz的条件下,应力扫描范围为0.001~1 000 Pa内进行动态应力扫描。由图6可知,采用不同方法处理,魔芋粉在应力为1.05~15 Pa范围内,复合模量是一个常数,即在线性黏弹性区域范围内。因此,设定应力为10 Pa,在此条件下,进行动态黏弹性实验。
2.2.5.1 频率对流变学特性的影响
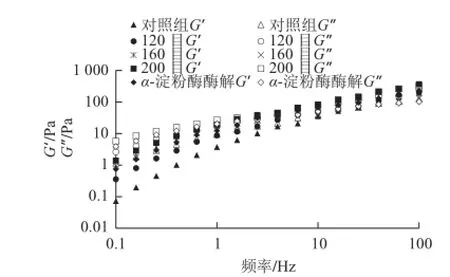
图 7 魔芋粉的剪切储存模量(G′)和损耗模量(G′′)随频率变化的函数关系Fig.7 Shear storage modulus G′ and loss modulus G′′ as a function of frequency for konjac fl our
由图7可知,随剪切振荡频率的增加,剪切储存模量(G′)和损耗模量(G′)都逐渐增加。在低剪切振荡频率时,魔芋粉水凝胶表现出非缠结的稀溶液,即G′<G″。因为低频率时,在相对较长的一个振荡周期内,魔芋粉水凝胶中魔芋葡甘聚糖分子缠结的网络结构解开有足够的时间。在高剪切振荡频率时,魔芋粉水凝胶表现类似固态,即G′>G′。在高振荡频率时,在相对较短的一个振荡周期内,魔芋粉水凝胶中魔芋葡甘聚糖分子解开的时间超过了分子重排的时间范围,魔芋葡甘聚糖分子间缠结的网络结构没有足够的时间解开,形成短暂的网络结构。
此外,魔芋粉经过超微粉碎处理后,与对照组相比,G′和G′都高于超微粉碎前,而且随着粉碎目数的增加,其G′和G′也在逐渐增加。表明随粉碎目数的增加,魔芋粉水凝胶形成的网络结构更稳定,抗剪切变形的能力更强。另外,随着粉碎目数的增加,魔芋粉水凝胶G′和G′的交叉频率逐渐降低。这与Du Xuezhu等[13]的研究报道相一致,表明随粉碎目数的增加,魔芋粉水凝胶的暂时网络结构增强。魔芋微粉经过α-淀粉酶酶解处理后,与未酶解的160目魔芋粉相比,G′和G′变化不大,表明魔芋微粉经过超微粉和α-淀粉酶酶解处理后,不同频率下其水凝胶形成的网络结构的稳定性升高了。
2.2.5.2 温度对流变学特性的影响

图 8 魔芋粉的剪切储存模量(G′)和损耗模量(G′′)随温度变化的函数关系Fig.8 Shear storage modulus G′ and loss modulus G′′ as a function of temperature for konjac fl our
由图8可知,随着温度的升高,G′和G′都降低。在较低温度时,剪切储存模量大于损耗模量(G′>G′);在较高温度时,剪切储存模量小于损耗模量(G′<G′),表明随温度的升高,凝胶的黏弹性降低,流动性增加。
据报道[7],氢键和疏水相互作用对凝胶多糖的网络结构的形成起着一定的作用,而且疏水相互作用对凝胶行为有着显著的影响。魔芋粉经过超微粉碎处理后,魔芋球茎异细胞由于机械力作用被破碎,大量的魔芋葡甘聚糖释放出来,与水分子之间氢键作用增强。从而,形成更稳定的网络结构。对于热可逆性聚合物凝胶而言,凝胶-溶胶转变临界温度被认为是一个重要的参数[25]。魔芋粉经过超微粉碎处理后,其水凝胶的凝胶-溶胶转变临界温度都有所降低,而且,随着粉碎目数的增加,凝胶-溶胶转变临界温度逐渐降低,即破坏魔芋粉水凝胶分子间的交联键所需的温度越低,表明随着粉碎目数的增加,魔芋粉水凝胶在较低温度条件下就能够形成凝胶。而魔芋微粉经过α-淀粉酶酶解处理后与对照组相比,剪切储存模量和损耗模量变化不大,表明魔芋微粉经过超微粉碎和α-淀粉酶酶解共同处理后,其水凝胶形成的网络结构对于温度稳定性变化不大。
3 结 论
魔芋粉经过超微粉碎处理和α-淀粉酶酶解后,再经95%乙醇微波辅助萃取生物碱,萃取3次后,可基本脱除生物碱。对比不同方法处理后的魔芋粉理化性质发现,160目魔芋粉经过α-淀粉酶酶解处理后,相对于对照组魔芋粉,其溶解性、溶胀性、葡甘聚糖含量和亮度值提高,黏度稳定性几乎不变。超微酶解后的魔芋粉,水凝胶网络结构在相同温度不同频率条件下稳定性较对照组提高,且随着温度的升高,稳定性变化不大。因此,超微粉碎和α-淀粉酶酶解后,对生物碱进行醇溶液微波脱除的方法,基本上能脱除生物碱,并且没有对魔芋粉的理化性质造成不利影响,具有一定的可行性。
[1] 钟刚琼, 盛德贤, 滕建勋, 等. 魔芋食品的开发利用与研究进展[J].食品研究与开发, 2005, 26(1): 106-108.
[2] 庞杰, 林琼, 张甫生, 等. 魔芋葡甘聚糖功能材料研究与应用进展[J].结构化学, 2003, 22(6): 633-642.
[3] LI Bin, XIE Bijun, KENNEDY J F. Retracted: studies on the molecular chain morphology of konjac glucomannan[J]. Carbohydrate Polymers, 2006, 64(4): 510-515.
[4] 谢建华, 庞杰, 朱国辉, 等. 魔芋葡甘聚糖功能研究进展[J]. 食品工业科技, 2005, 26(12): 180-183.
[5] ZHANG Yingqing, XIE Bijun, GAN Xin. Advance in the applications of konjac glucomannan and its derivatives[J]. Carbohydrate Polymers, 2005, 60(1): 27-31.
[6] 龙德清, 杨峰, 陈胜胜. 魔芋生物碱的初步分离及结构表征[J]. 应用化工, 2006, 34(12): 774-775.
[7] 杨海涛, 刘军海. 微波法提取魔芋中总生物碱工艺的研究[J]. 安徽农业科学, 2008, 36(3): 847.
[8] TONO T, FUJITA S, ITO T. Identifi cation of dopamine in the tubers of konjak (Amorphophallus konjac)[J]. Journal of Japanese Society of Food and Nutrition, 1974, 27(9): 467-470.
[9] 张志健, 梁引库. 魔芋加工下脚料中总生物碱提取技术研究[J]. 中国食品添加剂, 2011(1): 100-104.
[10] 龙德清, 丁宗庆, 谢茂军. 酸性醇回流法提取魔芋中的总生物碱研究[J]. 食品科学, 2003, 24(7): 87-89.
[11] 钟耕, 刘雅楠, 刘倍毓, 等. 消除魔芋粉中生物碱的方法: 中国, 201010192436[P]. 2010-10-27.
[12] GAO Shanjun, NISHINARI K. Effect of deacetylation rate on gelation kinetics of konjac glucomannan[J]. Colloids and Surfaces B: Biointerfaces, 2004, 38(3): 241-249.
[13] DU Xuezhu, LI Jing, CHEN Jian, et al. Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J]. Food Research International, 2012, 46(1): 270-278.
[14] 农业部种植司. NY/T 494—2010 魔芋粉[S]. 北京: 中国农业出版社, 2010.
[15] PAN Zhidong, MENG Junjie, WANG Yanmin. Effect of alkalis on deacetylation of konjac glucomannan in mechano-chemical treatment[J]. Particuology, 2011, 9(3): 265-269.
[16] TATIRAT O, CHAROENREIN S. Physicochemical properties of konjac glucomannan extracted from konjac flour by a simple centrifugation process[J]. LWT-Food Science and Technology, 2011, 44(10): 2059-2063.
[17] LIN Xiaoyan, WU Qiang, LUO Xuegang, et al. Effect of degree of acetylation on thermoplastic and melt rheological properties of acetylated konjac glucomannan[J]. Carbohydrate Polymers, 2010, 82(1): 167-172.
[18] 申玲玲, 杜光, 郭俊浩. 超微粉碎对中药活性成分溶出度的影响[J].中国医院药学杂志, 2011, 31(14): 1213-1214.
[19] 于敬, 周晶. 生物酶解技术在中药提取中的应用[J]. 现代药物与临床, 2010, 25(5): 340-344.
[20] 祁国栋, 张炳文, 张桂香, 等. 超微细处理对糯玉米淀粉加工特性影响的研究[J]. 食品科技, 2010, 35(3): 249-252.
[21] LI Long, RUAN Hui, MA Liuliu, et al. Study on swelling model and thermodynamic structure of native konjac glucomannan[J]. Journal of Zhejiang University-Science B, 2009, 10(4): 273-279.
[22] GALIBA M, WANISKA R D, ROONEY L W, et al. Couscous quality of sorghum with different kernel characteristics[J]. Journal of Cereal Science, 1988, 7(2): 183-193.
[23] 冲增哲. 魔芋科学[M]. 成都: 四川大学出版社, 1990: 142-143.
[24] GUNASEKARAN S, AK M M. Dynamic oscillatory shear testing of foods—selected applications[J]. Trends in Food Science and Technology, 2000, 11(3): 115-127.
[25] GAO Shanjun, GUO Jinming, WU Lili, et al. Gelation of konjac glucomannan crosslinked by organic borate[J]. Carbohydrate Polymers, 2008, 73(3): 498-505.
Preparation of Konjac Flour by Combined Use of Different Techniques and Its Physicochemical Properties
MENG Fanbing1,2, WANG Xiaoyan1, FAN Dingtao1, ZHONG Geng1,3,4,*
(1. College of Food Science, Southwest University, Chongqing 400716, China; 2. Chongqing Southwestern University Science and Technology Development Co. Ltd., Chongqing 400700, China; 3. National Undergraduate Experimental Demonstration Teaching Center of Food Science and Engineering, Southwest University, Chongqing 400716, China; 4. Sichuan Magic Technology Co. Ltd., Mianyang 621000, China)
In this study, we developed an integrated procedure using ultrafi ne grinding, α-amylase treatment and microwaveassisted extraction to prepare konjac fl our with expanded applicability by removing alkaloids. The results indicated that alkaloids could be removed almost completely from 160-mesh konjac fl our by the integrated methods. Compared with the control sample, the treated konjac flour had higher swelling ability and luminance value and also had a stable hydrogel network structure and a high ability of shear deformation resistance, but the viscosity stab ility almost remained constant. Therefore, this integrated procedure can be used to prepare alkaloid-free konjac flour with impr oved physicochemical properties.
konjac fl our; allergen removal; integrated technology; physicochemical property
TS219
A
1002-6630(2015)02-0063-06
10.7506/spkx1002-6630-201502012
2014-06-22
重庆市前沿与应用基础研究计划一般项目(cstc2014jcyjA80040);
重庆市“121”科技示范工程创新项目(cstc2014zktjccxyyB0022)
孟凡冰(1985—),女,博士研究生,主要从事现代食品加工理论与技术研究。E-mail:mfb1020@163.com
*通信作者:钟耕(1964—),男,教授,博士,主要从事粮油食品加工及天然产物开发研究。E-mail:gzhong@swu.cq.cn
