不同产地冬虫夏草的质量参数测定
2015-12-09丘雪红韩日畴
孙 超,丘雪红,曹 莉,韩日畴*
(1.安徽大学,合肥 230601;2.广东省昆虫研究所,广东省农业害虫综合治理重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
冬虫夏草Ophicordyceps sinensis 属于线性虫草菌科Ophiocordycipitaceae,是冬虫夏草真菌寄生在蝙蝠蛾科Hepialidae 昆虫中形成的菌核和子座复合物,在我国主要分布在甘肃、青海、四川、西藏、云南等省3000-5200 m 的高海拔地区 (Sung et al.,2007;Yue et al.,2013)。作为中国名贵的中药,冬虫夏草被证实具有抗氧化、抗菌、抗肿瘤和调节免疫等功效 (武忠伟等,2008;Yang et al.,2011;Mei et al.,2014;Wu et al.,2014)。
利益驱使不法商贩用混淆品代替冬虫夏草,造成市场混乱。性状和显微鉴别易观察,成为许多学者鉴别真假的手段(陈小秋等,2011)。冬虫夏草真菌的核糖体内部转录间隔区(international transcribed spacer,ITS)和蝙蝠蛾昆虫的细胞色素b序列(Cytochrome b,Cytb)在冬虫夏草复合体中保守,可用作为分子鉴定 (Rehner and Buckley,2005;Jiang and Yao,2005;Zhang et al.,2009)。
在冬虫夏草中的腺苷、肌苷、麦角甾醇、虫草酸和多糖等具有多种药理活性,可作为冬虫夏草质量评价的指标(Li et al.,2006)。Dong and Yao (2012)发现冬虫夏草发酵液具有较强的DPPH 自由基清除活性。Wu et al.(2007)证实冬虫夏草乙酸乙酯提取液对小鼠黑色素瘤细胞具有抑制作用。
陈婷等(2013)曾以冬虫夏草中腺苷、虫草素和麦角甾醇的含量评价不同产地冬虫夏草的质量。严冬和杨鑫嵎(2014)以氨基酸的含量评价不同产地冬虫夏夏草的质量。不同产地的冬虫夏草从形态上难以评价质量的优劣,单一的生化指标又不能全面反映其所体现的整体疗效 (Xiao et al.,2013)。
本文采用性状、显微和分子标记鉴别冬虫夏草样品,然后从冬虫夏草主要活性成分含量、抗自由基和抗癌细胞等方面测定不同产地冬虫夏草质量指标,为综合、科学评价冬虫夏草质量提供参考。
1 材料与方法
1.1 样品来源
本文所用的冬虫夏草样品分别采集于青海(玉树州)、四川(康定县)、西藏(当雄县)和云南(白马雪山)。
1.2 冬虫夏草鉴别
1.2.1 性状和显微鉴别
将冬虫夏草置于体视显微镜 (Olympus SZX16)下观察,拍摄记录头部、胸部、腹部和足等结构。将虫体浸润在清水中,虫体变软后,手持刀片刮取虫体的第5 腹节第1 小节的体壁和腹足,置于盖玻片上(康帅等,2013)。向盖玻片上滴加适量的水合氯化醛溶液,在50℃烘箱中加热10 min 至透明化。冷却后,滴加适量60% 甘油,加盖玻片,置于荧光显微镜(Nikon 80i)下观察,拍摄记录刺毛、刚毛、毛片、气门、腹足和趾钩等结构(王创新等,2013)。
1.2.2 分子鉴别
以Hipure Fungal DNA Kit (广州欣妍科技生物有限公司)分别提取样品子座和虫体的基因组DNA。采用真 通用引 ITS4 (5'-TCCTCCGCTTATTGATATG-3')和 ITS5 (5'-GGAAGTAAAAGTCGTAACAAGG-3')扩增样品子座的ITS 序列,PCR 扩增条件和方法参照毛雄明等(2013)。采用引物CB1 (5'-TATGTACTACCAT GAGGACAAATATC-3')和CB2 (5'-ATTACACC TCCTAATTTATTAGGAAT-3')扩增样品虫体的Cytb 序列,PCR 扩增条件和方法参照程舟等(2007)。PCR 产物经1.5%琼脂糖凝胶电泳检测后,送至北京华大基因公司测序。登陆NCBI 网站进行核苷酸序列比对与分析,进行相似性分析。
1.3 冬虫夏草活性成分含量测定
1.3.1 腺苷
称取0.5 g 样品粉末,加蒸馏水45 mL,超声波提取30 min。冷却后,定容至50 mL。在3000 rpm离心3 min,上清液经0.45 μm 滤膜过滤后供液相色谱分析用。色谱柱为C18柱(4.6 mm×150 mm,5 μm),柱温35℃。流动相为甲醇和0.01 mol/L 磷酸二氢钾溶液(10∶90,v/v),流速为1.0 mL/min,进样量为20 μL,检测波长为254 nm (Ikeda et al.,2008)。
1.3.2 肌苷
称取0.2 g 样品粉末,加20 mL 蒸馏水,超声波提取30 min。冷却后,定容至25 mL。在3000 rpm离心5 min,上清液经0.45 μm 滤膜过滤后供液相色谱分析用。色谱柱为C18柱(4.6 mm×150 mm,5 μm),柱温30℃。流动相为0.05 mol/L磷酸二氢钾溶液,流速为1.0 mL/min,进样量为20 μL,检测波长为254 nm (Ikeda et al.,2008)。
1.3.3 麦角甾醇
称取1.0 样品粉末,置于回流装置的150 mL三角瓶中,加入0.2 g 2,6-二叔丁基-4-甲基苯酚(BHT)、0.6 g 维生素C、2 g 焦性没食子酸和25 mL 甲醇,在80℃恒温水浴回流5 min。从冷凝回流管顶部加入5 mL 50%氢氧化钾溶液,继续回流30 min。冷却结束后,用正己烷过滤。用旋转蒸发器浓缩蒸干,残渣用4.0 mL 正己烷溶解,用0.45 μm 滤膜过滤,供高效液相色谱分析测定。色谱柱为 Inertsisil-100A 硅胶柱 (4.6 mm×250 mm,5 μm),柱温40℃。流动相为正己烷和异丙醇溶液(99∶1,v/v),流速为2.0 mL/min,进样量为10 μL,检测波长为282 nm (Yuan et al.,2007)。
综上所述,导师素质既直接影响研究生的学术水平,又通过影响研究生的学术感知力间接影响研究生的学术水平,本文所构建的理论模型如图1所示。
1.3.4 虫草酸
称取0.5 g 样品粉末,加蒸馏水45 mL,超声波提取30 min。冷却后,定容至50 mL。在3000 rpm离心3 min,上清液经0.45 μm 滤膜过滤后供液相色谱分析用。色谱柱为Prevail carbohydrate ES 糖柱(4.6 mm×150 mm,5 μm),柱温30℃。流动相为乙腈和蒸馏水(75∶25,v/v),流速为1.0 mL/min,进样量 5 μL (Ikeda et al.,2008)。
1.3.5 多糖
称取1.0 g 样品粉末,加5 mL 蒸馏水浸润样品,缓慢加入20 mL 无水乙醇。混匀后,超声提取30 min。在4000 rpm 下离心10 min,沉淀用10 mL 80%乙醇洗涤。用50 mL 蒸馏水将沉淀转移至圆底烧瓶中,在沸水中提取2 h。冷却至室温,将上清液转移至容量瓶中,加蒸馏水定容至100 mL。向1.0 mL 样品溶液中加入1.0 mL 苯酚溶液,然后快速加入5.0 mL 硫酸溶液,静置10 min。溶液液充分混合,将试管放置于30℃水浴中反应20 min,490 nm 测定吸光度值(阴婉婷等,2015)。
1.4 抗DPPH 自由基
称取1.0 g 样品粉末置于锥形瓶中,加入80 mL 甲醇,置于150 rpm、25℃摇床上摇匀1 h。滤纸过滤,收集上清液。残渣用40 mL 甲醇再提取一次,合并两次上清液。在40℃水浴中蒸发浓缩,用75%甲醇溶解提取物。在96 孔板中,每孔加6×10-5mol/L 二苯代苦味酰自由基溶液(DPPH)270 μL,75%甲醇提取物溶液30 μL,避光静止25℃反应30 min 后,在515 nm 波长下测定各孔吸光值。用BHT 作为阳性对照,DPPH 自由基清除率=[1-(A处理-A调零)/ (A对照-A调零)]×100%。其中,A处理表示孔板中有样品溶液和DPPH 溶液,A对照表示孔板中有DPPH 溶液,A调零表示孔板中只有75% 甲醇溶液。半数效应浓度(the half maximal inhibiting concentration,IC50)表示DPPH 自由基清除率为50%时样品中提取物的浓度(Reis et al.,2013)。
1.5 抗小鼠乳腺癌细胞(breast cancer)MT-1
在96 孔板中,每孔加入50 μL MT-1 细胞溶液,铺板使细胞密度至8000-10000 个/孔。5%CO2,37℃孵育,培养4 h 待细胞贴壁。加入浓度梯度的药物(将甲醇提取的样品有效物用二甲基亚砜DMSO 溶解),每孔50 μL,3 个复孔。5%CO2,37℃孵育44 h,倒置显微镜下观察。每孔加入40 μL 2.5 mg/mL 噻唑蓝(MTT)溶液,继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入150 μL DMSO,置摇床上低速振荡10 min。用酶联免疫检测仪在490 nm 波长下测量各孔的吸光值。用5-氟尿嘧啶(5-FU)阳性对照,癌细胞致死率=[1-(A处理-A调零)/ (A对照-A调零)]×100%。A处理表示孔板中有样品溶液、MT-1 细胞、细胞培养液 (dulbecco's modified eagle medium,DMEM)、MTT 和DMSO,A对照表示孔板中有细胞、相同浓度的药物溶解介质、DMEM培养液、MTT 和DMSO,A调零表示孔板中只有DMEM 培养液、MTT 和 DMSO (Wu et al.,2007)。
1.5 数据分析
不同产地冬虫夏草中活性成分的含量均用质量分数来表示,质量分数经以10 为底的对数函数处理;不同产地冬虫夏草DPPH 自由基清除率用半数效应浓度IC50表示;不同产地冬虫夏草对癌细胞致死率用百分数表示,百分数经开方、反正弦变换处理。以SPSS 16.0 进行方差分析,多重比较采用Tukey 检验,显著水平P<0.05。
2 结果与分析
2.1 冬虫夏草鉴别
对从青海、四川、西藏、云南采集的冬虫夏草样品进行性状和显微特征观察,发现头部、胸部、腹部、足、毛片和气门等结构与参考文献基本一致(陈小秋等,2011;Au et al.,2012;康帅等,2013)。不同产地样品子座的ITS 序列与GenBank 中冬虫夏草菌的ITS 序列相似度达到98%以上,样品虫体的Cytb 序列与GenBank 中蝙蝠蛾的Cytb 序列相似度达到98% 以上。综合以上结果,确定从青海、四川、西藏和云南采集的样品均为冬虫夏草。
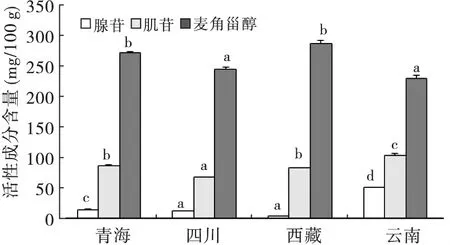
图1 不同产地冬虫夏草中腺苷、肌苷和麦角甾醇的含量Fig.1 The contents of adenosine,inosine and ergosterol of Ophiocordyceps sinensis from different origins
2.2 活性成分含量
在冬虫夏草中,虫草酸和多糖含量较高,其次是麦角甾醇,肌苷和腺苷的含量较少(图1 和图2)。不同产地冬虫夏草中,腺苷、肌苷、麦角甾醇、虫草酸和多糖的含量均存在显著性差异。虫草酸和多糖含量从大到小的产地依次是青海、西藏和云南(三者之间无显著性差异),四川;麦角甾醇含量从大到小的产地依次是青海和西藏,四川和云南;肌苷含量从大到小的产地依次是云南,青海和西藏,四川;腺苷含量从大到小的产地依次是云南,青海,四川,西藏。从测定的活性成分含量来看,云南和青海冬虫夏草的含量均较高,四川冬虫夏草的含量偏低。
2.3 抗DPPH 自由基
DPPH 自由基在甲醇溶液中呈现出深紫色,冬虫夏草具有清除DPPH 自由基等抗氧化能力,冬虫夏草甲醇提取液将DPPH 还原,并呈现出浅黄色或无色。通过酶标仪检测,能推断出DPPH 清除率,显示冬虫夏草的抗氧化活性。IC50值越小表示清除能力越强。不同产地冬虫夏草和BHT 的IC50存在显著性差异,其清除DPPH 自由基能力由大到小依次是BHT,云南和西藏(两者未呈现显著差异),以及青海和四川(两者未呈现显著差异)(图3)。
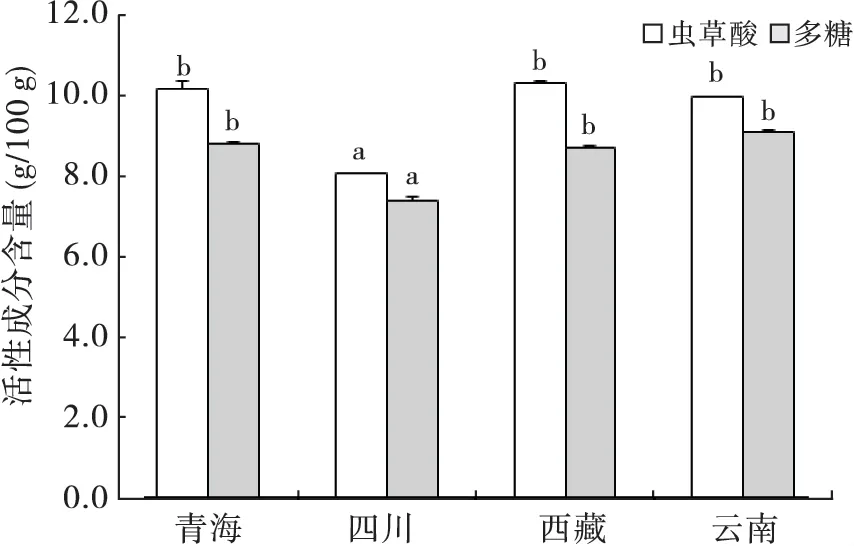
图2 不同产地冬虫夏草中虫草酸和多糖的的含量Fig.2 The content ofcordycepic acid and polysaccharide of Ophiocordyceps sinensis from different origins
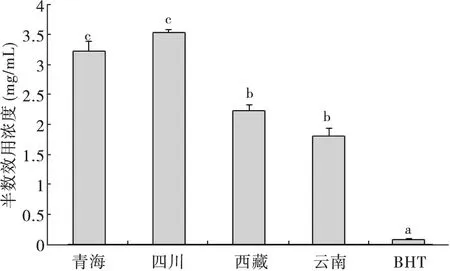
图3 不同产地冬虫夏草和BHT 清除DPPH 自由基的半数效应浓度IC50Fig.3 The half maximal inhibiting concentrations of the scavenging ability of BHT and Ophiocordyceps sinensis from different origins on DPPH
2.4 抗MT-1
MTT 作为一种黄色显色试剂,能被活细胞还原成水不溶性的蓝紫色结晶甲瓒,易溶于DMSO。通过酶标仪检测,能推断出细胞存活率,显示药物的抗癌活性。对抗癌药物5-FU 而言,不同产地冬虫夏草的甲醇提取液对癌细胞致死率的效果极差,致死率之间没有显著性差异(图4)。当冬虫夏草提取物浓度为400 μg/mL 时,对MT-1 致死率小于20%,说明甲醇提取物对MT-1 没有显著地抑制效果,其半数效应浓度IC50没有实际的意义。
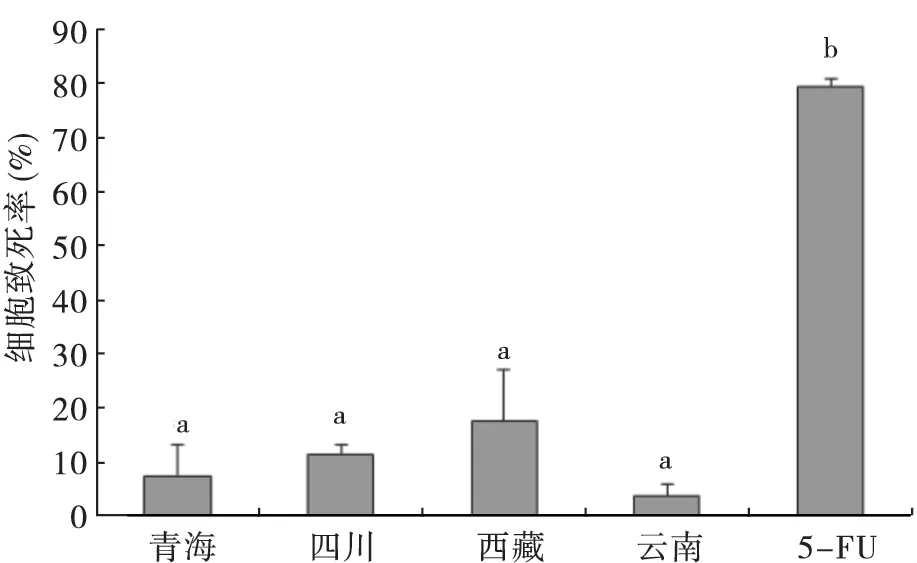
图4 不同产地冬虫夏和5-FU 在浓度为400 μg/mL 时对MT-1 的致死率Fig.4 The MT-1 death rates of 5-FU and Ophiocordyceps sinensis from different origins,at the concentration of 400 μg/mL
3 结论与讨论
尽管冬虫夏草市场上的产品真假难辨,但性状特征、显微特征和分子方法能验证。本研究从青海、云南、西藏、四川采集的样品均为冬虫夏草。
腺苷、肌苷、麦角甾醇、虫草酸和多糖5种活性物质在冬虫夏草内含量稳定,且具有多种药理作用。Li et al.(2002)测定冬虫夏草内的多糖含量为3-8 g/100 g。Yuan et al.(2007)测定冬虫夏草内麦角甾醇的含量为178.5-275.5 mg/100 g。李进等(2008)测定冬虫夏草中腺苷的含量为10-58 mg/100 g,肌苷的含量为73-189 mg/100 g。Wang et al.(2009)测定冬虫夏草内虫草酸的含量约为9 g/100。本次实验从青海、四川、西藏和云南采集的冬虫夏草中,腺苷、肌苷、麦角甾醇、虫草酸和多糖均存在显著性差异,虫草酸和多糖的含量较高,麦角甾醇的含量次之。如果仅从5种活性成分的含量评价,云南和青海冬虫夏草含量较高,四川冬虫夏草所测组分含量较低。
Pereiraet al.(2012)测定二十多种野生食用蘑菇的 DPPH 自由基清除率 IC50是0.86-20.02 mg/mL。Reis et al.(2013)测定蛹虫草中的DPPH 自由基清除率IC50是12.17 mg/mL。本次测定不同产地冬虫夏草的DPPH 自由基清除率IC50值均小于蛹虫草的IC50,冬虫夏草对DPPH 自由基的清除活性似强于蛹虫草。不同产地冬虫夏草的DPPH 自由基清除率存在显著性差异,西藏和云南的冬虫夏草清除DPPH 自由基活性较强。在冬虫夏草中,酚类化合物和多糖与自由基的清除有关(Li et al.,2003;Heleno et al.,2010)。
张巧霞等(2005)分别用乙酸乙酯、乙醇和水提取冬虫夏草,当提取物为浓度均为100 μg/mL时,对小鼠黑素瘤细胞的致死率分别为56.5%、21.6%和0.6%。本研究以甲醇从不同产地冬虫夏草中提取的活性物质对小鼠MT-1 抑制效果较弱,不同产地冬虫夏草之间不存在显著性差异。根据已知结果推断,非极性有机溶剂提取的活性物质的抗癌效果似优于极性大的溶液。在冬虫夏草中,腺苷和麦角甾醇被证明具有抗癌作用 (Fishman et al.,2002;张娴等,2011)。
本文对采集自青海、四川、西藏、云南的冬虫夏草进行形态和分子鉴定,分析5种主要活性成分的含量,测定抗DPPH 自由基和抗癌细胞活性,为综合评价冬虫夏草质量提供参考,有助于这一名贵资源的可持续利用。
References)
Au D,Wang L,Yang D,et al.Application of microscopy in authentication of valuable Chinese medicine I-Cordyceps sinensis,its counterfeits,and related products[J].Microscopy Research and Technique,2012,75 (1):54-64.
Chen Z,Geng Y,Liang HH,et al.Investigation of the phylogenetic relationship of the host of Cordyceps sinensis,Hepialus with mitochondrial Cytb gene sequences [J].Progress in Natural Science,2007,17 (8):1045-1052.[程舟,耿杨,梁洪卉,等.用线粒体Cytb 基因序列探讨冬虫夏草寄主蝠蛾的系统进化关系[J].自然科学进展,2007,17 (8):1045-1052]
Chen T,Liu Q,Mo ZK,et al.Determination of adenosine,cordycepin and ergosterol in Cordyceps sinensis by HPLC[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19 (6):161-163.[陈婷,刘群,莫灼康,等.HPLC 同时测定冬虫夏草中腺苷、虫草素和麦角甾醇[J].中国实验方剂学杂志,2013,19 (6):161-163]
Chen XQ,Liu BL,Zhao ZZ,et al.Studies on macroscopic and microscopic identification of Cordyceps sinensis and its counterfeits[J].China Journal of Chinese Materia Medica,2011,36 (9):1141-1144.[陈小秋,刘宝玲,赵中振,等.冬虫夏草与其混淆品的性状及显微鉴别研究[J].中国中药杂志,2011,36 (9):1141-1144]
Dong C,Yao Y.Isolation,characterization of melanin derived fromOphiocordyceps sinensis,an entomogenous fungus endemic to the Tibetan Plateau [J].Journal of Bioscience and Bioengineering,2012,113 (4):474-479.
Fishman P,Bar-Yehuda S,Madi L,et al.A3 adenosine receptor as a target for cancer therapy[J].Anticancer Drugs,2002,13 (5):437-443.
Heleno SA,Barros L,Sousa MJ,et al.Tocopherols composition of Portuguese wild mushrooms with antioxidant capacity[J].Food Chemistry,2010,119 (4):1443-1450.
Ikeda R,Nishimura M,Sun Y,et al.Simple HPLC-UV determination of nucleosides and its application to the authentication of Cordyceps and its allies[J].Biomedical Chromatography,2008,22 (6):630-636.
Jiang Y,Yao YJ.ITS sequence analysis andascomatal development of Pseudogymnoascus roseus[J].Mycotaxon,2005,94:55-73.
Kang S,Zhang J,Lin RC.Morphological and microscopic characteristics of Chinese caterpillar fungus [J].Acta Pharmaceutica Sinica,2013,48 (3):428-434.[康帅,张继,林瑞超.冬虫夏草的性状[J].药学学报,2013,48 (3):428-434]
Li J,Feng CQ,Ni XM,et al.Determination of nucleosides of natural Cordyceps sinensis in Qinghai province by capillary electrophoresis[J].Chinese Pharmaceutical Journal,2008,43 (14):1105-1107.[李进,冯成强,倪雪梅.毛细管电泳法测定青海不同产地冬虫夏草核苷类的含量[J].中国药学杂志,2008,43 (14):1105-1107]
Li SP,Su ZR,Dong TT,et al.The fruiting body and its caterpillar host of Cordyceps sinensis show close resemblance in main constituents and anti-oxidation activity[J].Phytomedicine,2002,9 (4):319-324.
Li SP,Zhao KJ,Ji ZN,et al.A polysaccharide isolated from Cordyceps sinensis,a traditional Chinese medicine,protects PC12 cells against hydrogen peroxide-induced injury [J].Life Science,2003,73 (19):2503-2513.
Li SP,Yang FQ,Karl WK,et al.Quality control of Cordyceps sinensis,a valued traditional Chinese medicine[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41 (5):1571-1584.
Mao XM,Zhao SM,Cao L,et al.The morphology observation of Ophiocordyceps sinensis from different origins [J].Journal of Environmental Entomology,2013,35 (3):343-353.[毛雄明,赵世明,曹莉,等.不同产地冬虫夏草无性型的形态观察[J].环境昆虫学报,2013,35 (3):343-353]
Mei YX,Yang W,Zhu PX,et al.Isolation,characterization,and antitumor activity of a novel heteroglycan from cultured mycelia of Cordyceps sinensis[J].Planta Medica,2014,80 (13):1107-1112.
Pereira E,Barros L,Martins A,et al.Towards chemical and nutritional inventory of Portuguese wild edible mushrooms in different habitats[J].Food Chemistry,2012,130 (2):394-403.
Rehner SA,Buckley E.A beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences:evidence for cryptic diversification and links to Cordyceps teleomorphs[J].Mycologia,2005,97 (1):84-98.
Reis FS,Barros L,Calhelha RC,et al.The methanolic extract of Cordyceps militaris (L.)link fruiting body shows antioxidant,antibacterial,antifungal and antihuman tumor cell lines properties[J].Food and Chemical Toxicology,2013,62:91-98.
Sung GH,Hywel-Jones NL,Sung JM,et al.Phylogenetic classification of Cordyceps and clavicipitaceous fungi[J].Study in Mycology,2007,57:5-59.
Wang CX,Chen B,Fu WB,et al.Mosquito specimens making technology[J].Journal of Chongqing Normal University (Natural Science),2013,30 (3):16-20.[王创新,陈斌,傅文博.蚊虫标本制作技术[J].重庆师范大学学报(自然科学版),2013,48 (3):428-434]
Wu DT,Meng LZ,Wang LY,et al.Chain conformation and immunomodulatory activity of a hyperbranched polysaccharide from Cordyceps sinensis[J].Carbohydrate Polymers,2014,110:405-414.
Wu ZW,Wang YB,Zhao XF,et al.Antibacterial activity of fermentation broth by Cordyceps sinensis and Cordyceps militaris[J].Journal of Microbiology,2008,28 (4):47-50.[武忠伟,王运兵,赵现方,等.冬虫夏草和蛹虫草发酵液抗菌活性研究[J].微生物学杂志,2008,28 (4):47-50]
Wang S,Yang FQ,Feng K,et al.Simultaneous determination of nucleosides,myriocin,and carbohydrates in Cordyceps by HPLC coupled with diode array detection and evaporative light scattering detection[J].Journal of Separation Science,2009,32 (23-24):4069-4076.
Wu JY,Zhang QH,Leung PH.Inhibitory effects of ethyl acetate extract of Cordyceps sinensis mycelium on various cancer cells in culture and B16 melanoma in C57BL/6 mice [J].Phytomedicine,2007,14 (1):43-49.
Xiao JH,Qi Y,Xiong Q.Nucleosides,a valued chemical maker for quality control in traditional Chinese medicine Cordyceps [J].Recent Patents on Biotechnology,2013,7 (2):153-166.
Yang ML,Kuo PC,Hwang TL,et al.Anti-inflammatory principles from Cordyceps sinensis[J].Journal of Natural Products,2011,74 (9):1996-2000.
Yin WT,Li T,Ma C.Determination of Polysaccharides in Cordyceps militaris link by improved phenol-sulfuric acid method [J].Journal of Anhui Agricultural Sciences,2015,43 (4):117-118.[阴婉婷,李彤,马辰.改良的苯酚-硫酸法测定蛹虫草多糖含量[J].安徽农业科学,2015,43 (4):117-118]
Yuan JP,Wang JH,Liu X,et al.Simultaneous determination of free ergosterol and ergosteryl esters in Cordyceps sinensis by HPLC[J].Food Chemistry,2007,105:1755-1759.
Yan D,Yang XY.Analysis of amino acid composition and evaluation of nutritional quality in Cordyceps sinensis from different regions of Tibet[J].Chinese Agricultural Science Bulletin,2014,30 (3):281-284.[严冬,杨鑫嵎.西藏不同产地冬虫夏草中氨基酸成分分析及其营养价值评价[J].中国农学通报,2014,30(3):281-284]
Yue K,Ye M,Zhou ZJ,et al.The genus Cordyceps:A chemical and pharmacological review [J].Journal of Pharmacy and Pharmacology,2013,65 (4):474-493.
Zhang X,Huang Y,Zeng X.Ergosterol inhibits HepG2 proliferation by inducing p21 expression[J].Pharmacology and Clinics of Chinese Materia Medica,2011,27 (5):26-29.[张娴,黄羽,曾星.麦角甾醇对肝癌细胞HepG2 增殖及p21 表达的影响[J].中药药理与临床,2011,27 (5):26-29]
Zhao QX,Liang BK,Wu JY,et al.Comparison of antitumor effect of extracts in cultivated Cordyceps sinensis fungus HK-1 and natural Cordyceps sinensis [J].Chinese Traditional and Herbal Drugs,2005,36 (9):1346-1349.
Zhang YJ,Xu L,Zhang S,et al.Genetic diversity of Ophiocordyceps sinensis,a medicinal fungus endemic to the Tibetan Plateau:implications for its evolution and conservation [J].BMC Evolutionary Biology,2009,9:290.
