刚竹叶提取物对斜纹夜蛾酚氧化酶抑制作用研究
2015-12-09徐广增刘守柱梁婷婷楚成茹潘立婷
徐广增,刘守柱*,梁婷婷,楚成茹,潘立婷,李 婷
(1.聊城大学农学院,山东聊城 252059;2.华南农业大学资源环境学院,广州 510642)
随着杀虫剂的广泛使用和数量的逐年增多,其持续选择压力逐渐增强,越来越多的昆虫对杀虫剂产生了抗性,到目前为止,已有600 多种昆虫及螨类对杀虫剂产生了抗性 (何书海等,2006)。昆虫的抗性主要分为代谢抗性和靶标抗性,代谢抗性指昆虫体内谷胱甘肽-S-转移酶、非专一性酯酶、细胞色素P450 氧化酶系等代谢、分解或转化外来有毒物质而产生的抗性;靶标抗性指昆虫体内的乙酰胆碱酯酶、γ-氨基丁酸受体和钠离子通道等靶标对杀虫剂敏感度降低而产生的抗性(王敦等,2006;周斌芬等,2008)。昆虫抗性的产生与增强,加大了农林业害虫防治的难度,新型农药的研制迫在眉睫,在昆虫体内寻找新的作用靶标可为新型农药的研发提供思路,而酚氧化酶即是最有希望的靶标之一。
酚氧化酶(PO,Phenoloxidase)广泛存在于动物、植物、微生物等有机体内,又称为酪氨酸酶(tyrosinase),是生物体内黑色素合成的关键酶(李国荣等,2003)。昆虫在生长发育过程中经历多次蜕皮现象,新形成的表皮颜色较浅且柔软,对外界环境及病毒微生物的抵抗力较弱,需在PO的催化作用下完成鞣化和黑化作用而使表皮变黑、变硬;当昆虫受到外来病原菌或寄生虫侵入时,体内无活性的酚氧化酶原 (prophenoloxidase,PPO)被激活转化为PO,催化产生黑色素与形成的包囊或结节将病原微生物消灭 (Clark and Strand,2013)。鉴于PO 在昆虫的免疫、防御系统中起着重要的作用,因而可以作为害虫控制的一个作用靶标。筛选对PO 具有强力抑制作用的化合物是开发以PO 为靶标的新型农药的有效途径。许多化合物对PO 具有较好的抑制作用,较多的是取代苯酸类,如:对羟基苯甲酸、硫脲等;极地与深海生境链霉菌产生的吲哚咔唑生物碱能够对菜青虫酚氧化酶具有一定的抑制作用和杀虫活性(王可等,2015);一些寄生蜂,如半闭弯尾姬蜂Diadegma semiclausum 寄生小菜蛾Plutella xylostella后也能有效抑制小菜蛾血淋巴中的酚氧化酶前体的激活(黄芳等,2011);此外,一些植物中的天然化合物对PO 也有抑制作用如:槲皮素、银杏叶提取物等(罗万春和薛超彬,2010),由于植物中的化合物是天然产物,对环境友好、易降解,符合无公害农业的发展潮流,因而从植物中提取、筛选PO 抑制剂有无可比拟的优势。
刚竹Phyllostachys viridis (Young)Mc Clure 是国内广泛种植的绿化植物,竹叶中含有多种复杂的次生代谢物,具有抗氧化、抗自由基、抗菌、抗病毒、抗衰老、降血脂等功能,且对蚜虫、棉铃虫、菜青虫等生长发育有一定的抑制作用,是我国新开发的一类天然植物资源,具有很高的研究价值 (操海群等,2003;赖炘和陈其兵,2013)。本文以斜纹夜蛾Spodoptera litura 幼虫酚氧化酶为靶标,研究了刚竹叶提取物对PO 的作用效果,以期为开发以PO 为靶标的环境友好型的农药提供理论支持。
1 材料与方法
1.1 供试材料
斜纹夜蛾虫源由华南农业大学提供,在人工气候养虫室内参照涂业苟等(2010)方法使用人工饲料继代饲养:室内温度25℃± 1℃,相对湿度60%±5%,光周期L∶D=14 h∶10 h,收集2-3 日龄的5 龄幼虫供试验用;刚竹叶采于聊城大学校园内。
1.2 试剂及仪器
本试验所用的试剂均为国产分析纯试剂,酶标仪为BIO-RAD;冷冻离心机为D-37520,美国赛默飞世尔科技公司产品。
1.3 方法
1.3.1 竹叶提取物的制备
将供试植物材料(刚竹叶片),用蒸馏水洗净,烘箱低温(50℃左右)烘干,然后用研钵研磨至粉末状,取粉末120 g,分别装入6 个锥形瓶中(各20 g),分别加入10 倍体积的不同极性的溶剂(极性大小:去离子水>乙醇>丙酮>乙酸乙酯>氯仿>石油醚),放置于恒温水浴锅中50℃加热2 h 后,倒入布氏漏斗中抽滤,残渣再加溶剂浸泡,连续浸泡3 次,合并滤液,在旋转蒸发器内减压浓缩至膏状,称重,按如下公式计算提取率:
提取率(%)=提取物干重(g)/植物干粉重(g)×100
粗提物置于4℃冰箱中保存,备用。
1.3.2 酶液的制备
取斜纹夜蛾5 龄幼虫,按1 g∶5 mL 的比例加入预冷处理的0.2 mol/L 磷酸缓冲液,冰浴匀浆,在4℃冰箱中静置30 min 后,4℃,8000 r/min 离心30 min,取上清液即为粗酶液。在制备的粗酶液中加入固体硫酸铵,边加边搅拌,使其饱和度达到30%,冰浴静置30 min 后,4℃,8000 r/min离心30 min,收集盐析后的沉淀物,将沉淀物用0.2 mol/L 磷酸缓冲液溶解,得到待测酶液。
1.3.3 酚氧化酶活力的测定
采用酶标仪法进行测定。在300 μL 测活体系中含有:0.2 mol/L 磷酸缓冲液(pH7.0),终浓度0.01 mol/L 邻苯二酚溶液,10 μL 酶制剂。活力测定:在420 nm 波长处测定2 min 内光密度随时间的增长曲线,每隔10 s 记录一次,从直线的斜率求得酶活力。酶活力单位U 定义为每mg 蛋白每10 s 催化底物氧化光密度增加0.001 为1 个活力单位。蛋白质含量的测定采用G-250 考马斯亮蓝法进行。每组试验均重复3 次。
1.3.4 二甲基亚砜与吐温80 对酚氧化酶活性的影响
将二甲基亚砜和吐温80 按体积比1∶1 混合,300 μL 测活体系中,先加入10 μL 酶液,再加入150 μL 不同终含量的二甲基亚砜和吐温80 (二甲基亚砜:吐温80=1∶1,总含量设置为:50%、25%、12.5%、6.25%、3.125%、1.5625%、0.78%、0.39%、0),室温下静置5 min,最后加入140 μL 终浓度为0.01 mol/L 的邻苯二酚溶液,按1.3.3 方法测定酶活力。与对照酶活力相比较,求得相对剩余活力,测定不同含量二甲基亚砜与吐温80 对酚氧化酶活性的影响。
1.3.5 竹叶提取物对酚氧化酶抑制作用测定
将不同溶剂提取的竹叶提取物用少量的二甲基亚砜和吐温80 (二甲基亚砜∶吐温80=1∶1,终含量1.5%)溶解后,加入pH7.0 的磷酸缓冲液稀释至2000 mg/L,备用。300 μL 测活体系中,先加入10 μL 酶液,再加入150 μL 不同终浓度的竹叶提取物(去离子水、乙醇、石油醚提取物终浓度分别 为1000、900、800、700、600、500、400、300、200、100 和0 mg/L;丙酮和三氯甲烷提取物终浓度分别为600、500、400、300、200、100 和0 mg/L;乙酸乙酯提取物终浓度为700、600、500、400、300、200、100 和0 mg/L),室温下静置5 min,最后加入140 μL 终浓度为0.01 mol/L的邻苯二酚溶液,按1.3.3 方法测定酶活力。各处理剩余酶活力与对照酶活力相比较,以对照酶活力为100,求得相对剩余活力,测定不同溶剂提取物浓度与酶剩余相对活力的关系,计算求出IC50。
1.3.6 竹叶提取物对酚氧化酶抑制效应的测定
取抑制效果最好的竹叶提取物 (丙酮提取物),在测活体系中,固定邻苯二酚的浓度,改变加入的酶量(分别为2、4、6、8、10 μL),测定不同提取物浓度 (终浓度分别为0、100、200、300、400、500 mg/L)下酶活力随加入的酶量变化的规律,以加入的酶量对酶剩余活力作图,判断提取物的抑制效应。
1.3.7 竹叶提取物对酚氧化酶抑制类型和抑制动力学参数的测定
取抑制效果最好的竹叶提取物 (丙酮提取物),在测活体系中,固定酶量(10 μL),改变邻苯二酚的浓度 (终浓度分别为0.5、1、2、4、8 mmol/L),测定不同提取物浓度(终浓度分别为0、100、200、300 mg/L)下酶活力随底物浓度变化的规律,以Lineweaver-Burk 双倒数作图法作图,比较提取物对表观米氏常数(Km)和最大反应速度(Vm)的影响,根据Km和Vm的变化规律判断抑制类型,并求得抑制常数Ki。
1.4 数据处理与分析
试验数据采用SPSS 软件进行单因素方差分析,计算标准误(SE,standard error)后,在图中以平均值± SE 来表示试验数据,显著水平P≤0.05。
2 结果与分析
2.1 竹叶不同溶剂提取率比较
采用温浸法制备了竹叶的6种不同溶剂(极性大小:去离子水>乙醇>丙酮>乙酸乙酯>氯仿>石油醚)的提取物,并通过旋转蒸发至粉末状,测得了不同溶剂提取物的提取率,结果表明:去离子水的提取率最高,可达30.17%,其次为乙醇,提取率为21.45%,石油醚的提取率最低,为1.28%,提取率有随溶剂的极性降低而降低的趋势(图1)。
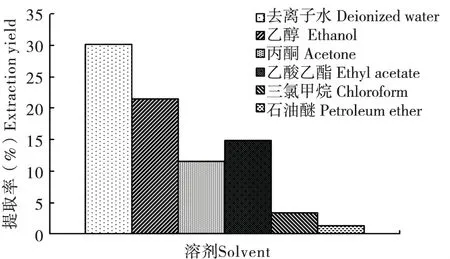
图1 竹叶的不同溶剂提取率Fig.1 The extraction yield of different solvents
2.2 二甲基亚砜与吐温80 对酚氧化酶活性的影响
由图2 可知,二甲基亚砜和吐温80 按体积比1∶1 混合后,当含量在0-3.125%范围内时对PO起激活作用,且随混合物含量的增加,激活作用先增加后降低;当含量大于3.125%时,对PO 起抑制作用,且随混合物含量的增加,抑制作用越来越强,当混合物含量达50%时,PO 相对剩余活性仅为11.75%,故在溶解植物提取物时应保证二甲基亚砜和吐温80 混合物含量在3.125%之内。
2.3 竹叶不同溶剂提取物对酚氧化酶活性的抑制作用
竹叶不同溶剂提取物对酚氧化酶的影响如图2:三氯甲烷提取物在0-300 mg/L 范围内,对PO表现为激活作用,当浓度大于300 mg/L 时,表现为一定的抑制作用;其他5种溶剂提取物在测定的范围内均对PO 表现为抑制作用,且随提取物浓度的升高,抑制作用有逐渐增强的趋势;在6种不同溶剂提取物中,丙酮提取物对PO 的抑制效果最显著,其IC50为550 mg/L,其次为乙酸乙酯提取物和乙醇提取物,其IC50分别为575 mg/L 和700 mg/L,其他3种溶剂提取物在可测的浓度范围内,对PO 的抑制效果均未达到50%。
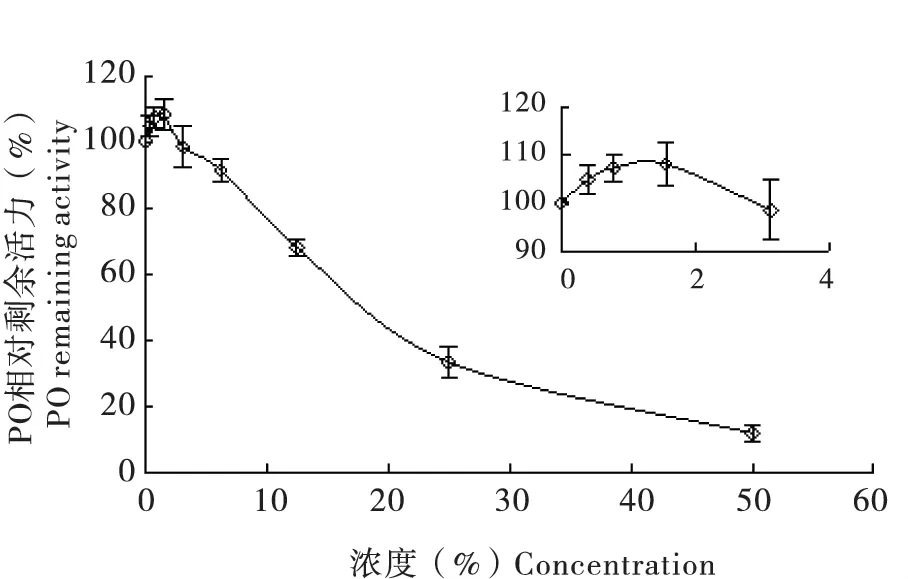
图2 二甲基亚砜与吐温80 对酚氧化酶活性的影响Fig.2 Effect of dimethyl sulfoxide and Tween 80 concentration on the activity of PO
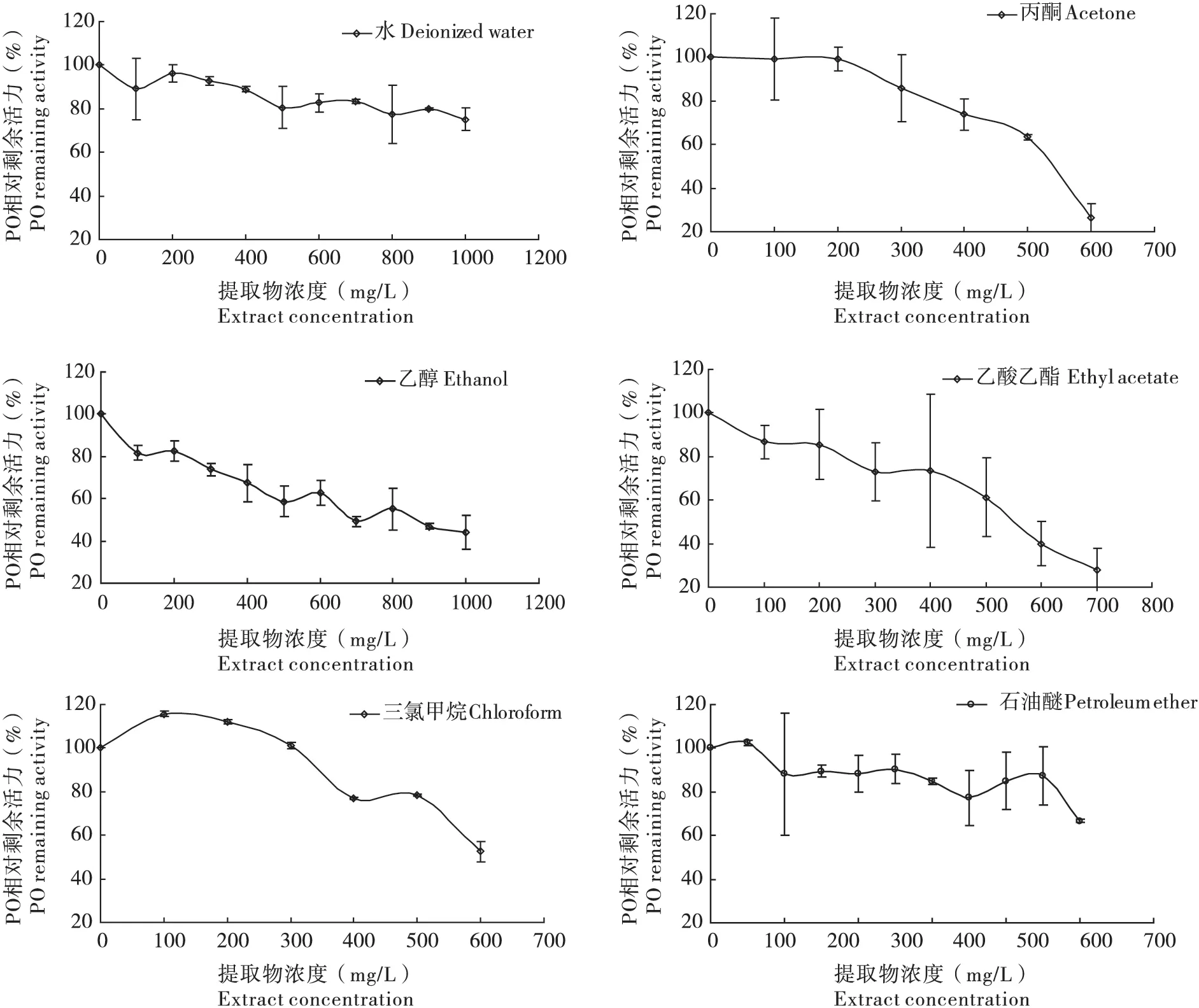
图3 不同溶剂提取物对斜纹夜蛾酚氧化酶活力的抑制作用Fig.3 The inhibition effect of different extracts against the PO activity from Spodoptera litura
2.4 丙酮提取物的酚氧化酶的抑制效应
在测活体系中,固定底物邻苯二酚的终浓度为10 mmol/L,加入不同浓度的丙酮提取物,然后改变加入的酶量,测定不同浓度的丙酮提取物对斜纹夜蛾酚氧化酶催化邻苯二酚氧化活力的影响。图3 表示PO 经丙酮提取物作用后的剩余酶活力与加入的酶量之间的关系,分别以酶活力对酶量作图得到一组过原点的直线,且随提取物浓度的增大,直线的斜率逐渐降低。此结果表明竹叶的丙酮提取物对PO 的抑制作用属于可逆过程。
2.5 竹叶丙酮提取物对酚氧化酶的抑制常数
在测活体系中,固定加入的酶量,改变底物邻苯二酚的浓度,测定不同浓度的丙酮提取物对PO 活力的影响,以Lineweaver-Burk 双倒数作图,得到一组与横轴交于一点直线(图4),说明丙酮提取物不改变米氏常数(Km),只影响最大反应速度(Vm),其抑制类型为非竞争性抑制。以不同浓度丙酮提取物条件下测定的1/Vm对提取物浓度作图(图5 内插图)得到一条直线,从直线的斜率求得抑制常数Ki为158.2 mg/L。
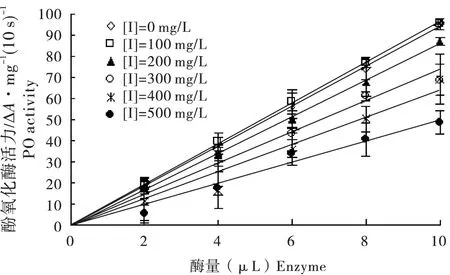
图4 不同酶液量对斜纹夜蛾酚氧化酶活力影响Fig.4 Effect of enzyme concentration on the activity of PO from Spodoptera litura at different concentration of acetone extract
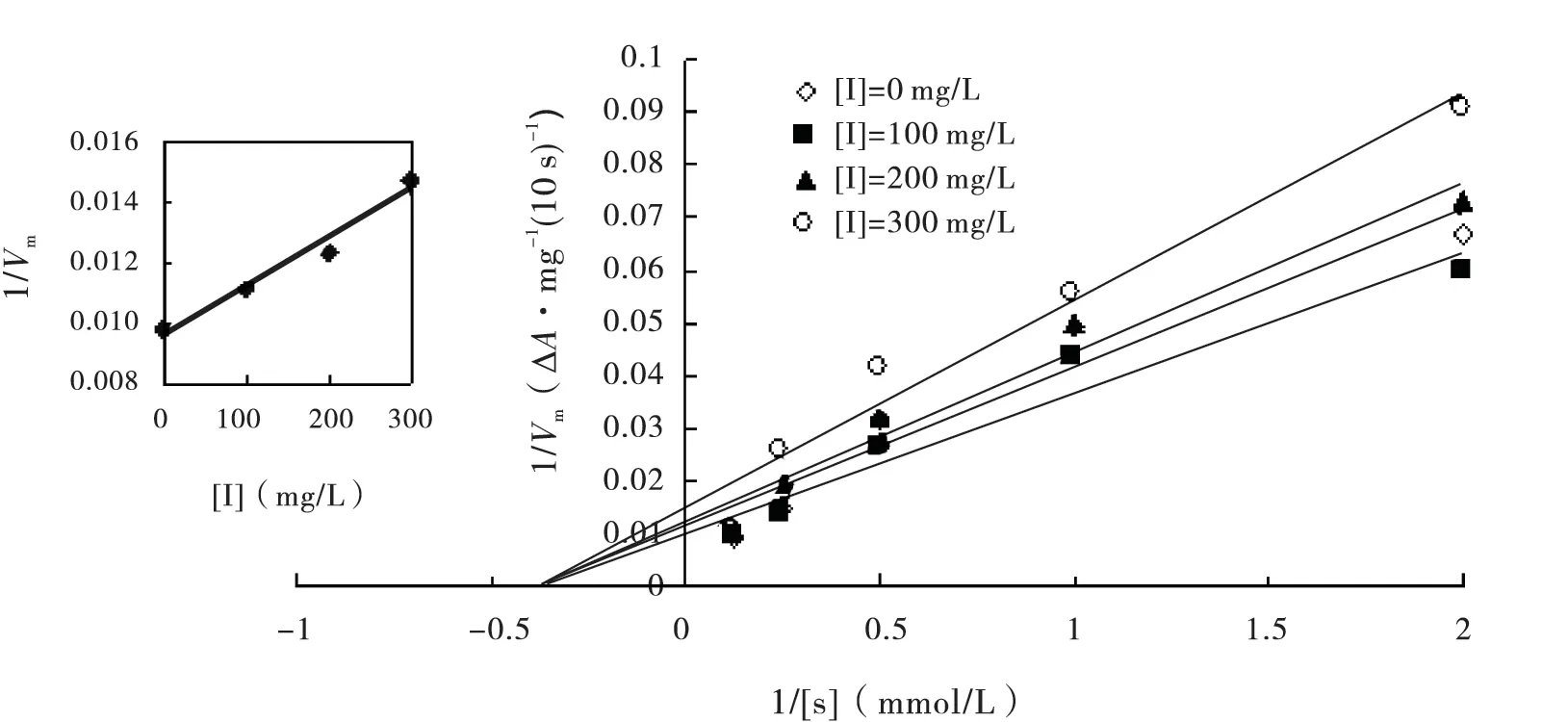
图5 丙酮提取物对斜纹夜蛾酚氧化酶的抑制作用Fig.5 Linerweaver-Burk plots for inhibition of acetone extract on the activity of PO from Spodoptera litura
3 结论与讨论
本实验测定了刚竹叶的不同溶剂提取物对PO的影响。溶剂的极性不同,所得提取物的主要成分不同,对PO 的影响存在较大的差异,但整体都表现为抑制作用(三氯甲烷提取物在0-300 mg/L范围内,对PO 表现为激活作用)。其中,丙酮提取物对PO 的抑制作用最强,IC50为550 mg/L,其次为乙酸乙酯提取物和乙醇提取物,其IC50分别为575 mg/L 和700 mg/L,而去离子水和石油醚提取物对PO 抑制作用较弱,在0-1000 mg/L 范围内抑制率低于40%。随溶剂极性的降低,所得的提取物对PO 的抑制效果先升高后降低。实验测得的刚竹提取物对PO 的IC50高于其他化合物,如7,4'-三羟基黄酮和槲皮素对菜青虫PO 的IC50分别低至25.65 mg/L 和43.94 mg/L (薛超彬,2007),说明本实验所得刚竹提取物的抑制效果不如已知纯品化合物。分析原因,主要是本实验所用的是粗提物,含有大量杂质,也可能含有一些具有激活作用的成分,通过测定34种不同采集地的竹叶提取物对酚氧化酶的抑制作用,发现有16种存在抑制作用,但不同采集地抑制效果存在差异,其他18种竹提取物对酚氧化酶则存在一定的激活作用(张永兵,2009),故本试验所得竹叶粗提取总体表现对PO 的抑制作用不是很强。
以邻苯二酚为底物,研究了刚竹的丙酮提取物对PO 的抑制效应,结果表明:其抑制效果属于可逆过程,抑制类型为非竞争性抑制,但抑制常数较高,Ki为158.2 mg/L,主要原因依然是提取物纯度不够。刚竹提取物中含有多种成分,主要包括:黄酮及其苷类、多糖类、特种氨基酸及其肽类、芳香成分及多种微量元素(何跃君和岳永德,2008)。提取物具有较强的抗氧化和去除自由基作用,能够有效的拮抗氧对PO 的激活作用;同时,可以清除过氧负离子、氢氧基和氧原子自由基等(酚氧化酶活性中心的桥联配体,与PO 的活性有密切关系),从而终止自由基链的发生,降低PO 的活性(赖炘和陈其兵,2013)。因而,刚竹提取物对PO 的抑制不是单一成分的作用,而是多种成分的综合表现,其抑制机理较为复杂,需进一步提纯以后才能最终确定。
不同品种的竹叶提取物对PO 活性的抑制效果存在差异:张永兵(2009)曾探究了34种竹叶提取物对络氨酸酶的影响,抑制效果较强的为毛环竹、翠竹、高节竹和阔叶箬竹,并对箬竹的活性成分进行了分离鉴定,其活性成分主要是对羟基肉桂酸乙酯;王文文等(2010)测定了不同品种、不同季节竹笋醇提取物对络氨酸酶单、双酚酶活力的抑制作用,发现麻竹笋肉醇提取物抑制活性较高,且不同提取物间对PO 抑制活性差异较大。
许多研究表明,植物提取物中的黄酮类物质,如:芹菜素、曲酸、木犀草素等,及鼠鞠草素、对羟基苯甲酸、槲皮素、山奈素、芦丁、枯醛、枯酸、杨梅黄素和蛇葡萄素等都可以作为酚氧化酶的抑制剂,对PO 都有较强的抑制作用(罗万春和薛超彬,2010)。植物源的PO 抑制剂成分多种多样,虽然抑制能力强弱不同,但由于其本身是天然化合物,对环境友好、易降解,兼之资源丰富,因而具有广阔的应用前景。
农药的研发技术已经由传统的随机筛选、类推合成、天然产物模板发展到了生物合理设计阶段,对昆虫、病原物等的生命活动具有重要作用的酶以及酶促反应是研究的重要靶标。生物合理设计是研究开发新型农药的有效途径,如以几丁质合成酶(CS,Chitin synthase)为靶标,已开发出两大类能够破坏几丁质合成的抑制剂农药,一类是核苷肽类,包括多氧霉素(polyoxin)、三国霉素(nikkomycins)等(Hans,2006),能够通过抑制几丁质合成酶来干扰真菌细胞壁的形成,具有较高的抗菌活性;另一类是酰基脲类,包括除虫脲、灭幼脲、氟虫脲等(杨化恩等,2007;赵新筠等,2003),此类杀虫剂安全、高效且高选择,能够合理、有效的控制害虫。
同几丁质合成酶类似,PO 也是昆虫生长发育过程中必不可少的关键酶,在昆虫生长发育的各个时期都需要一定量的PO 来协调完成生理、形态等变化;PO 也是昆虫免疫、防御系统的重要组成部分,可作为害虫控制的一个作用靶标,通过抑制昆虫酚氧化酶的活力,使害虫丧失防御能力从而间接达到合理控制虫害的目的(罗万春和薛超彬,2010)。因而,酚氧化酶抑制剂有可能成为继几丁质合成酶抑制剂之后一类新的对环境友好的害虫抑制剂。
References)
Cao HQ,Yue YD,Peng ZH,et al.Bioactivities of extracts from bamboo to Lipaphis erysimi[J].Plant Protection,2003,29 (2):33-36.[操海群,岳永德,彭镇华,等.竹提取物对蚜虫生物活性的研究[J].植物保护,2003,29 (2):33-36]
Cao HQ,Yue YD,Peng ZH,et al.Antifeedant activity of the extracts from bamboo against Helicoverpa armigera and Pieris rapae[J].Chinese Bulletin of Entomology,2005,42 (2):171-174.[操海群,岳永德,彭镇华,等.竹提取物对棉铃虫幼虫及菜青虫的拒食活性[J].昆虫知识,2005,42 (2):171-174]
Clark KD,Strand MR.Hemolymph melanization in the silkmoth Bombyx mori involves formation of a high molecular mass complex that metabolizes tyrosine[J].Journal of Biological Chemistry,2013,288 (20):14476-14487.
Hans M.Insect chitin synthases:A review[J].Journal of Comparative Physiology B,2006,176 (1):1-15.
He SH,Han BJ,Peng LX.Research progress on 1nsect resistance to pesticides and development of new pesticides[J].Chinese Journal of Tropical Agriculture,2006,26 (5):75-80.[何书海,韩丙军,彭黎旭.昆虫抗药性研究进展及其新农药开发对策[J].热带农业科学,2006,26 (5):75-80]
He YJ,Yue YD.A review of the effective component and applications of extracts from bamboo leaves[J].Biomass Chemical Engineering,2008,42 (3):31-38.[何跃君,岳永德.竹叶提取物的有效成分及其应用研究进展[J].生物质化学工程,2008,42 (3):31-38]
Huang F,Shi M,Chen XX,et al.Effect of parasitism by Diadegma
semiclausum on the humoral immune system of the diamondback moth larvae,Plutella xylostella[J].Journal of Environmental Entomology,2011,33 (2):154-158.[黄芳,时敏,陈学新,等.半闭弯尾姬蜂寄生对寄住小菜蛾幼虫体液免疫的影响[J].环境昆虫学报,2011,33 (2):154-158]
Lai X,Chen QB.The research progress of chemical composition and physiological function of extract of bamboo leaves[J].J.of Fujian Forestry Sic.and Tech.,2013,40 (1):214-220.[赖炘,陈其兵.竹叶提取物的化学成分及其生理功能研究进展[J].福建林业科技,2013,40 (1):214-220]
Li GR,Zhang SC,LiHY,et al.Advance on the study of Phenoloxidase I:Properties,functions,distribution and change during embryonic stage[J].Marine Sciences,2003,27 (4):4-8.[李国荣,张士璀,李红岩,等.酚氧化酶研究概况Ⅰ-特性、功能、分布和在胚胎发育中的变化[J].海洋科学,2003,27 (4):4-8]
Luo WC,Xue CB.Phenoloxidase of Insect and its Inhibitors [M].Beijing:Science Press,2010,1-19.[罗万春,薛超彬.昆虫酚氧化酶及其抑制剂[M].北京:科学出版社,2010,1-19]
Tu YG,Zeng JH.A method for artificial rearing of common cutworm,Spodoptera litura[J].Acta Agriculturae Jiangxi,2010,22 (1):87-88.[涂业苟,曾吉华.斜纹夜蛾的人工饲养技术[J].江西农业科学,2010,22 (1):87-88]
Wang D,Tang ZH,Shang JY,et al.Advances in the studies of acetylcholinesterase from insects[J].Acta Entomologica Sinica,2006,49 (3):497-503.[王敦,唐振华,尚金燕,等.昆虫乙酰胆碱酯酶基因研究进展[J].昆虫学报,2006,49 (3):497-503]
Wang K,Zhang JM,Shi ZP,et al.The insecticidal activity and mechanism of Indolocarbazole alkaloid of Streptomyces isolated from Arctic deep sea[J].Journal of Environmental Entomology,2015,37 (1):85-89.[王可,张久明,史振平,等.极地与深海生境链霉菌产生的吲哚咔唑生物碱杀虫活性及作用机理初探[J].环境昆虫学报,2015,37 (1):85-89]
Wang WW,Yuan Y,Wu JW.Effects of ethanol extracts from bamboo shoot on activity oftyrosinase[J].Jiangsu Academy of Agricultural Sciences,2010,26 (6):1197-1200.[王文文,袁艺,武静文.竹笋醇提取物对络氨酸酶活力的影响[J].江苏农业学报,2010,26 (6):1197-1200]
Xue CB.Kinetics Inhibition and Quantitative Structure-activity Relationship (QSAR)Studies of Phenoloxidase Inhibitors on Pieris rape (L.)[D].Taian:Shandong Agricultural University,2007,56-76.[薛超彬.菜青虫酚氧化酶抑制剂的抑制动力学及其构效关系(QSAR)研究[D].泰安:山东农业大学博士学位论文,2007,56-76]
Yang HE,Liu SZ,Li YZ,et al.Chitin synthase from insects and its inhibitions[J].Chinese Bulletin of Entomology,2007,44 (5):769-773.[杨化恩,刘守柱,李友忠,等.昆虫几丁质合成酶及其抑制剂[J].昆虫知识,2007,44 (5):769-773]
Zhang YB.Effect of Extracts from Bamboo Leaves on the Tyrosinase and Melanoma Cells [D].Beijing:Chinese Academy of Forestry,2009,21-74.[张永兵.竹叶提取物对络氨酸酶和黑色素瘤细胞的影响[D].北京:中国林业科学研究院,2009,21-74]
Zhao XY,Zhang ZW,Wang YG.Biological activities and synthetic methods of acyl urea compounds[J].Chemistry,2003,11:784-788.[赵新筠,张正文,汪焱钢.酰基脲类化合物的生物活性及合成方法[J].化学通报,2003,11:784-788]
Zhou BF,Tang ZH,Gao JF.Advances in metabolic resistance to insecticides in insects[J].Agrochemicals,2008,47 (5):313-315.[周斌芬,唐振华,高菊芳.昆虫代谢抗性的研究进展[J].农药,2008,47 (5):313-315]
