黑皱鳃金龟甲壳素提取工艺研究
2015-12-09张建英杨贵军石晓莉
张建英,贾 龙,杨贵军,石晓莉
(1.宁夏大学生命科学学院,银川 750021;2.宁夏大学农学院,银川 750021)
黑皱鳃金龟Trematodes tenebrioides (Pallas)又名无后翅金龟子,隶属于鞘翅目Coleoptera 鳃金龟科Melolonthidae (章有为,1979)。黑皱鳃金龟是世界范围内的一大地下害虫,为害多种作物和牧草(乌宁等,2002;刘新民和乌宁,2004),主要分布于包括我国在内的古北区国家或地区(张林林等,2012)。成虫体中型,长15.0-16.0 mm,宽6.0-7.5 mm,黑色无光泽,刻点粗大而密,鞘翅卵圆形,具大而密排列不规则的圆刻点,后翅退化仅留痕迹,略呈三角形(章有为,1979)。成虫为害幼苗茎、叶,喜食灰菜、刺儿菜及荧菜等野生植物,也是甘草的地下害虫。幼虫除主要为害高粱、玉米、大豆、花生(曲明静等,2011)、土豆(郭成瑾等,2012)、小麦、棉花等作物,啮食幼苗地下茎和根部,使幼苗滞长、枯黄、全株枯死;幼虫也是内蒙古典型草原大型土壤动物的优势种,起着分解动植物残体和牧畜粪便,分解转化有机质和矿物质的重要作用。
甲壳素又名甲壳质、几丁质等,是自然界中唯一带正电荷的天然高分子聚合物,化学名称为(1,4)-2-乙酰氨基-2-脱氧-β-D-葡聚糖(王敦等,2004;刘高强等,2007)。主要存在于甲壳动物外壳、软体动物内骨骼、昆虫表皮、菌类及藻类等微生物的细胞壁中(王金华和干信,2003)。每年地球上的生物合成量约为100 亿吨,是产量仅次于纤维素的第二大可再生资源,也是除蛋白之外数量最大的含氮天然有机高分子(李维莉和林南英,1999;王敦等,2004;阳范文和陈晓明,2012)。甲壳素具有非常优秀的再生能力,其化学结构和植物纤维素非常相似,具备特殊的理化性质,天然无毒、组织相容性良好、可生物降解,其开发应用已涉及工业、农业、国防、化工、环保、食品、医药、保健、美容、纺织等诸多领域(施林妹等,2013;王月等,2013)。目前甲壳素的生产方法主要有酸碱法(张雪和王雪涛,2007;唐义宝和谢晶,2012)、酶法(段元斐等,2007)、电解法(贺淹才等,2000)、发酵法(周湘池等,2008)、EDTA 法(何兰珍等,2008)等。通过前人从蝇、蚕等一些虫种中提取甲壳素的研究发现,昆虫中甲壳素含量比较高,钙和重金属含量低,杂质少,纯度高,质量好,提取过程中对水、酸、碱消耗少,生产成本低。因此,昆虫甲壳素要优于虾、蟹甲壳素,开发新的甲壳素资源具有重要的意义,而资源量大、种类多的昆虫正是潜在的甲壳素来源。据估算昆虫的总生物量超过了地球上所有动物总生物量,适应能力和分布范围都超过了其它动物群,但被人类利用的昆虫资源却很少,只占昆虫种类的万分之一左右,因而昆虫甲壳素资源是有待开发的优势资源(吉惠杰和马艳丽,2012)。
目前国内已有蚕蛹、蜣螂、蟋蟀等昆虫中甲壳素的提取报道,但有关甲虫中甲壳素资源的开发信息甚少。因此,本试验拟以黑皱鳃金龟为材料,采用酸碱法研究甲壳素的提取工艺。
1 材料与方法
1.1 材料
1.1.1 试验材料
黑皱鳃金龟成虫干粉,成虫采自内蒙古乌审旗。样品预处理:洗净→烘干(60℃)→研磨→过筛→黑皱鳃金龟干粉。
1.1.2 主要仪器及用具
电热恒温鼓风干燥箱,上海一恒科技有限公司;电热恒温水浴锅,北京长源实验设备厂;紫外可见分光光度计,北京普析通用仪器有限责任公司;电子分析天平,梅特勒-托利多仪器(上海)有限公司;马弗炉sx4-10,深圳市中达电炉厂;红外光谱仪,德国布鲁克;低速台式离心机上海安亭科学仪器厂;PH 计,梅特勒-托利多仪器(上海)有限公司;研钵;称量瓶;三角瓶等。
1.1.3 主要试剂
柠檬酸(分析纯)、氢氧化钠(分析纯)、标准甲壳素样品(美国进口C9752-250MG)、高锰酸钾(分析纯)、草酸(分析纯)、蒸馏水(水洗使用)。
1.2 方法
试验利用酸浸碱煮法,首先,通过单因素试验对氢氧化钠浓度、碱浸固液比、碱浸时间、碱浸温度、柠檬酸浓度、酸浸固液比、酸浸时间等七个因素进行探究,以残余蛋白质和灰分含量为考察指标,确定从黑皱鳃金龟中提取甲壳素的初步制备工艺条件;再以单因素试验所得结果进行正交试验设计以优化工艺条件,采用紫外吸收法测定残留蛋白质含量(陈毓荃,2002),以残留蛋白质含量为指标来衡量氢氧化钠脱除蛋白质的效果;采用干法灰化法测定灰分含量 (参见GB 5009.4-2010),以残留灰分为指标来衡量柠檬酸脱除无机盐的效果;最后按照正交试验所得的最佳工艺条件进行甲壳素的提取并利用红外光谱比对法进行定性分析并计算其得率。蛋白质(μg/mL)=(1.45A280-0.74A260)×稀释倍数;总灰分(%)=(恒重后坩埚和灰分重量-恒重后坩埚重量)/样品重量×100。
1.2.1 单因素试验脱除蛋白质条件的探究
影响脱除蛋白质效果的有氢氧化钠浓度、碱浸温度、碱浸时间、固液比等四个因素。在单因素试验探究中,将其中三个因素固定为固定值,第四个因素设计成五个水平,以残留蛋白质含量为指标来确定上述五个水平那哪个为最适值。
1.2.2 单因素试验脱除无机盐条件的探究
影响脱除无机盐效果的有柠檬酸浓度、酸浸时间、固液比等三个因素。在单因素试验探究中,在室温条件下,将其中两个因素固定为固定值,第三个因素设计成五个水平,以残留灰分含量为指标来确定上述五个水平哪个为最适值。
1.2.3 氢氧化钠脱除蛋白质的正交试验设计
在单因素试验得到的最适氢氧化钠浓度、碱浸时间、碱浸温度、固液比的基础上,选择氢氧化钠浓度、碱浸时间、碱浸温度、固液比四个因素为考察对象,在单因素试验得到的四个因素最适值两端再各取一个水平,设计四因素三水平正交试验对工艺条件进行优化。正交试验设计见表1,重复2 次。

表1 脱除蛋白质的正交试验因素水平表Table1 Factors and levels of deproteinization orthogonal experiment
1.2.4 柠檬酸脱除无机盐的正交试验设计
在单因素试验得到的最适柠檬酸浓度、酸浸时间、固液比的基础上,在室温条件下,选择柠檬酸浓度、酸浸时间、固液比三个因素为考察对象,在单因素试验得到的三个因素最适值两端再各取一个水平,设计三因素三水平正交试验对工艺条件进行优化。正交试验设计见表2,重复2 次。
1.2.5 甲壳素的制备的工艺流程
新鲜甲虫→预处理→脱除蛋白质→水洗至中性→脱除无机盐→水洗至中性→干燥→脱色→甲壳素样品(彭元怀等,2012)。
1.2.6 甲壳素的定性定量分析
甲壳素定性检测采用红外光谱对比法:分别将标准甲壳素和所制备的甲壳素烘干,2 mg 待测样品与100 mg KBr 混合,通过压片法制成薄片,用红外光谱仪扫描范围400-4000/cm (包淑云等,2012),通过对比两者的红外光谱图,确定本研究制备的样品是否为甲壳素。
甲壳素得率计算方法(王敦等,2004;郭宝华,2005):甲壳素含量(%)=(所提甲壳素重量干重W1)/ (所用该种昆虫干重W2)×100

表2 脱除无机盐的正交试验因素水平表Table 2 Factors and levels of demineralization orthogonal experiment
2 结果与分析
2.1 单因素试验脱除蛋白质条件的探究
2.1.1 氢氧化钠浓度的确定
称取5 份黑皱鳃金龟粉1.000 g,分别置于锥形瓶中,依次以固液比1∶12 加入质量分数4%、6%、8%、10%、12%氢氧化钠溶液,置于90℃水浴锅中恒温5 h,水洗至中性,得脱除蛋白质的黑皱鳃金龟粉,测定其残余蛋白质含量,重复3 次,结果见图1。氢氧化钠浓度越高,脱除蛋白质的效果越好,氢氧化钠质量分数8%时,残余蛋白质含量0.760 μg/mL,而氢氧化钠质量分数10% 时,残余蛋白质含量0.701 μg/mL,即当氢氧化钠质量分数大于8%后,对脱除蛋白质的影响效果不大,且随着氢氧化钠质量分数的增加易使甲壳素脱乙酰化生成壳聚糖。因此,选择质量分数8%的氢氧化钠溶液浸泡即可。

图1 碱浓度对脱除蛋白质的影响Fig.1 Effect of NaOH concentration on deproteinization
2.1.2 碱浸温度的确定
称取5 份黑皱鳃金龟粉1.000 g,分别置于锥形瓶中,以固液比1∶12、质量分数8%加入氢氧化钠溶液,分别置于80℃、85℃、90℃、95℃、100℃水浴锅中恒温5 h 后水洗至中性,得脱除蛋白质的黑皱鳃金龟粉,测定其残余蛋白质含量,重复3 次。结果见图2。随着碱浸温度的升高,残余蛋白质含量急剧下降,脱除蛋白质效果明显;当达到85℃以后,残余蛋白质含量下降的趋势减缓。温度对氢氧化钠水解蛋白质有很大的影响,在其它条件固定的情况下,反应温度越高,蛋白质碱水解的速度越快;但温度达到一定值时,蛋白质碱水解速度开始变慢,蛋白质的碱水解反应趋于平衡,继续升温对脱除蛋白效果影响不大。同时考虑到高温反应会增加生产成本,因此,选择碱浸温度85℃即可。

图2 反应温度对脱除蛋白质的影响情况Fig.2 Effect of temperature on deproteinization
2.1.3 碱浸时间的确定
称取5 份黑皱鳃金龟粉1.000 g,分别置于锥形瓶中,以固液比1∶12、质量分数8%、水浴温度90℃,分别恒温1 h、3 h、5 h、7 h、9 h 后水洗至中性,得脱除蛋白质的黑皱鳃金龟粉,测定其残余蛋白质含量,重复3 次。结果见图3。在反应的初始阶段,随着碱浸时间的延长,残余蛋白质含量急剧下降,脱除蛋白效果明显;在5 h 后其蛋白质含量总体虽在下降,但下降的趋势减缓。一般来说,脱除蛋白质时间越长,蛋白质水解的越彻底,但水解速度逐渐减慢;当延长到某一时刻以后,蛋白质的水解反应进行得非常缓慢,其对脱除蛋白效果的影响便不再明显。同时考虑到长时间高温反应会带来生产成本上的增加,因此,选择碱浸时间5 h 即可。

图3 碱浸时间对脱除蛋白质的影响情况Fig.3 Effect of reaction time on deproteinization
2.1.4 碱浸固液比的确定
称取5 份黑皱鳃金龟粉1.000 g,分别置于锥形瓶中,分别以固液比1∶8、1∶10、1∶12、1∶14、1∶16 加入质量分数8%氢氧化钠溶液,置于90℃水浴锅中恒温5 h,水洗至中性,得脱除蛋白质的黑皱鳃金龟粉,测定其残余蛋白质含量,重复3 次。结果见图4。固液比对反应的影响不是很明显,但固液比越大,脱除蛋白质的效果越好,固液比1∶10 时,残余蛋白质含量为0.371 μg/mL,而当固液比1∶12 时,残余蛋白质含量为0.329 μg/mL,即当固液比大于1∶10 时,对除蛋白质的影响不是很大,因此,选择固液比1∶10 浸泡即可。

图4 固液比对脱除蛋白质的影响情况Fig.4 Effect of ratio of liquid to material removal of protein
2.2 单因素试验脱除无机盐条件的探索
2.2.1 柠檬酸浓度的确定
称取5 份黑皱鳃金龟粉1.000g,分别置于锥形瓶中,室温条件下,以固液比1∶11 分别加入浓度0.6 g ∕L、1.0 g/L、1.4 g/L、1.8 g/L、2.2 g/L柠檬酸溶液,反应时间30 h,水洗至中性,得脱除无机盐黑皱鳃金龟粉,测定其灰分含量,重复3 次。结果见图5。随着柠檬酸浓度的增加,灰分含量逐渐下降,脱除无机盐效果明显;柠檬酸浓度达到1.4 g/L 后其灰分含量总体也在下降,但下降趋势不明显,当浓度由1.4 g/L 变为1.8 g/L时,灰分含量由1.70% 变为1.57%,灰分含量减少量不大,且随着柠檬酸浓度的增加甲壳素易于水解。同时考虑在实际操作中,柠檬酸浓度过高会使反应速率过快而不易控制,因此,选择柠檬酸浓度1.4 g/L 较为合适。

图5 柠檬酸浓度对脱除无机盐的影响情况Fig.5 Effect of citric acid concentration on demineralization
2.2.2 酸浸时间的确定
称取5 份黑皱鳃金龟粉1.000g,分别置于锥形瓶中,室温条件下,以固液比1∶11 加入浓度1.4 g/L 柠檬酸溶液,恒温20 h、25 h、30 h、35 h、40 h,水洗至中性,得脱除无机盐黑皱鳃金龟粉,测定其灰分含量,重复3 次。结果见图6。在反应的初始阶段,随着酸浸时间的延长,灰分含量急剧下降,脱除无机盐效果明显;达到25 h以后其灰分含量总体也在下降,但下降趋势减缓。由于壳中碳酸钙是与甲壳素以及蛋白质结合在一起,在柠檬酸与碳酸钙的反应中,部分碳酸钙被甲壳素紧密的胶状分子团结构所包围,柠檬酸很难完全渗透到里面,导致其不能彻底与其反应完全。当达到25 h 以后,柠檬酸和碳酸钙的反应基本达到平衡,再延长时间对脱除无机盐效果的影响不大。因此,选择酸浸时间为25 h 即可。
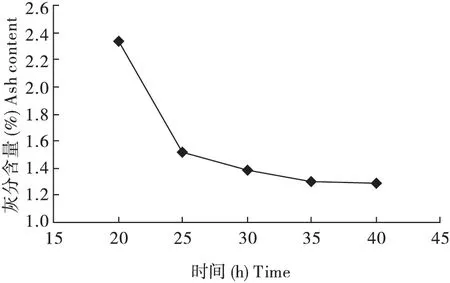
图6 酸浸时间对脱除无机盐的影响情况Fig.6 Effect of reaction time on demineralization
2.2.3 酸浸固液比的确定
准确称取5 份黑皱鳃金龟粉1.000 g,分别置于锥形瓶中,室温条件下,分别以固液比1∶7、1∶9、1∶11、1∶13、1∶15 加入浓度1.4 g/L 的柠檬酸溶液,恒温30 h,水洗至中性,得脱除无机盐黑皱鳃金龟粉。测定其灰分含量,重复3 次。结果见图7。固液比由1∶9 变至1∶11 时,灰分含量下降趋势较为明显,由2.39% 变为1.55%,而当固液比由1∶11 变至1∶13 时灰分含量有所减少但很缓慢,由1.55% 变为1.52%,因此,选择固液比1∶11 浸泡洗脱除无机盐即可。

图7 酸浸固液比对脱除无机盐的影响情况Fig.7 Effect of liquid-solid ratio on demineralization
2.3 氢氧化钠脱除蛋白质的正交试验
称取9 份黑皱鳃金龟干粉1.000 g,分别置于锥形瓶中,按表1 正交试验设计的9种组合进行试验,重复2 次取平均值。结果见表3。由正交试验结果可得最佳试验条件为A2、B1、C2、D2,即氢氧化钠浓度8%,固液比1∶10,在85℃下反应4 h即可。且又由结果可得A >C >B >D,即四个因素影响脱除蛋白质的主次顺序为:反应温度>固液比>碱浸时间>氢氧化钠溶液浓度。

表3 脱除蛋白质的正交试验设计及结果Table 3 Orthogonal test results of deproteinization
2.4 柠檬酸脱除无机盐的正交试验
称取9 份黑皱鳃金龟干粉1.000 g,分别置于锥形瓶中,按表2 正交试验设计的9种组合进行试验,重复2 次取平均值。结果见表4。由正交试验结果可得最佳条件为A2、B3、C3,即柠檬酸浓度1.6 g/L,固液比1∶12,在室温条件下反应25 h 即可,且又由结果可得B >C >A,即在室温条件下,三个因素影响柠檬酸脱除无机盐的主次顺序为:柠檬酸浓度>固液比>反应时间。
2.5 甲壳素的制备及其定性定量分析
2.5.1 甲壳素的制备
按照正交试验得到的最佳试验条件,将准确称取的黑皱鳃金龟干粉置于锥形瓶中,以固液比1∶10 加入质量分数8%氢氧化钠溶液,置于温度为85℃反应4 h,水洗至中性,得脱除蛋白质黑皱鳃金龟粉,烘干后再以固液比 1∶12 加入浓度1.6 g/L,的柠檬酸溶液,置于室温条件下恒温25 h,水洗至中性,烘干后可得脱除蛋白质与无机盐的粗产品,再进行脱色处理(张雪和王雪涛,2007),用3%的高锰酸钾溶液,以固液比1∶10,在室温下处理0.5 h,再用2%草酸溶液以固液比1∶20,在70℃进行还原脱色处理,即可得到白色蓬松的甲壳素产品。
2.5.2 甲壳素的定性分析
甲壳素的红外吸收光谱分析,对在最佳条件下制备的甲壳素产品进行质量分析与结构表征。甲壳素产品红外光谱如图8 所示,红外光谱图中3400 cm-1是O-H 伸缩振动吸收峰;3270 cm-1是N-H 伸缩振动吸收峰;2960-2879 cm-13 个吸收峰是C-H 伸缩振动吸收峰;分别在1657、1557、1315 cm-1的吸收峰,分别是酰胺Ⅰ、Ⅱ、Ⅲ谱带,这3 个吸收峰是甲壳素的特征吸收峰;1030-1157 cm-1之间的4 个吸收峰,是C-O 伸缩振动吸收峰;897 cm-1是环伸缩振动吸收峰。通过比对本工艺所得产品和购买的甲壳素标准样品的红外谱图可知,本工艺提取的甲壳素与甲壳素标样化学结构一致。
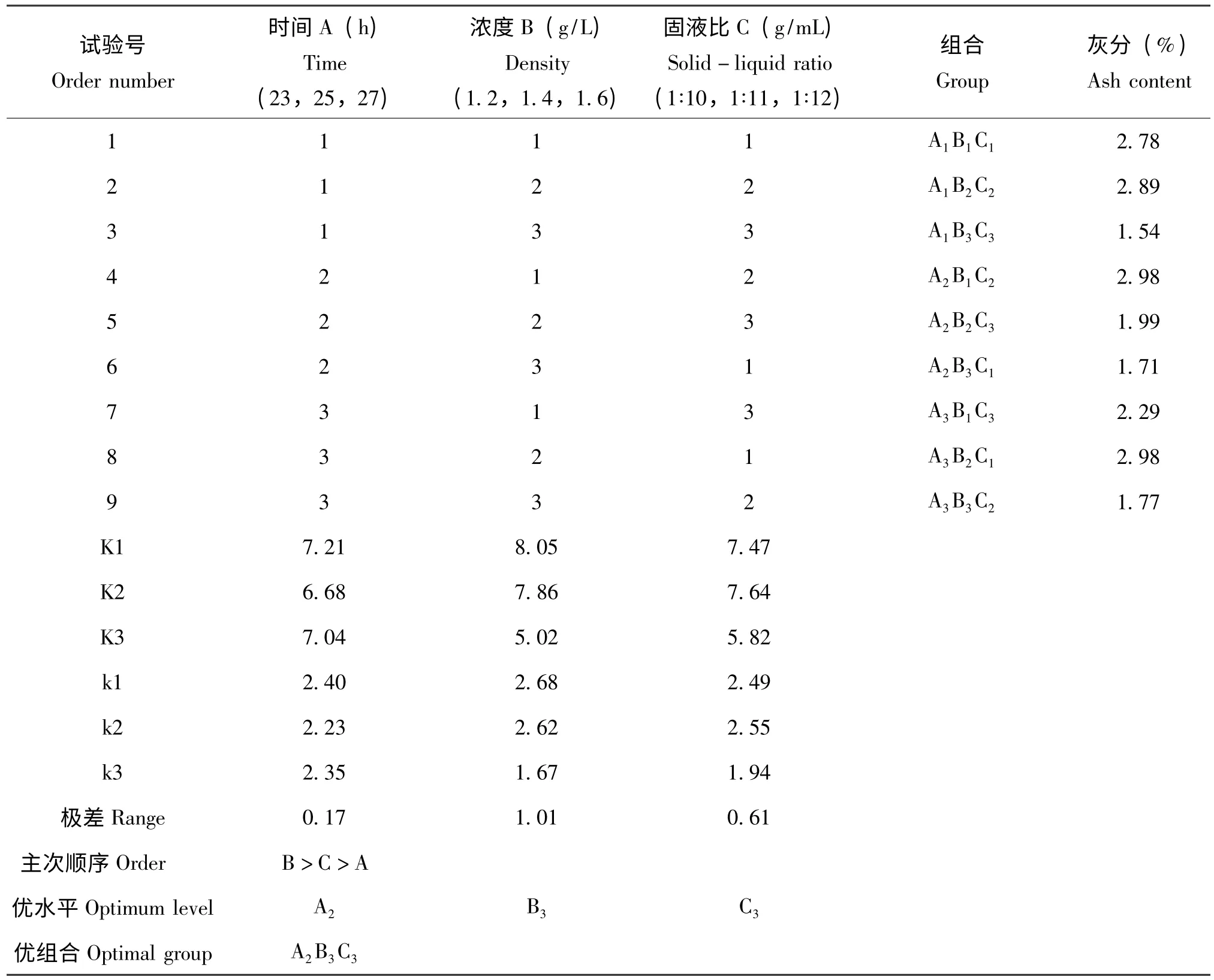
表4 脱除无机盐的正交试验设计及结果Table 4 Orthogonal test results of demineralization

图8 两种样品的红外光谱图Fig.8 IR spectra of two samples
2.5.3 甲壳素的定量分析
在本试验所得最佳工艺流程下制备甲壳素并计算其得率,结果分析可得从黑皱鳃金龟中提取甲壳素的得率为24.82% (表5)。

表5 黑皱鳃金龟粉提取甲壳素试验数据Table 5 The experimental data of chitin extracted from Trematodes tenebrioides Pallas
3 结论与讨论
本试验对黑皱鳃金龟甲壳素的提取工艺先进行了单因素试验,然后根据单因素的最佳条件再进行正交试验以优化工艺流程。应用紫外吸收法分析提取物中的残余蛋白质含量,利用干法灰化法分析提取物中残余灰分含量。通过对试验数据分析处理,又结合甲壳素在酸性较强的溶液中易分解,温度高又易降解,而在碱性较强的溶液中易脱乙酰化为壳聚糖的特性,初步确定了黑皱鳃金龟甲壳素提取的最佳工艺条件:氢氧化钠溶液质量分数8%、浸泡温度85℃、固液比1∶10、浸泡时间4 h,柠檬酸浓度1.6 g/L、浸泡固液比1∶12、浸泡时间25 h,在以上工艺条件下制备的甲壳素产品经脱色后为乳白色蓬松固体,得率24.82%.
本试验首次利用黑皱鳃金龟成虫为试验材料制备甲壳素,结果显示,该虫干粉甲壳素产率达24.82%,产品颜色呈乳白色絮状固体;对其产品进行红外光谱分析,证实了本试验所制备的物质确为甲壳素。昆虫作为甲壳素制备的材料来源,其自身优势十分明显。目前由昆虫获得的甲壳素产量、质量和提取流程上,具有比虾蟹壳单位产量高、提取流程简单、产品质量高、蛋白含量相对较少等明显优势,具有广泛利用前景,能够用于解决多种人类“文明病”。昆虫类甲壳素制备方面的研究相对滞后,研究也局限在个别昆虫种类。黑皱鳃金龟作为一种农业害虫,其存在危害着农作物的生长,严重时影响着农业经济的发展,将其作为提取甲壳素的原料能够变害为宝。昆虫丰富的物种资源以及其巨大的天然合成能力没有得到相应的利用,相信随着对大量不同种类昆虫甲壳素的深入研究,必定能够利用好这一丰富的天然资源。
References)
Bao SY,Wu SY,Li CP,et al.Study on preparation technology of silkworm pupa chitin[J].Lishizhen Medicine and Materia Medica Research,2012,23 (3):697-698.[包淑云,吴少云,李朝品,等.蚕蛹甲壳素的制备工艺研究[J].时珍国医国药,2012,23 (3):697-698]
Chen YQ.Method and Technique of Biochemical Experiment [M].Beijing:Science Press,2002,166-168.[陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002,166-168]
Duan YF,He ZC,Zhuang GD,et al.Study on the new production process of chitin[J].The Food Industry,2007,28 (3):7-8,10.[段元斐,何忠诚,庄桂东,等.甲壳素提取新工艺的研究[J].食品工业,2007,28 (3):7-8,10]
Guo BH.Chitin Extraction from Four Spieces of Insects and Purification of Insect Chitosan and Carboxymethyl chitosan [D].Beijing:China Academy of Forestry,2005.[郭宝华.四种昆虫甲壳素的提取及昆虫壳聚糖和羧甲基壳聚糖的制备[D].北京:中国林业科学研究院,2005]
Guo CJ,Zhang HP,Zhang LR,et al.The investigation of potato diseases and pests in central and southern Ningxia [J].China Vegetables,2012,(13):30-32.[郭成瑾,张华普,张丽荣,等.宁夏中南部地区马铃薯病虫害调查[J].中国蔬菜,2012(13):30-32]
He LZ,Yang D,Liu Y,et al.Study on the preparation of chitin with EDTA decalcify method [J].Journal of Food Science and Biotechnology,2008,27 (4):49-52.[何兰珍,杨丹,刘毅,等.制备甲壳素过程中EDTA 脱钙法的研究[J].食品与生物技术学报,2008,27 (4):49-52]
He YC,Xu QQ,Xu YH,et al.Extracting chitin and chitosan from Aspergillus Niger[J].Biotechnology,2000,10 (2):20-22.[贺淹才,许庆清,许嫣红,等.从黑曲霉提取甲壳素和壳聚糖[J].生物技术,2000,10 (2):20-22]
Ji HJ,Ma YL.Study on pupa chitin extraction process[J].Journal of Jilin Institute of Chemical Technology,2012,29 (5):28-32.[吉惠杰,马艳丽.蚕蛹甲壳素提取工艺研究[J].吉林化工学院学报,2012,29 (5):28-32]
Li WL,Lin NY,Li WP,et al.Study on the extraction of chitin from a new subspecies Blaps japanensis yunnanensis Mars[J].Journal of Yunnan University (Natural Science Edition),1999,21 (2):139-140.[李维莉,林南英,李文鹏,等.从云南琵琶甲中提取甲壳素的研究[J].云南大学学报 (自然科学版),1999,21 (2):139-140]
Liu GQ,Liu WX,Wei MC,et al.A preliminary study on the extraction of chitin from pupa of Dendrolimus punctatus [J].Journal of Northwest Forestry University,2007,22 (2):138-141.[刘高强,刘卫星,魏美才,等.从害虫马尾松毛虫中提取甲壳素的初步研究[J].西北林学院学报,2007,22 (2):138-141]
Liu XM,Wu N.Community features of Scarabaeoidea larvae in Stipa grandis steppe[J].Chinese Journal of Applied Ecology,2004,15 (9):1607-1610.[刘新民,乌宁.大针茅草原蛴螬群落特征研究[J].应用生态学报,2004,15 (9):1607-1610]
Peng YH,Huang C,Zhao ZJ.Study on optimization of ultrasonic wave-assisted extraction of chitin from shrimp shell[J].Science and Technology of Food Industry,2012,9:304-306.[彭元怀,黄川,赵泽洁.超声波辅助提取虾壳甲壳素的工艺研究[J].食品工业科技,2012,9:304-306]
Qu MJ,Jiang XJ,Ju Q,et al.Control and residual effects of several insecticides against the peanut grubs[J].Plant Protection,2011,27 (2):167-169.[曲明静,姜晓静,鞠倩,等.4种杀虫剂对花生蛴螬的防治效果及农药残留研究[J].植物保护,2011,27 (2):167-169]
Shi LM,Wang HJ,Gao WB.Adsorption behavior of chitin for lead (II)[J].Chemical Research and Application,2013,25 (3):336-339.[施林妹,王惠君,高伟彪.甲壳素对铅(Ⅱ)的吸附研究[J].化学研究与应用,2013,25 (3):336-339]
Tang YB,Xie J.Utilization of malate acid for the decalcifying of the shrimp head and shell [J].Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2012,41 (3):311-314.[唐义宝,谢晶.苹果酸用于虾头、虾壳脱钙的工艺条件[J].福建农林大学学报 (自然科学版),2012,41 (3):311-314]
Wang D,Hu JJ,Liu MT.The study of isolation chitin and chitosan from dung beetle[J].Scientia Silvae Sinicae,2004,40 (5):180-185.[王敦,胡景江,刘铭汤.从臭蜣螂中提取甲壳素/壳聚糖的研究[J].林业科学,2004,40 (5):180-185]
Wang JH,Gan X.Development and application of the silkworm chrysalis with plain crust[J].Modern Business Trade Industry,2003,4:46-48.[王金华,干信.蚕蛹甲壳素的开发与应用[J].现代商贸工业,2003,4:46-48]
Wang Y,Yang BB,Shao QJ.Progress in research on the effects of chitin,chitosan on immunologic function of aquatic animal[J].China Feed,2013,(6):38-40.[王月,杨彬彬,邵庆均.甲壳素、壳聚糖对水产动物免疫功能的影响研究进展[J].中国饲料,2013,(6):38-40]
Wu N,Liu XM,Guo L,et al.Influence of different stocking rates on scarabaoidea larvae community in inner mongolia typical steppe[J].Journal of Inner Mongolia Normal University (Natural Science Edition),2002,31 (4):379-383.[乌宁,刘新民,郭砺,等.不同放牧强度对内蒙古典型草原蛴螬群落特征影响的研究[J].内蒙古师范大学学报 (自然科学版),2002,31 (4):379-383]
Yang FW,Chen XM.Infrared spectroscopy and application performance comparison of several medical chitin non-woven[J].Guangdong Chemical Industry,2012,39 (16):32.[阳范文,陈晓明.几种医用甲壳素无纺布的红外光谱分析和应用性能比较[J].广东化工,2012,39 (16):32]
Zhang LL,Wu JX,Lu JJ.Scarabs species trapped by black light and population dynamics of dominant species in Yangling,Shaanxi Province [J].Journal of Environmental Entomology,2012,34 (3):395-399.[张林林,仵均祥,陆俊娇.陕西杨凌地区黑光灯下金龟甲种类组成及优势种群发生动态[J].环境昆虫学报,2012,34 (3):395-399]
Zhang X,Wang XT.Study on the preparation of chitin from exoskeleton of small lobsters[J].Science and Technology of Cereals,Oils and Foods,2007,15 (4):36-37,48.[张雪,王雪涛.虾壳制备甲壳素工艺研究[J].粮油食品科技,2007,15 (4):36-37,48]
Zhang YW.Identification of two species of the genus Trematodes Fald.(Melolonthidae)[J].Acta Zootaxonomica Sinica,1979,4 (3):303.[章有为.黑皱鳃金龟和爬皱鳃金龟的识别[J].动物分类学报,1979,4 (3):303]
Zhou XC,Liu BQ,Guo CP,et al.Fermentation of lactobacillus used for clean production of chitin based on shellfish waste as material[J].Oceanologia et Limnologia Sinica,2008,39 (5):517-522.[周湘池,刘必谦,郭春苹,等.生物技术清洁生产替代高污染化学法制备甲壳素的研究与应用[J].海洋与湖沼,2008,39 (5):517-522]
