土荆芥化感胁迫对玉米幼根抗氧化酶活性和基因表达的影响
2015-12-08陈斌王亚男马丹炜胡忠良何亚强周健
陈斌,王亚男,马丹炜,胡忠良,何亚强,周健
四川师范大学生命科学学院,四川 成都 610101
土荆芥化感胁迫对玉米幼根抗氧化酶活性和基因表达的影响
陈斌,王亚男,马丹炜*,胡忠良,何亚强,周健
四川师范大学生命科学学院,四川 成都 610101
为了探讨土荆芥(Chenopodium ambrosioides L.)化感胁迫诱导氧化损伤的机理,以土荆芥入侵地广泛种植的玉米(Zea mays L.)(雅玉26#)为受试材料,在未施加或施加外源抗氧化剂抗坏血酸(AsA)的条件下,研究了土荆芥挥发油及其两种主要成分对伞花素和α-萜品烯对玉米幼根根长以及抗氧化酶(CAT、SOD和POD)活性的影响,并运用实时荧光定量PCR(RT-qPCR)技术分析了土荆芥化感胁迫下3种抗氧化酶基因相对表达量的变化规律。结果表明:在土荆芥挥发油及其两种主要成分的作用下,玉米幼根根长受到影响,其抗氧化酶活性也受到不同程度的抑制。其中,SOD活性受到的抑制效应最为显著。挥发油的两种主要成分中,α-萜品烯对抗氧化酶活性的影响比对伞花素更为明显;各处理组中,玉米幼根的 SOD基因(ZmSOD)和POD基因(ZmPOD)的表达均被下调。在挥发油和对伞花素的作用下,CAT基因(ZmCAT)的表达随着处理剂量增加而显著上调。在α-萜品烯作用下,ZmCAT的表达在高处理剂量时明显被下调。整体来看,抗氧化酶活性与其基因的表达量具有显著的相关性;外源AsA缓解了土荆芥化感胁迫对玉米幼根抗氧化酶活性的抑制效应,这种缓解效应随着抗坏血酸浓度的增加而更加显著。以上结果说明,土荆芥挥发油及其两种主要成分诱导玉米幼根内过量积累活性氧(ROS),下调抗氧化酶基因表达,降低抗氧化酶活性,引起了氧化损伤。比较化感综合效应可知,土荆芥挥发油对玉米幼根抗氧化系统的胁迫效应最为明显(0.413),α-萜品烯次之(0.398),对伞花素最弱(0.325)。
土荆芥;挥发油;化感胁迫;抗氧化酶活性;基因表达
土荆芥(Chenopodium ambrosioides L.)属藜科藜属一年生或多年生草本植物,原产于中美洲和南美洲,现广布于全球热带及温带地区(徐海根等,2004),目前已成为我国危害极严重的外来入侵物种(中华人民共和国环境保护部,2010)。化感作用是入侵植物成功入侵的机制之一,它们通过各种途径释放到环境中的化感物质包括挥发性物质最终都会进入土壤影响植物的根系(王朋等,2008),抑制其他植物生长发育,如银叶鼠尾草(Salvia leucophylla)叶片释放的挥发性萜类化合物可以被雨露带进土壤(李绍文,1989)。根尖是植物吸收物质的主要部位,对外界胁迫十分敏感,对进入土壤的化感物质必然会产生响应。活性氧(Reactive Oxygen Species,ROS)是植物体产生的有害代谢产物。在正常情况下,植物体内的抗氧化剂和抗氧化酶将ROS控制在较低的水平(Yang et al.,2011;Gechev et al.,2006)。但是,当植物受到逆境胁迫时,ROS水平异常升高,就会抑制甚至破坏抗氧化系统诱导氧化胁迫,导致细胞死亡(Gechev et al.,2006)。化感胁迫往往伴随着氧化胁迫的发生,如美国西部的入侵植物斑点矢车菊(Centaurea maculosa)释放的化感物质-catechin引发拟南芥(Arabidopsis thaliana)根分生区 ROS爆发,激活ROS触发的Ca2+信号通路,最终导致植物细胞的快速死亡(Bais et al.,2003);向日葵(Helianthus annuus)籽油诱导发芽芥菜种子内H2O2浓度增大,细胞内MDA水平升高,使抗氧化系统失控(Bogatek et al.,2007)。土荆芥全株富含挥发油,其挥发油的化感胁迫引起蚕豆根尖细胞出现氧化损伤,细胞内积累 MDA,抗氧化酶活性改变(胡琬君等,
2012)。目前已知土荆芥挥发油成分在10种以上,虽然具有一定的地域差异,但主要成分均为单帖烯类和倍半萜类(贺祝英等,2002),如对伞花素和α-萜品烯等(黄雪峰等,2002;魏辉等,2010)。在这些物质中,哪些是土荆芥的挥发性主效化感物质?这些物质的化感作用是否改变了受体植物抗氧化酶基因的表达?这些化感物质诱导氧化损伤的途径和机理是什么?这些问题尚不清楚。因此,本研究选择在土荆芥入侵地被广泛栽培的农作物玉米(Zea mays L.)作为受体植物,以土荆芥挥发油及其两种主要成分对伞花素和α-萜品烯为供体,在探究土荆芥挥发性化感物质对玉米幼根根长影响的基础上,采用生化分析和RT-QPCR进一步分析了土荆芥挥发性化感物质对玉米幼根抗氧化酶活性以及对ZmSOD、ZmCAT、ZmPOD等抗氧化酶基因表达的影响。此外,在反应体系中施加外源抗氧化剂抗坏血酸(AsA)的条件下,研究在土荆芥化感胁迫下玉米根尖细胞抗氧化酶活性的变化规律,以期从分子水平和生物化学水平揭示土荆芥化感胁迫引起氧化损伤的机理,为确定土荆芥挥发油中的化感物质成分和探讨土荆芥入侵机制提供理论依据。
1 材料和方法
1.1 供试材料
成熟期土荆芥植株采集于成都郊区荒地,阴干后剪成小段,水蒸气蒸馏法(孟庆会等,2009)提取其挥发油,无水Na2SO4干燥后置于4 ℃冰箱保存备用;经四川大学分析测试中心测定,供试土荆芥挥发油中α-萜品烯含量为151 mg·mL-1,对伞花素的含量为156 mg·mL-1,本研究据此确定α-萜品烯和对伞花素的处理剂量。
α-萜品烯标准品(质量分数90%,国药集团化学试剂有限公司)、对伞花素标准品(质量分数99.5%,德国Ehrenstoefer Quality公司)均购自成都锐可思生化试剂公司。
受体植物玉米种子(雅玉 26#)购自四川西南科联种业有限责任公司。
1.2 实验方法
1.2.1 材料培养
挑选颗粒饱满、大小均一的玉米种子,0.5% KMnO4浸泡20 min,蒸馏水清洗6次,置于25 ℃培养箱中催芽;配制0.8%纯琼脂培养基,121 ℃灭菌后,分别将50 mL培养基倒入玻璃培养瓶(容积100 mL,高9 cm,瓶底直径6 cm)中,凝固后备用;待种子露白后,胚根朝外插入纯琼脂培养基中,每瓶10粒。
1.2.2 实验处理
胁迫实验:根据前期化感胁迫处理实验结果以及挥发油中α-萜品烯和对伞花素的含量,设置4个处理组:挥发油处理组(V)、对伞花素处理组(C)、α-萜品烯处理组(AT),对伞花素+α-萜品烯混合处理组(M)。设置3个化感物质处理梯度(表1),分别将挥发油、对伞花素、α-萜品烯滴加在培养瓶的瓶盖上,立即旋紧瓶盖,置于 25 ℃培养箱中,倒置暗培养24 h。以不加挥发油、对伞花素、α-萜品烯的处理为对照(CK),每处理重复5次。
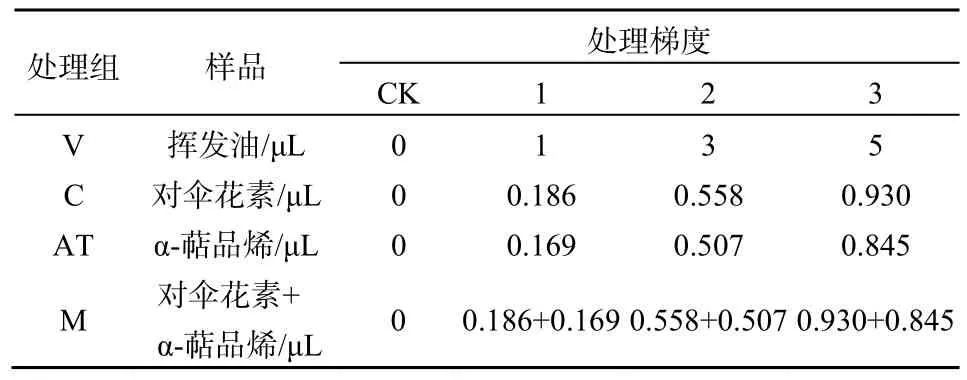
表1 土荆芥挥发油和两个主要成分的处理剂量Table 1 The treatment doses of the volatile oil from Chenopodium ambrosioides L. and two main components
缓解实验:根据胁迫处理实验结果,选取V组、C组、AT组和M组梯度2的处理进行氧化损伤缓解实验。分别将0.01、0.02、0.03、0.04、0.05 mol·L-1的 AsA溶液喷洒在玉米幼根上(每个培养瓶约 5 mL),其余操作与胁迫处理相同。以不加挥发油、对伞花素、α-萜品烯和 AsA溶液的处理为对照(CK)。
1.2.3 玉米幼根根长测定
24 h胁迫处理结束后,分别取不同处理下的玉米幼根测定其根长。
1.2.4 总RNA的提取和RT-qPCR分析
总RNA的提取:总RNA的提取按照天根生化科技(北京)有限公司的植物总RNA提取试剂盒(DP432)说明书进行。用普通琼脂糖凝胶电泳检测RNA完整性。
引物设计:使用Primer Express software(V 5.0)设计用于RT-qPCR的引物(表2)。
RT-qPCR分析:选取玉米的GAPDH基因作为内参基因,检测3个目的基因ZmSOD、ZmCAT、ZmPOD的相对表达量。使用北京庄盟国际生物基因科技有限公司(ZOMANBIO)的HSYBR一步法实时定量PCR试剂盒(ZOMANBIO,ZF301)进行实时定量PCR分析。使用美国Bio-Rad生命医学公司的 MiniOpticon™ Real-Time PCR Detection Systems,Bio-Rad CFX Manager(V 3.1)(SYBR Green)进行实时定量PCR。反应体系为20 μL,包括 10 μL的 HSYBR One Step RT-qPCR Buffer(ZOMANBIO),0.4 μL的forward and reverse引物(成都擎科梓熙生物技术有限公司),0.4 μL的
QKEnzyme Mix(ZOMANBIO),10 μL的RNA提取 物 以 及 7.8 μL 的 RNase-Free Water(ZOMANBIO)。PCR反应条件为:45 ℃ 5min,95 ℃ 1 min,然后94 ℃ 10 s,57 ℃ 40 s进行45个循环。每个处理分析3次,Bio-Rad CFX Manager(V 3.1)分析基因表达结果。

表2 玉米幼根ZmSOD、ZmCAT和ZmPOD基因RT-qPCR引物设计Table 2 Primers of ZmSOD, ZmCAT and ZmPOD used for RT-qPCR assays
1.2.5 抗氧化酶活性测定
总酶提取:分别称取0.5 g长约10 mm玉米根尖,置于研钵中,加入液氮研磨成粉末状后转入10 mL离心管,加入5 mL匀浆液[含50 mmol·L-1磷酸缓冲液(pH=7.0),1 mmol·L-1EDTA和2 g·L-1PVP]混匀,4 ℃下10000 g离心40 min,取上清液待用(范雪涛等,2008)。
抗氧化酶活性测定:抗氧化酶活性的测定方法参照文献(刘萍等,2007),略有改进。SOD(超氧化物歧化酶)活性的测定采用氮蓝四唑(NBT)光化还原法;CAT(过氧化氢酶)活性采用 H2O2分解法测定;POD(过氧化物酶)活性采用愈创木酚法测定。分别用SpectraMax M2多功能酶标仪测定OD值。
1.3 数据处理和统计分析
化感效应敏感指数(RI)的计算参照Williamson et al.(1998)的方法:

式中,C为对照值,T为处理值。RI表示化感作用强度大小,其绝对值大小反映化感作用的强弱。参考文献(沈慧敏等,2005)计算挥发油、对伞花素、α-萜品烯及其混合物的化感综合效应(SE)。
采用SPSS 17.0进行ANOVA方差分析和相关性分析,Microsoft Excel 2010作图。
2 结果与分析
2.1 土荆芥挥发油及其两种主要成分对玉米幼根根长的影响
在土荆芥挥发油及其两种主要成分作用下,玉米幼根根长变化如图1所示。

图1 土荆芥挥发油及其两种主要成分对玉米幼根根长的影响Fig. 1 The effects of the volatile oil from Chenopodium ambrosioides L., α- terpinene and cymene on the root length of maize radicle
总体上,4种不同化感物质处理下,玉米幼根的长度均受到不同程度的影响。其中,在处理梯度为3时,在挥发油及其两种不同主要成分作用下,玉米幼根的长度被明显抑制(P=0.000)。整体来看,处理剂量越大,对玉米幼根的长度的抑制效应越显著。
2.2 土荆芥挥发油及其两种主要成分对玉米幼根抗氧化酶活性的影响
在土荆芥挥发油及其两种主要成分作用下,玉米幼根CAT、SOD、POD活性变化如图2所示。
CAT活性在各处理组均表现为与处理剂量呈负相关。土荆芥挥发油及其两种主要成分的不同处理对CAT活性的影响差异不显著;SOD活性总体上表现出与CAT活性相似的特征。其中挥发油对其活性的影响较其他处理组更为显著(P=0.000)。随着处理剂量的增大,α-萜品烯对SOD活性的抑制作用相对于对伞花素更为明显;除AT组表现为随着处理剂量增大呈先降低后增加的趋势外,其余各处理组 POD活性均与处理剂量呈负相关,即处理剂量越大, POD活性受抑制效应越显著。
整体来看,玉米幼根 SOD活性受到土荆芥挥发油及其两种主要成分的影响较大,而 POD活性的变化幅度相对较小。抗氧化酶活性与幼根根长相关性分析表明结果表明,不同处理组中,抗氧化酶活性与幼根根长均呈显著正相关(P<0.05)。4种处理对抗氧化酶的化感综合效应强弱顺序为:挥发油
(0.413)>α-萜品烯(0.398)>对伞花素(0.325)>α-萜品烯+对伞花素(0.283)。

图2 土荆芥挥发油、对伞花素和α-萜品烯对玉米幼根CAT、SOD和POD活性的影响Fig. 2 The effects of the volatile oil from chenopodium ambrosioides L., α- terpinene and cymene on activities of CAT, SOD and POD in maize radicle
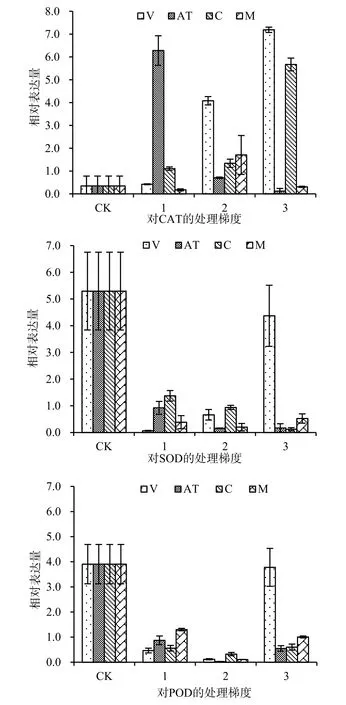
图3 土荆芥挥发油、对伞花素和α-萜品烯对玉米幼根ZmCAT、ZmSOD和ZmPOD相对表达量的影响Fig. 3 The effects of the volatile oil from Chenopodium ambrosioides L., α- terpinene and cymene on relative expression of ZmSOD, ZmCAT and ZmPOD in maize radicle
2.3 土荆芥挥发油及其两种主要成分对玉米幼根抗氧化酶基因表达的影响
在土荆芥挥发油及其两个主要成分作用下,玉米幼根ZmSOD、ZmCAT和ZmPOD的相对表达量发生变化(图3)。
与对照相比,V组和C组玉米幼根的ZmCAT的表达量均被上调,上调程度与处理剂量呈正相关;AT组中,低剂量处理(梯度1)导致ZmCAT基因表达量明显上调,但随着处理剂量增大,这种上调作用逐渐减弱;M组中,中等处理剂量(梯度2)导致ZmCAT基因表达量上调。
与对照相比,ZmSOD的相对表达量在4个处理组中均被显著下调,其中AT、C和M组下调最为明显。V组的低剂量处理使ZmSOD表达量明显下调,高剂量处理时,ZmSOD基因表达量所有上升,但仍低于对照。
ZmPOD的相对表达量在4个处理组中表现出
与ZmSOD相似的结果。其中AT、C和M组中,ZmPOD表达量均被下调,下调程度随着处理剂量增大而更为显著。V组中,低剂量处理导致ZmPOD的相对表达量明显下调,而高剂量处理使 ZmPOD表达量明显上调。
抗氧化酶活性与基因表达相关性分析结果表明,不同处理组中,CAT活性与其基因相对表达量均呈负相关,但未达到显著水平(P>0.05);SOD活性与其基因表达呈正相关,其中对伞花素处理组达到显著水平(P=0.033);挥发油处理组中 POD活性与基因表达量呈负相关,其余处理组 POD活性与其基因相对表达量之间均表现出正相关。
2.4 外源AsA对土荆芥化感胁迫下玉米幼根抗氧化酶活性的影响
无外源AsA时,玉米幼根CAT、SOD和POD活性均明显低于对照组(P<0.01)(图4)。

图4 外源抗坏血酸作用下土荆芥挥发油、对伞花素和α-萜品烯对玉米幼根CAT、SOD和POD活性的影响Fig. 4 The effects of the volatile oil from Chenopodium ambrosioides L., α- terpinene and cymene on Activities of CAT, SOD and POD in maize radicle under the treatments of exogenous ascorbic acid
当施加外源 AsA后,CAT活性明显升高(P=0.000),且与处理剂量呈正相关。但当AsA处理浓度为0.05 mol·L-1时,除C组外,CAT活性相对于其他处理剂量有所降低,但仍然高于未施加外源AsA的处理组。
SOD活性在各处理组中均随着AsA浓度增加而升高。其中,V组的SOD活性升高幅度最为明显,各处理均达到显著水平(P<0.01)。当AsA浓度为0.03 mol·L-1时,其余处理组的SOD活性升高也达到显著程度(P<0.05)。0.05 mol·L-1的AsA作用下,各处理组的 SOD活性有所降低,但仍高于没有施加外源AsA的处理组。
POD活性的变化与SOD相似,但其活性随AsA浓度增加的幅度大于SOD。在0.05 mol·L-1AsA溶液作用下,POD活性显著高于无 AsA的处理组(P=0.000)。
3 讨论
3.1 土荆芥挥发油及其两种主要成分化感胁迫诱导的氧化损伤
化感物质引起的胁迫往往会诱导 ROS的过量积累而使受体代谢失衡(Yang et al.,2011)。这些ROS一方面可以作为信号分子,参与细胞内的抗氧化应答(Kreslavskii et al.,2012),低剂量的ROS也会诱导抗氧化酶活性升高,以达到清除过量ROS的目的(Veal et al.,2011;Suzuki et al.,2012)。另一方面,当 ROS积累过多,受体抗氧化系统会受到破坏,主要的抗氧化酶如SOD、POD、CAT等活性受到影响(何兵等,2013)。抗氧化系统在植物对外防御中起着重要的作用,但化感物质诱导的氧化损伤往往又会影响抗氧化系统的正常运转(Qian et al.,2009)。本研究结果表明,在土荆芥挥发油及其主要成分对伞花素和α-萜品烯作用下,玉米幼根的生长不同程度受到抑制,抗氧化酶活性整体表现随着处理剂量增加而下降的趋势。
植物体积累的 ROS会不同程度地影响抗氧化酶基因的表达。一般来说,较低水平的 ROS诱导抗氧化酶基因表达上调(Li et al.,2012),而较高水平的ROS会使得抗氧化系统受到破坏(Zhang et al.,2012;Sharma et al.,2012),诱导的基因表达下调(Shearer et al.,2012;Mehterov et al.,2012;Golisz et al.,2011)。毛野豌豆(Vicia villosa Roth.)
释放的氰胺影响了蕃茄(Solanum lycopersicum L.)根尖细胞分裂和激素水平,下调抗氧化应答相关基因表达(Dorota et al.,2012)。本研究结果表明,玉米幼根不同抗氧化酶基因表达对不同化感物质胁迫的应答有所差异。在挥发油和对伞花素作用下,玉米幼根CAT基因表达上调,在高剂量处理组中,对伞花素处理的上调效应大于挥发油处理。α-萜品烯对 CAT基因表达的影响则整体表现为低剂量上调、高剂量下调效应,其下调作用比对伞花素更为明显;整体来看,挥发油、对伞花素和α-萜品烯化感胁迫均导致 SOD基因和 POD基因表达下调。根据这些结果推测,土荆芥化感胁迫诱导产生的 ROS作为信号分子,参与细胞抗氧化应答,通过上调抗氧化酶基因表达、提高抗氧化酶活性来清除过量产生的 ROS。当化感胁迫诱导产生的 ROS量过多、超出了抗氧化系统的清除能力时,导致抗氧化系统受损,基因表达下调,进而引起氧化损伤。在同等剂量处理下,α-萜品烯对玉米幼根的损伤作用大于对伞花素。相关性分析表明,不同处理组的CAT活性均与基因相对表达量呈负相关,但未达到显著水平。此时,基因表达量上调,但酶活性仍然随处理剂量增加而降低,其原因可能是土荆芥化感胁迫导致 ROS过量产生,破坏了细胞内蛋白质的结构与功能。而SOD与POD的活性与其基因相对表达量整体呈正相关,表明土荆芥挥发油及其两种主要成分通过下调相关抗氧化酶基因表达从而降低了酶的活性。
3.2 外源AsA对土荆芥挥发油及其两种成分诱导氧化损伤的缓解效应
AsA是自然界植物抗氧化系统中重要的非酶抗氧化剂,可以通过清除过量的 ROS达到抗氧化的目的(Huang et al.,2005)。当用AsA和SO2共同作用于气孔保卫细胞时,AsA有效清除了SO2胁迫产生的ROS,缓解了由SO2诱导的保卫细胞凋亡(魏爱丽等,2014)。本研究结果表明,施加外源AsA条件下,明显缓解了由土荆芥挥发油及其两种主要成分胁迫对玉米幼根抗氧化酶活性的抑制效应,CAT、SOD和POD的活性明显升高,这种缓解作用随着AsA剂量的增加而增强。由此可见,土荆芥挥发油及其两种主要成分造成玉米根尖受损与其化感胁迫诱导的氧化损伤有关。在土荆芥挥发油、对伞花素和α-萜品烯作用下,根尖细胞内积累大量ROS,破坏抗氧化酶的结构与功能。
4 结论
土荆芥挥发油及其两种成分化感胁迫影响抗氧化酶基因的表达,降低抗氧化酶活性,引起玉米幼根生长受抑制。这种抑制效应与土荆芥挥发油及其两种成分诱导细胞内大量积累ROS,引起氧化损伤有关;土荆芥挥发油化感胁迫效应最明显,α-萜品烯次之,对伞花素最弱。
BAIS H P, VEPACHEDU R, GILROY S, et al. 2003. Allelopathy and exotic plant invasion: from molecules and genes to species interactions [J]. Science, 301(5638): 1377-1380.
BOGATEK R, GNIAZDOWSK A A. 2007. ROS and phytohormones in plant-plant allelopathic interaction [J]. Plant Signaling & Behavior, 2(4): 317-318.
DOROTA S, ANNA R L, AGNIESZKA G, et al. 2012. Inhibition of tomato (Solanum lycopersicum L.) root growth by cyanamide is due to altered cell division, phytohormone balance and expansin gene expression [J]. Planta, 236(5): 1629-1638.
GECHEV T S, BREUSEGEM F V, STONE J M, et al. 2006. Reactive oxygen species as signals that modulate plant stress responses and programmed cell dea th [J]. Bioessays, 28(11): 1091-1101.
GOLISZ A, SUGANO M, HIRADATE S, et al. 2011. Microarray analysis of Arabidopsis plants in response to allelochemical L-DOPA [J]. Planta, 233(2): 231-240.
HUANG C H, HE W L, GUO J K, et al. 2005. Increased sensitivity to salt stress in an ascorbate-deficient Arabidopsis mutant [J]. Journal of Experimental Botany, 56(422): 3041-3049.
KRESLAVSKII V D, LOS D A, .ALLAKHVERDIEV S I, et al. 2012. Signaling Role of Reactive Oxygen Species in Plants under Stress [J]. Russian Journal of Plant Physiology, 59(2): 141-154.
LI L, YI H. 2012. Effect of sulfur dioxide on ROS production, gene expression and antioxidant enzyme activity in Arabidopsis plants [J]. Plant Physiology and Biochemistry: PPB/Societe Francaise de Physiologie Vegetale, 58(3): 46-53.
MEHTEROV N, BALAZADEH S, HILLE J, et al. 2012. Oxidative stress provokes distinct transcriptional responses in the stress-tolerant atr7 and stress-sensitive loh2 Arabidopsis thaliana mutants as revealed by multi-parallel quantitative real-time PCR analysis of ROS marker and antioxidant genes [J]. Plant Physiol Biochemistry, 59(2): 20-29.
QIAN H F, XU X Y, CHEN W, et al. 2009. Allelochemical stress causes oxidative damage and inhibition of photosynthesis in Chlorella vulgaris [J]. Chemosphere, 75(3): 368-375.
SHARMA P, JHA A B, DUBEY R S, et al. 2012. Reactive Oxygen Species, Oxidative Damage, and Antioxidative Defense Mechanism in Plants under Stressful Conditions [J]. Journal of Botany: 1-26.
SHEARER T L, RASHER D B, SNELL T W, et al. 2012. Gene expression patterns of the coral Acropora millepora in response to contact with macroalgae [J]. Coral Reefs, 31(4): 1177-1192.
SUZUKI N, KOUSSEVITZKY S, MITTLER R, et al. 2012. ROS and redox signalling in the response of plants to abiotic stress [J]. Plant, Cell & Environment, 35(2): 259-270.
VEAL E, DAY A. 2011. Hydrogen peroxide as a signaling molecule [J]. Antioxidants & Redox Signaling, 15(1): 147-151.
WILLIAMSON G B, RICHARDSON D. 1998. Bioassays for allelopathy [J]. Journal of Chemical Ecology, 14(1): 181-187.
YANG C Y, LIU S J, ZHOU S W, et al. 2011. Allelochemical ethyl 2-methyl acetoacetate (EMA) induces oxidative damage and antioxidant responses in Phaeodactylum tricornutum [J]. Pesticide Biochemistry and Physiology, 100(1): 93-103.
ZHANG F, CHEN F, LIU W, et al. 2012. ρ-Cymene Inhibits Growth and
Induces Oxidative Stress in Rice Seedling Plants [J]. Weed Science, 60(4): 564-570.
范雪涛, 马丹炜, 向莎, 等. 2008. 不同逆境条件下辣子草抗氧化酶系统的变化[J]. 应用与环境生物学报, 14(5): 616-619.
何兵, 王亚男, 李安奇, 等. 2013. 土荆芥组培根分泌物对大豆根尖细胞的氧化损伤[J]. 四川师范大学学报, 36(3): 440-444.
贺祝英, 周欣, 王道平, 等. 2002. 贵州土荆芥挥发油化学成分研究[J].贵州科学, 20(2): 76-78.
胡琬君, 马丹炜, 王亚男, 等. 2012. 土荆芥挥发油对蚕豆根尖细胞的氧化损伤[J]. 应用生态学报, 23(4): 1077-1082.
黄雪峰, 孔令义. 2002. 土荆芥挥发油的化学成分分析[J]. 中国药科大学学报, 33(3): 256-257.
李绍文. 1989. 生态生物化学(二). 高等植物之间的生化关系[J]. 生态学杂志, 8(1): 66-70.
刘萍, 李明军. 2007. 植物生理学实验技术[M]. 北京: 科学出版社: 123-129, 147-149, 162-164.
孟庆会, 黄红娟, 刘艳, 等. 2009. 假高粱挥发油化学成分及其化感潜力[J]. 植物保护学报, 36(3): 277-282.
沈慧敏, 郭鸿儒, 黄高宝. 2005. 不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J]. 应用生态学报, 16(4): 740-743.
王朋, 王莹, 孔垂华. 2008. 植物挥发性单萜经土壤载体的化感作用——以三裂叶豚草(Ambrosia trifida L.)为例[J]. 生态学报, 28(1): 62-68.
魏爱丽, 辛晓静, 王云山, 等. 2014. SO2衍生物诱导的萱草保卫细胞凋亡及其信号调节[J]. 环境科学学报, 34(3): 801-806.
魏辉, 李兵, 田厚军, 陈艺欣, 等. 2010. 福建省不同产地及不同生育期土荆芥精油化学成分的比较[J]. 植物资源与环境学报, 19(3): 62-67.
徐海根, 强胜. 2004. 中国外来入侵物种编目[M]. 北京: 中国环境科学出版社: 91-92.
中华人民共和国环境保护部. 2010. 关于发布中国第二批外来入侵物种名单的通知. [2014-12-08]. http://www.mep.gov.cn/gkml/hbb/bwj/ 201001/t20100126_184831.htm.
The Antioxidant Enzyme Activities and Their Gene Expression in Maize Radicle under the Allelochemical Stress from Chenopodium ambrosioides L.
CHEN Bin, WANG Yanan, MA Danwei*, HU Zhongliang, HE Yaqiang, ZHOU Jian
College of Life Science, Sichuan Normal University, Chengdu 610101, China
To explore the mechanism of oxidative damage induced by the allelochemical stress of an invasive plant, Chenopodium ambrosioides L.. In this study, maize (Zea mays L.) which widely planted in the areas invaded by C. ambrosioides was chosen as the receptor plant. The root length and the activities of catalase (CAT), superoxide dismutase (SOD) and peroxidase (POD) in maize radicles induced by the volatile oil from Chenopodium ambrosioides L. and its two main components (cymene and α-terpinene) were studied under the condition of exogenous antioxidant ascorbic acid or absent. The antioxidant enzyme gene expressions of maize radicle were analyzed by the real-time fluorescent quantitative (RT-qPCR). The results showed that the root length of maize radicle were inhibited by the volatile oil, cymene and α-terpinene from C. ambrosioides, and the antioxidant enzyme activities in maize radicle were inhibited, too. The inhibitory effect on SOD activity was the most significant in the three enzymes. Their activities affected by α-terpinene were more obvious than cymene. The expression of ZmSOD and ZmPOD were down-regulated in each treatment group, while the ZmCAT expression was up-regulated with the increasing treatment dose. And when treated with high dose of α-terpinene, the expression of ZmCAT was down-regulated obviously. There was a correlation between the antioxidant enzymes and their gene expression. The inhibtory effect on the antioxidant enzymes activities induced by the allelopathic stress was reduced by the exogenous ascorbic acid. The reducing effect was more significant with the increasing concentration of ascorbic acid. In conclusion, C.ambrosioides and its two main components induced the excessive accumulation of reactive oxygen species (ROS) in maize radicle, down-regulated the gene expression of the antioxidant enzymes, reduced the antioxidant enzyme activities and caused oxidative damage. In comparison of the effects on the antioxidant system of maize radicle, the stress induced by the volatile oil was the most, followed by α-terpinene, cymene was the weakest.
Chenopodium ambrosioides L.; volatile oil; allelochemical stress; antioxidant enzyme activity; gene expression
10.16258/j.cnki.1674-5906.2015.10.008
Q945.78;X171.1
A
1674-5906(2015)10-1640-07
陈斌,王亚男,马丹炜,胡忠良,何亚强,周健. 土荆芥化感胁迫对玉米幼根抗氧化酶活性和基因表达的影响[J].生态环境学报, 2015, 24(10): 1640-1646.
CHEN Bin, WANG Yanan, MA Danwei, HU Zhongliang, HE Yaqiang, ZHOU Jian. The Antioxidant Enzyme Activities and Their Gene Expression in Maize Radicle under the Allelochemical Stress from Chenopodium ambrosioides L. [J]. Ecology and Environmental Sciences, 2015, 24(10): 1640-1646.
国家自然科学基金项目(31370549);四川省高校重点实验室开放项目(SCYZ201410);四川师范大学校级重点培育项目(2013)
陈斌(1988年生)男,硕士研究生,主要从事细胞生物学的研究。E-mail: xiao_nongfu@hotmail.com *通信作者:马丹炜(1963年生)女,教授,硕士生导师,博士,研究方向为植物化感作用。E-mail: danwei10ma@163.com
2015-07-15
