细叶百合鳞茎冷藏过程中核酸及蛋白质的变化
2015-12-08刘芳郭晓红廉华马光恕汪志强
刘芳,郭晓红,廉华,马光恕,汪志强
(黑龙江八一农垦大学农学院,大庆 163319)
细叶百合鳞茎冷藏过程中核酸及蛋白质的变化
刘芳,郭晓红,廉华,马光恕,汪志强
(黑龙江八一农垦大学农学院,大庆 163319)
以细叶百合为试材,通过冷藏(5℃)解除鳞茎休眠,研究了细叶百合鳞茎解除休眠过程中核酸及可溶性蛋白质的变化规律。结果表明,冷藏过程中顶芽与鳞茎盘中核酸含量发生了明显的变化,顶芽中DNA、RNA含量及RNA/DNA比值在鳞茎冷藏36 d时变化最为明显,贮藏36 d是内外鳞片DNA及核酸总含量的转折点;顶芽和鳞茎盘冷藏0~36 d内可溶性蛋白质的含量升高,鳞茎不同部位可溶性蛋白质含量在冷藏48 d后迅速降低也是鳞茎开始解除休眠的重要体现。
细叶百合;鳞茎;休眠;核酸;可溶性蛋白质
细叶百合观赏性很强,又兼有药用和食用的价值。秋季鳞茎收获后即进入休眠状态。休眠期间,鳞茎外部形态变化不明显,但其内部仍发生着非常复杂的生理生化反应。已有研究表明,百合休眠鳞茎在低温处理过程中淀粉向可溶性糖转化,可溶性蛋白及氨基酸含量的增加,以及内源激素的变化,抗氧化酶类作为保护酶在百合鳞茎休眠解除过程中都具有重要的作用[1-4]。蛋白质在植物休眠解除及球根萌发成苗的过程中,调控着植物的各种生理生化反应和新陈代谢过程,控制休眠性状的因素极其复杂,鳞茎休眠过程中所有的变化归根结底都与遗传物质的调控相关,目前,关于百合鳞茎休眠过程中核酸的变化规律还不曾有人报道,试验试图从细叶百合鳞茎解除休眠过程中的核酸及可溶性蛋白的代谢规律入手,研究遗传物质变化与鳞茎萌发的关系,以期为揭示细叶百合鳞茎休眠解除的生理生化标志及休眠机理提供理论支持。
1 材料与方法
供试材料为从凌源引种的野生种细叶百合,鳞茎周径4~6 cm。
于2012年10月中旬采收细叶百合休眠鳞茎于5℃冰箱中冷藏处理,冷藏基质为蒸汽消毒的潮湿珍珠岩。低温处理阶段,每12 d取样一次,每次随机取
30个鳞茎测定顶芽与鳞茎长的比值,并将鳞茎定值于花盆中放在25℃的人工气候箱中进行萌发试验(统计30 d内的鳞茎萌发率及萌发时间,取其平均值,确定休眠程度),每次随机取10个鳞茎,分成外层、内层鳞片、顶芽、鳞茎盘四部分,测定其生理指标。每处理重复3次。
核酸含量测定:采用紫外吸收法,参照张荻的方法[5]。可溶性蛋白质含量的测定,采用考马斯亮蓝G-250法[6]测定。试验数据采用Excel软件进行计算和处理,利用DPS软件进行数据分析。
2 结果与分析
2.1 冷藏过程中细叶百合鳞茎的萌发情况
由表1可见,在冷藏0~12 d内鳞茎没有萌发,24 d时鳞茎萌发率为33.33%,随着冷藏时间的延长鳞茎萌发率逐渐升高,冷藏84 d时鳞茎能够完全萌发。鳞茎萌发率在不同冷藏时期差异显著。鳞茎顶芽在冷藏过程中逐渐伸长,冷藏0 d时顶芽长度将近鳞茎高度的1/2,冷藏60 d时顶芽与鳞茎长比率已接近2/3。冷藏84 d时顶芽已伸长到鳞茎顶端。顶芽与鳞茎长比率在72~84 d较0~60 d差异显著。

表1 冷藏过程中鳞茎的萌发情况Table 1Bulb germination situation during cold storage
2.2 细叶百合鳞茎冷藏过程中核酸含量的变化
如图1、图2所示。百合鳞茎在低温贮藏过程中,顶芽和鳞茎盘中核酸含量发生了明显的变化,顶芽内DNA和总核酸含量的变化呈现先下降后上升的趋势,在冷藏12~24 d内含量降低,冷藏36~84 d内DNA和总核酸的含量随贮藏时间的延长呈递增趋势。RNA含量整体变化表现为逐渐上升的趋势。在0~24 d内含量增加缓慢,24~48 d内含量增加幅度较大,此后有一个平稳时期,鳞茎冷藏84 d时含量达到最高。RNA/DNA的变化为先上升后回落的抛物线趋势。

图1 鳞茎冷藏过程中DNA和RNA含量的变化Fig.1Changes of DNA and RNA content of Lilium pumilum Bulbs during cold storage
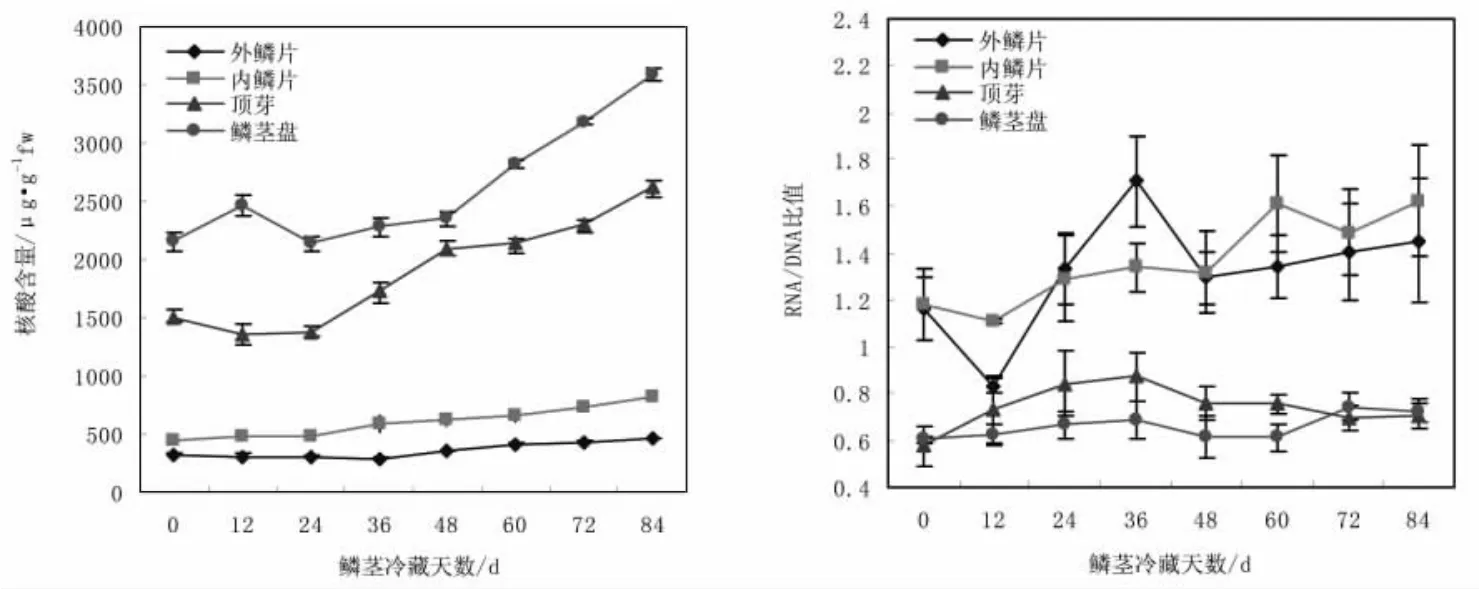
图2 鳞茎冷藏过程中总核酸含量及RNA/DNA的变化Fig.2Nuclear acid content and RNA/DNA ratio changes of bulb during cold storage
冷藏过程中鳞茎盘核酸的变化与顶芽内的变化有所差异,鳞茎盘从冷藏0~48 d内DNA含量和RNA含量呈先上升后下降再上升的波动性变化趋势,此时期内DNA和RNA的含量变化范围不大,冷藏48 d后DNA和RNA的含量随贮藏时间的延长呈上升趋势。鳞茎盘核酸总含量的变化趋势与DNA含量的变化趋势类似,核酸总含量在冷藏后期变化量较大。鳞茎盘中RNA/DNA比值在冷藏0~36 d内缓慢上升,36 d后又有下降趋势,72 d后迅速上升到最大值。
鳞片在冷藏过程中DNA、RNA及总核酸的含量比顶芽及鳞茎盘中的含量低。外鳞片及内鳞片在整个冷藏过程中DNA的含量变化具有波动性,但在冷藏48 d后两个部位DNA的含量都比贮藏0 d时有一定程度的增加。外鳞片的RNA含量在12~84 d内随冷藏时间的延长逐渐升高。内鳞片在整个冷藏时期内,RNA含量持续升高,内外鳞片RNA含量在冷藏末期都有较大幅度的提高。外鳞片核酸含量呈先下降后上升的趋势,冷藏48 d时总核酸含量已经高于冷藏0 d时的含量。内鳞片总核酸含量随贮藏时间延长持续递增。外鳞片和内鳞片RNA/DNA比值在整个冷藏期都有不同程度的波动,从整体上看,除了冷藏12 d时的比值较低外,冷藏24~84 d内RNA/DNA比值均高于贮藏0 d的比值。内鳞片在冷藏84 d时比值最大。
2.3 细叶百合鳞茎冷藏过程中可溶性蛋白质含量的变化
从整个贮藏期内的含量变化上可知(图3),顶芽内可溶性蛋白含量高于鳞茎盘的含量,外鳞片和内鳞片可溶性蛋白含量相差不多,但比顶芽和鳞茎盘中的含量低一些。顶芽和鳞茎盘中可溶性蛋白含量的变化成抛物线型的变化趋势,在冷藏0~36 d内随贮藏时间的延长含量持续增加,36~84 d逐渐递减,冷藏84 d时蛋白含量降至最低。外鳞片和内鳞片中可溶性蛋白含量的变化为先下降后上升再下降的趋势。冷藏0~36 d内鳞片内可溶性蛋白含量逐渐降低,变化过程比较平缓,冷藏48 d时含量有所上升,冷藏48 d后内外鳞片蛋白质含量均成递减趋势。从蛋白含量的变化情况看,蛋白质在整个贮藏过程中变化幅度不大,且在鳞茎的不同部位蛋白含量整体上呈下降的趋势。

图3 鳞茎冷藏过程中可溶性蛋白含量的变化Fig.3Soluble protein content changes of bulb during cold storage
3 讨论与结论
(1)百合鳞茎休眠解除过程中,鳞茎内部的生理活动也比较活跃,作为遗传物质的核酸和生命活动体现者的蛋白质影响着细胞的分裂、分化以及器官的形成和发育过程。在百合鳞茎低温贮藏过程中,顶芽与鳞茎盘中的核酸含量发生了明显的变化,顶芽分生组织中DNA、RNA含量及RNA/DNA比值在鳞茎冷藏36 d时变化最为明显,贮藏36 d是内外鳞片DNA及核酸总含量的转折点,而且,顶芽与内部鳞片RNA/DNA比值在这个时期含量最高,说明这个时期有着旺盛的mRNA转录和蛋白质合成。鳞茎盘中RNA/DNA的比值呈现明显的双峰曲线,此时期也是RNA/DNA的比值的第一个峰值。鳞茎冷藏36 d后,鳞茎不同部位DNA、RNA及核酸总含量都成逐渐上升趋势,鳞茎不同部位在冷藏36 d后DNA含量上升,至第84 d鳞茎出芽时达到高峰。
(2)植物体内酶蛋白比例很高,可溶性蛋白质含量一定程度上能够反映植物体内生理代谢活动的强弱[7-8]。百合鳞茎顶芽和鳞茎盘冷藏0~36 d内可溶性蛋白质的含量升高,鳞茎不同部位在冷藏48 d后迅速降低是鳞茎开始解除休眠的重要标志。说明鳞茎在冷藏48 d后,休眠解除需要大量消耗蛋白质导致其水溶性蛋白含量降低。这些可溶性蛋白发生降解,可能合成其他的蛋白质或者游离的氨基酸或者进入其他物质的代谢循环。高文远[9]指出,鳞片中蛋白质含量越高,其休眠程度越低。浙贝母鳞茎的功能蛋白质和贮藏蛋白质等可溶性蛋白质含量在休眠解除前期也有所增加。与试验的研究结果是相似的。管毕财[10]对龙牙百合休眠鳞茎的研究表明在休眠解除时,鳞茎盘和鳞叶的谱带变化趋势相似,只是鳞茎盘中出现了新蛋白,而鳞叶中没有新蛋白出现,表明在低
温解除休眠过程中,鳞茎盘顶端分生组织可能是生命活动的中心,鳞茎休眠解除的过程主要是鳞茎盘顶端分生组织的复苏过程,鳞叶也参与了这个过程,鳞茎盘和鳞叶之间有着密切的联系,存在着内在物质代谢的相关性。试验中发现,鳞茎盘和顶芽的蛋白含量较高,且在冷藏过程中变化显著,说明鳞茎盘和顶芽内可溶性蛋白质的变化可能在鳞茎休眠解除过程中起着更为关键的作用。
[1]孙红梅,李天来,李云飞.低温贮藏期间百合鳞茎中的游离氨基酸组分和含量变化[J].植物生理学通讯,2004,40(4):414-418.
[2]Xu R Y,Niimi Y,Han D S.Changes in endogenous abscisic acid and soluble sugars levels during dormancyrelease in bulbs of Lilium rubellum[J].Sci Hort,2006,111:68-72.
[3]孙红梅,李天天,李云龙.低温解除休眠过程中兰州百合中部鳞片物质变化的生理机制[J].中国农业科学,2005,38(2):376-382.
[4]乔永旭,张永平,陈超,等.百合鳞茎低温解除休眠与抗氧化系统酶的关系[J].西南农业学报,2010,23(1),161-163.
[5]张获.百子莲花芽分化及开花机理研究[D].哈尔滨:东北林业大学,2011.
[6]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[7]涂淑萍,穆鼎,刘春.百合鳞茎低温解除体眠过程中的生理生化变化研究[J].江西农业大学学报,2005,27(3):404-407.
[8]靳亚忠,焦玉生,王宁.氮肥用量对暗棕壤烤烟氮素积累及分配的影响[J].黑龙江八一农垦大学学报,2014,26(4):1-4.
[9]高文远.浙贝母低温解除休眠过程中可溶性蛋白质的含量变化[J].中国中药杂志,1997,22(7):397-398.
[10]管毕财,龚熹,郭琼.低温打破龙牙百合休眠过程中可溶性蛋白的变化[J].南昌大学学报,2006,30(5):492-494.
Changes of Nuclear Acid and Soluble Protein Content in Lilium pumilum Bulbs under Refrigerated Condition
Liu Fang,Guo Xiaohong,Lian Hua,Ma Guangshu,Wang Zhiqiang
(College of Agronomy,Heilongjiang Bayi Agricultural University,Daqing 163319)
The changes of nuclear acid content and soluble protein content of Lilium pumilum in the process of bulb dormancy breaking at 5℃were studied.Results showed that the changes of nucleic acid content in apical buds and basal plates of Lilium pumilum bulbs were obvious.The changes of DNA,RNA content and RNA/DNA ratio in apical buds were most obvious when bulb refrigerated 36 d,and 36 d was a turning point of the total amount of nucleic acid and DNA in inner and outer scales.The content of soluble protein in apical buds and basal plates increased within 0-36 d during refrigerated condition.The content of soluble protein in different parts of the bulbs reduced rapidly after 48 d,which was the important symbol of bulb for breaking dormancy.
Lilium pumilum;bulb;dormancy;nuclear acid;soluble protein
S682.29
A
1002-2090(2015)02-0019-04
10.3969/j.issn.1002-2090.2015.02.005
2014-10-25
黑龙江省农垦总局科技攻关项目(HNK125BZD-02-17,HNK125BZD-04-21);黑龙江省青年科学基金(QC2012C057)。
刘芳(1980-),女,实验师,东北林业大学毕业,现主要从事园艺植物种质资源方面的研究工作。
