不同禽源坦布苏病毒抗原相关性的测定与分析
2015-12-08傅秋玲傅光华程龙飞万春和施少华陈红梅陈翠腾林建生
傅秋玲,傅光华,黄 瑜,程龙飞,万春和,施少华,陈红梅,陈翠腾,陈 珍,林建生
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
不同禽源坦布苏病毒抗原相关性的测定与分析
傅秋玲,傅光华,黄 瑜,程龙飞,万春和,施少华,陈红梅,陈翠腾,陈 珍,林建生
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
为了比较不同禽源坦布苏病毒(TMUV)抗原的相关性,通过细胞微量血清交叉中和试验测定了分离自种鸭、蛋鸡、肉鹅的不同禽源坦布苏病毒之间的抗原相关值,并进行了抗原相关性分析。结果测得抗鸭源TMUV阳性血清对鸭源TMUV、鸡源TMUV和鹅源TMUV的中和效价分别为1∶1 349、1∶1 202和1∶1 318,抗鸡源TMUV阳性血清对鸭源TMUV、鸡源TMUV和鹅源TMUV的中和效价分别为1∶1 023、1∶1 023和1∶977,抗鹅源TMUV阳性血清对鸭源TMUV、鸡源TMUV和鹅源TMUV的中和效价分别为1∶933、1∶912和1∶955。根据亲缘值(R值)(R=√r1×r2)计算公式,得出鸭源TMUV与鸡源TMUV、鹅源TMUV间的抗原亲缘值(R)分别为0.94和0.95,鸡源TMUV与鹅源TMUV间的抗原亲缘值(R)为0.91,可见3种不同禽源TMUV之间的R均大于0.7,表明三者为同一血清型的坦布苏病毒。
坦布苏病毒;不同禽源;抗原相关性;测定
2010年的4月以来,我国南方大部分地区种(蛋)鸭相继发生了一种以产蛋骤降为主要特征的传染病。研究者对该病从病毒分离、形态学观察、理化特性测定、全基因组测序与分析和动物致病性试验等方面开展了一系列研究,最终明确了其病原为坦布苏病毒(Tembusu virus,TMUV)[1-5]。这几年相继又有种(蛋)鸡、鹅、白羽半番鸭、樱桃谷鸭、麻雀和鸽子感染TMUV的病例报道,表明该病毒的感染宿主在不断增多,感染谱在不断拓宽,已严重危害我国养禽业的健康发展[6-12]。
目前关于TMUV生物学特性、抗原性、主要毒
力和结构蛋白功能等相关研究报道较少。因此,开展对该病毒的抗原性研究不仅可揭示不同禽源TMUV的抗原相关性,还可促进疫苗研发工作进程,为禽类防治该病提供依据。
基于国内已报道鸭源、鸡源和鹅源TMUV基因组之间的核酸序列和氨基酸序列的同源性均很高,分别达98.4%和98.6%以上[13]。鉴于此,这3种不同禽源TMUV的抗原相关性如何?本研究通过细胞微量交叉中和试验明确其抗原相关性。
1 材料与方法
1.1 毒株和试验鸭胚 WR株鸭源TMUV、FQ-C1株鸡源TMUV和GD06株鹅源TMUV均由福建省农业科学院畜牧兽医研究所分离、鉴定和保存,10日龄鸭胚(无TMUV母源抗体),购自华南生物农大生物药品有限公司。
1.2 方法
1.2.1 阳性血清抗体、阴性血清抗体的制备 阳性血清抗体是浓缩的灭活WR株鸭源TMUV、FQC1株鸡源TMUV和GD06株鹅源TMUV病毒液分别经甲醛灭活后与弗氏不完全佐剂按1∶1比例进行乳化,首次免疫成年鸭、鸡和鹅,间隔2周后,与弗氏完全佐剂乳化后再次免疫,3免后采集血液制备血清,应用鸭胚成纤维细胞中和试验法测定抗血清效价,56℃灭活后分装冻存备用。阴性血清抗体的制备是采集自无TMUV母源抗体鸭胚孵化而得的雏鸭,56℃灭活后分装冻存备用。
1.2.2 原代鸭胚成纤维细胞的培养 在无菌条件下取出12日龄鸭胚的胚体,置于平皿内,用小镊子去内脏、头、翅膀和腿等器官后将剩余的胴体放入50 mL的烧杯。用DMEM培养基漂洗3次,将剪刀剪成1 mm3左右的小块,再用DMEM培养基漂洗3次后,弃去上清。将烧杯内的小组织块移入锥形瓶内,加入适量的胰酶后置入37℃水浴锅内,消化约10min至组织小块边缘出现毛绒状为止。弃去胰酶,加入DMEM培养基漂洗3次,弃去上清。加入适量培养基吹打组织小块至呈单个细胞后,将液体加入8层纱布过滤。加入完全培养基(含6%胎牛血清)稀释至25mL后,进行活细胞计数,最后将细胞密度调整至106个/m L,加入96孔微量细胞培养板内于37℃、5%CO2培养箱静置培养。
1.2.3 不同禽源TMUV细胞适应毒的复壮 将不同禽源TMUV鸭胚成纤维细胞适应毒接种于鸭胚成纤维细胞上,置37℃、5%CO2培养箱培养,直至出现75%的细胞病变后置-80℃冰箱冻存,反复冻融3次后收毒,病毒液分装后标明批次,于-80℃保存备用。
1.2.4 不同禽源TMUV TCID50的测定[14]分别对WR株鸭源TMUV、FQ-C1株鸡源TMUV和GD06株鹅源TMUV病毒液用不完全培养基DMEM进行10倍系列稀释,将10-1-10-10每稀释度按0.1mL/孔的剂量接种于使用96孔培养皿培养的原代鸭胚成纤维细胞中,37℃孵育1 h,弃去病毒液,以PBS洗涤1次后按200μL/孔加入96孔细胞培养板内,于37℃、5%CO2继续培养1周并观察记录细胞病变结果,按Kärber法计算TCID50。
1.2.5 细胞微量血清中和试验的操作程序 采用固定病毒稀释血清法[15]。首先制备原代鸭胚成纤维细胞铺于96孔细胞培养板内,次日将处理好的血清以灭菌PBS(pH值=7.2)进行连续梯度稀释。以稀释好的血清与病毒于37℃进行感作处理1 h。将感作后的病毒-血清混合液以100μL/孔的量加入已含单层细胞的96孔微量细胞培养板内,每个血清梯度接种5个孔。同时,设病毒对照、血清对照和细胞空白对照孔,均于37℃、5%CO2培养箱中静置培养。每天观察两次细胞病变,记录试验结果。以病毒对照全部死亡及血清、PBS对照全部存活为试验成立。按Kärber方法计算血清抗体效价。
1.2.6 细胞微量血清交叉中和试验 首先将3种禽源TMUV阳性血清用灭菌PBS作倍比稀释。且将含200TCID50/0.2 mL的病毒(WR株鸭源TMUV、FQ-C1株鸡源TMUV和GD06株鹅源TMUV病毒液)分别与不同稀释度的阳性血清等量混合,于37℃孵育1 h。其他步骤按照1.2.5进行操作。
1.2.7 判定标准 参照口蹄疫病毒血清型和亚型的区分标准进行判定[15],由异源血清与同源血清效价之比得到2个比值(r1和r2),再根据公式亲缘值(R值):R=√r1×r2计算得出。
2 结果
2.1 不同禽源TMUV TCID50的测定按Kärber方法计算出WR株鸭源TMUV、FQ-C1株鸡源TMUV和GD06株鹅源TMUV的TCID50值分别为105.96/0.1 mL、105.69/0.1mL、105.62/0.1mL。
2.2 细胞微量交叉中和效价及R值 采用固定病毒(200TCID50/0.2mL)稀释血清法对鸭源、鹅源和鸡源TMUV进行细胞微量交叉中和试验。利用交叉中和抗体效价按公式计算两种间的亲缘值(R值)(表2),结果显示,WR株鸭源TMUV与FQC1株鸡源TMUV、WR株鸭源TMUV与GD06株鹅源TMUV和FQ-C1株鸡源TMUV与GD06株鹅源TMUV的R值分别为0.94、0.95和0.91。因此,不同禽源TMUV的R值都大于0.7,表明3种不同禽源TMUV处于同一种血清型。
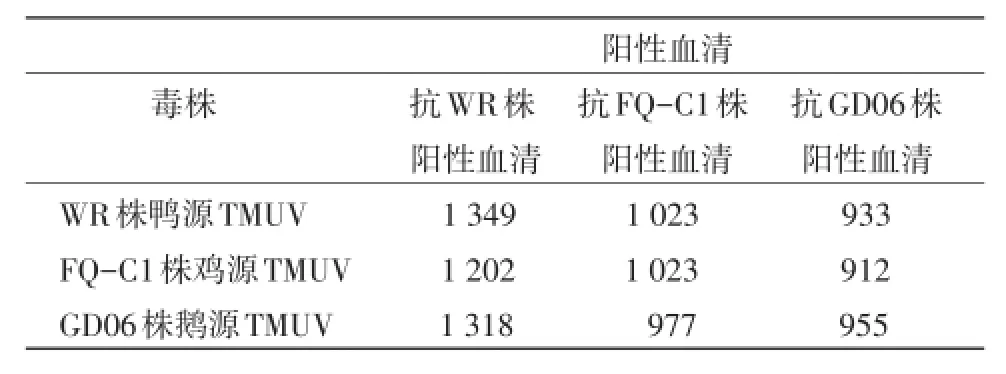
表1 不同禽源TMUV与相应血清交叉中和试验

表2 不同禽源TMUV毒株间R值
3 讨论与结论
坦布苏病毒是黄病毒(Flaviviridae)黄病毒属(Flavivirus)的坦布苏病毒成员,其基因组全长约为10 278 nt,编码3 425个氨基酸的多聚蛋白前体,由3种结构蛋白(衣壳蛋白C、膜前体蛋白M和包膜蛋白E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)组成[16]。自2010年以来,我国研究发现不同禽源的坦布苏病毒全基因组核苷酸的同源性很高[16]。本研究选用的FQ-C1株鸡源TMUV与2010年后分离的TMUV全基因组核苷酸的同源性均达98%以上,与WR株鸭源TMUV全基因组核苷酸和氨基酸同源性都达99.2%,与鹅源TMUV全基因组核苷酸和氨基酸同源性亦达99%和98%以上[12];WR株鸭源TMUV与鹅源TMUV全基因组核苷酸和氨基酸同源性也为99%以上[17],且GenBank中近几年公布TMUV各分离株间的序列无宿主来源或分离地点的特性差异[12]。
本研究利用细胞微量血清交叉中和试验测定了不同禽源的抗原相关值,结果显示,3株不同禽源TMUV之间的R值都达0.9以上,均大于0.7,表明这3种不同禽源的TMUV不存在抗原性差异,为同一血清型坦布苏病毒,与基因组核苷酸同源性高的结果相一致。
[1]万春和,施少华,程龙飞,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J].福建农业学报,2010,25(6):663-666.
[2]曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[3]滕巧泱,颜丕熙,张旭,等.一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报,2010,18(6):1-4.
[4]SU J,LIS,HU X,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related Flavivirus[J].PLOS One,2011,6(3):e18106.
[5]Cao Z,Zhang C,Liu Y,et al.Tembusu virus in ducks,China[J]. Emerg Infect Dis,2011,17(10):1873-1875.
[6]傅光华,黄瑜,施少华,等.鸡黄病毒的分离与初步鉴定[J].福建畜牧兽医,2011,33(3):1-2.
[7]陈仕龙,陈少莺,王劭,等.一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J].福建农业学报,2011,26(2):170-174.
[8]黄欣梅,李银,赵冬敏,等.新型鹅黄病毒JS804毒株的分离与鉴定[J].江苏农业学报,2011,27(2):354-360.
[9]施少华,傅光华,万春和,等.鹅源坦布苏病毒的分离及初步鉴定[J].中国兽医杂志,2012,48(12):37-40.
[10]傅秋玲,施少华,陈珍,等.鸭感染禽坦布苏病毒血清学检测与分析[J].中国农学通报,2014,30(20):21-25.
[11]TANG Y,DIAO Y,YU C,et al.Characterization of a Tembusu Virus Isolated from Naturally Infected House Sparrow(Passer do⁃mesticus)in Northern China[J].Transboundary and Emerging Dis⁃eases,2013,60(2):152-158.
[12]Liu P,Lu H,Li S,et al.Genomic and antigenic characterization of the newly emerging Chinese duck egg-drop syndrome flavivi⁃rus:genomic comparison with Tembusu and Sitiawan viruses[J].J GVirol,93:2158-2170.
[13]傅光华,黄瑜,程龙飞,等.坦布苏病毒鸡源分离株全基因组及遗传变异分析[J].中国兽医学报,2014,34(9):1418-1422.
[14]Saif Y M.禽病学[M].苏敬良,高福,索勋,译.12版.北京:中国农业出版社,2005:431-443.
[15]殷震,刘景华.动物病毒学[M].2版 .北京:科学出版社,1997:510-512.
[16]Tang Y,Diao Y,Gao X,et al.Analysis of the complete genome of Tembusu Virus,a flavivirus isolated from ducks in China[J]. Transbound Emerg Dis,2012,59(4):336-343.
[17]傅光华,陈红梅,黄瑜,等.种番鸭源禽坦布苏病毒分离鉴定及基因组序列分析[J].福建农业学报,2014,29(4):301-305.
Identification and analysis of the antigenicity of Tembusu virus from different avian
FUQiu-ling,FUGuang-hua,HUANG Yu,CHENG Long-fei,WAN Chun-he,SHIShao-hua,CHEN Hong-mei,CHEN Cui-teng,CHEN Zhen,LIN Jian-sheng
(Institute of Animal Husbandry and Veterinary Medicine,Fujian Academy of Agricultural Science,Fuzhou 350013,China)
In order to study the antigenicity of different avian Tembusu viruses isolated from breeding duck,laying hen,and meat goose,serum cross cellmicro-neutralization testwas employed to analyze the antigenicity of the viruses.The results of serum cross neutralization test showed that the neutralization titers of reaction between sera against TMUV from ducks and different avian Tembusu viruseswere 1∶1349,1∶1202 and 1∶1318,respectively.The neutralization titers of reaction between sera against TMUV from chickens and differentavian Tembusu viruseswere 1∶1023,1∶1023 and 1∶977,respectively.The neutralization titers of reac⁃tion between seras against TMUV from geese and different avian Tembusu viruseswere 1∶933,1∶912 and 1∶955,respectively.Ac⁃cording to the relative value(R value)calculation formula(R=√r1×r2),the R value between TMUV from ducks and TMUV from chickens or TMUV from geese were 0.94 and 0.95,and the R value between TMUV from chickens and TMUV from geese was 0.91,which was more than 0.7.The results indicate that the three different avian Tembusu viruses belong to the same sero-sub⁃type,and the crossprotectionsexistamong them.
Tembusu virus;differentavian;antigenicity;identification
HUANG Yu
S852.65
A
0529-6005(2015)11-0030-03
2015-06-11
现代农业产业技术体系建设专项资金资助(CARS -43);国家自然科学基金项目(31201936);福建省优良蛋鸭品种与设施化养殖创新产业化工程项目;福建省农业科学院科研项目(2013DQB-3);福建省农科院“双百”行动项目(sbmx1507-3)
傅秋玲(1985-),女,研究实习员,硕士,研究方向为预防兽医免疫,E-mail:qiulingfu0822@163.com
黄瑜,E-mail:huangyu_815@163.com
