过氧化尿素的制备及产品中活性氧含量的测定*
——介绍一个基础化学综合实验
2015-12-07蔡吉清李秀玲曾秀琼何巧红
蔡吉清 李秀玲 曾秀琼 何巧红
(浙江大学化学系 浙江杭州 310058)
过氧化尿素的制备及产品中活性氧含量的测定*
——介绍一个基础化学综合实验
蔡吉清 李秀玲**曾秀琼 何巧红
(浙江大学化学系 浙江杭州 310058)
介绍一个基础化学小型综合实验——过氧化尿素的制备及产品中活性氧含量的测定。该实验以尿素和过氧化氢为原料制备过氧化尿素,并对其性质及含量进行鉴定和定量分析。实践结果表明本实验设计合理,可作为基础化学实验课程中的小型综合实验开设。
过氧化尿素 活性氧含量 氧化-还原性质 高锰酸钾
浙江大学对本科教学方法进行了改革,提出了“厚基础、强能力、重自主创新”三阶段实验教学模式,并在实验教学内容上坚持以人为本[1],即以学生为实验教学的中心,注重学生综合素质的培养,在教学工作中充分发挥学生学习的主动性。本文以已有文献[2-11]为基础,设计了一个基础化学小型综合实验,该实验涉及过氧化尿素的制备,过氧化尿素的氧化-还原性质鉴定以及过氧化尿素产品中过氧化氢含量的测定,集无机制备、定性和定量分析多种基本操作于一个实验中,有利于学生实验综合能力的培养,同时也为基础化学实验增添了新内容。
1 实验原理
过氧化尿素又称过氧化氢尿素、过碳酰胺、过氧化碳酰胺或过氧化氢脲,分子式为:CH6N2O3,相对分子质量为94.07,外观为白色针状晶体或粉末,无毒无味,易溶于水。是一种与过氧化氢溶液性质相似的固体氧化剂。与过氧化氢相比,过氧化尿素具有价廉、安全、易于存储、使用方便等优点,因而被广泛应用于医药、纺织、日用化工、食品、印染、农业、建筑等领域[2-11]。
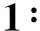
CO(NH2)2+H2O2=CO(NH2)2·H2O2
本实验通过混合尿素和过氧化氢溶液,并缓慢蒸发溶液得到过氧化尿素晶体。过氧化尿素遇水缓慢分解释放出活性氧(reactive oxygen species,ROS)。由于活性氧的存在,表现出较强的氧化性、漂白性和杀菌性。
通过定性实验可使学生了解过氧化尿素的氧化还原性质。
过氧化尿素中活性氧含量利用高锰酸钾氧化-还原滴定法来测定。
过氧化尿素产物中活性氧含量(质量分数)按下式计算:
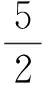
式中w(ROS)为过氧化尿素中活性氧质量分数;c为高锰酸钾标准溶液浓度(mol/L);V为滴定所用的高锰酸钾标准溶液的体积(L);m为过氧化尿素产品试样的质量(g)。
2 实验部分
2.1 试剂
过氧化氢(30%);尿素(s);高锰酸钾溶液(0.02mol/L);Na2C2O4(基准物质);H2SO4(3mol/L);二氧化锰(s);AgNO3(0.1mol/L);硫代乙酰胺(5%);NaOH(6mol/L,2mol/L);KI(0.1mol/L);K2CrO4(0.1mol/L);H2SO4(2mol/L);乙醚;无水乙醇。
2.2 实验步骤
2.2.1 过氧化尿素制备
2.2.2 过氧化尿素的性质[12]
称取0.50g过氧化尿素于试管中,加5mL水溶解。
(1) 过氧化尿素的鉴定反应:在试管中加入5滴过氧化尿素溶液、0.5mL乙醚和2滴2mol/L H2SO4酸化,再加入2~3滴0.1mol/L K2CrO4溶液,振荡试管,观察水层和乙醚层颜色有何变化。
(2) 过氧化尿素的催化分解:在试管中加入0.1g产品、少量水及二氧化锰,用火柴余烬检验生成的气体,观察现象。
(3) 过氧化尿素的酸碱性:用pH试纸测试过氧化尿素溶液的酸碱性。在试管中加入1mL 6mol/L NaOH,1mL过氧化尿素溶液和2mL无水乙醇,振荡试管,观察现象。
(4) 过氧化尿素的氧化性:在试管中加入5滴过氧化尿素溶液、2滴0.1mol/L KI溶液、4滴2mol/L H2SO4溶液,振荡试管,观察现象。
在离心管中加入10滴0.1mol/L Pb(NO3)2溶液,再滴加10滴5%硫代乙酰胺溶液,振荡离心管后,将试管放在水浴中加热,观察现象。离心分离后弃去上层清液,用少量去离子水洗涤沉淀3次,然后往沉淀中加入数滴过氧化尿素溶液,微热,观察现象。
(5) 过氧化尿素的还原性:在试管中加入3滴0.1mol/L AgNO3溶液,并滴加2mol/L NaOH溶液至棕色沉淀生成,再滴加1mL过氧化尿素溶液,用火柴余烬检验生成的气体,观察现象。
在另一试管中加入3滴0.1mol/L AgNO3溶液,直接滴加1mL过氧化尿素溶液,用火柴余烬检验,观察现象有何不同。
2.2.3 过氧化尿素中活性氧含量测定[12-13]
(1) 高锰酸钾标准溶液的标定:准确称取0.20~0.22g Na2C2O4于250mL锥形瓶中。用80mL去离子水溶解后,再加15mL 3mol/L H2SO4,混匀后,将溶液加热到70~80℃。立即趁热用KMnO4滴定至溶液呈微红色且30s不退色为终点。
(2) 准确称量0.62g产品,放在100mL烧杯中,用50mL去离子水溶解后,全部转移到100mL容量瓶内,用少量蒸馏水把烧杯洗几次,洗涤液也倒入容量瓶内,最后把溶液定容到100mL。用移液管移取10.00mL溶液至250mL锥形瓶中,加入80mL去离子水和15mL 3mol/L H2SO4,混匀后,用高锰酸钾标准溶液滴定至微红色(30s不变)。
3 结果与讨论
3.1 结果
由于过氧化氢是过量的,过氧化尿素的收率以尿素为基准,当尿素的使用量为1.75g时,过氧化尿素的理论产量为2.74g。得到的过氧化尿素的收率平均为90%。结果表明此方法制得的产品收率较高。过氧化尿素中活性氧理论含量为17.02%,制得的产品中活性氧含量为16.9%左右,高于文献值[5-11]。
3.2 注意事项
(1) 在制备过氧化尿素水浴加热时,要注意控制温度,防止尿素分解,缓慢蒸发过程约需60min。
(2) 操作时应注意过氧化氢、过氧化尿素均有腐蚀性。30%过氧化氢不要接触金属,特别是金属粉末。
(3) 对于过氧化尿素的催化分解实验,加入二氧化锰的量一定要少(固体控制在一个小米粒大小),以防由于分解速度过快使反应液喷溅到试管外;对于用火柴余烬检验生成的气体,由于过长的试管无法观测到火柴复燃现象,建议使用离心管。
(4) 在做高锰酸钾标准溶液的标定实验时,应注意控制滴定条件:温度在75~85℃,酸度在0.5~1mol·L-1,滴定速度为:慢—快—慢(开始滴定时先缓慢滴加,然后再加快滴定速度,临近终点时再缓慢滴加)。
3.3 性质实验现象及解释
(1) 过氧化尿素的鉴定反应:振荡试管后,上层为乙醚层,溶液呈深蓝色;下层为水层,溶液呈绿色。在酸性溶液中,过氧化氢与重铬酸钾反应生成蓝色的过氧化铬CrO5,反应式如下:
CrO5常温下在水中很不稳定,易分解成Cr3+和O2,在乙醚中稍稳定。
(2) 过氧化尿素的催化分解:用火柴余烬检验生成的气体时,产生的气体可以使火柴余烬复燃。反应式如下:
(3) 过氧化尿素的酸碱性:测得过氧化尿素的pH≈6(同去离子水)。振荡试管,可以观察到有白色的胶状沉淀生成,为生成的盐在乙醇中析出。反应式如下:

(4) 过氧化尿素的氧化性:振荡试管,有红棕色碘生成。反应式如下:

将试管直接放在水浴中,加热后产生黑色PbS沉淀。往沉淀中加入数滴过氧化尿素溶液,微热后生成白色PbSO4沉淀。反应式如下:



(5) 过氧化尿素的还原性:在试管中加入AgNO3溶液后滴加NaOH溶液,有棕色沉淀生成,反应式如下:

再滴加过氧化尿素溶液,有气体生成,用火柴余烬检验生成的气体,观察到产生的气体可以使余烬火柴复燃。另一支试管中不滴加NaOH溶液,无上述现象。
4 教学效果
本实验以无机制备、定性分析及定量分析的实验基本操作为基础,使学生在无机化学制备实验时能自行对产品进行准确分析和测定,不但提高了学生的实验兴趣,也培养了学生统筹安排时间的能力,提高了教学质量。本实验已在本校化学系本科生的化学实验课程中进行了教学实践,取得了良好的教学效果。
[1] 李秀玲,蔡吉清,曾秀琼,等.大学化学,2011,26(2):32
[2] 延秀银,张红霞.化工时刊,2009,23(2),40
[3] Grigoropoulou G,Clark J H,Elings J A.GreenChem,2003,5:1
[4] Dobado J A,Molina J,Portal D.PhysChemA,1998,102:778
[5] 欧阳贻德,唐正姣,何寿林,等.精细石油化工进展,2002,3(8):34
[6] 欧阳贻德,陈伯适.化学世界,2002,43(1):50
[7] 吴春燕,蔡敏.化工技术与开发,2011,40(6):13
[8] 王安奇,唐少红.辽宁化工,2001,30(9):414
[9] 戴小军,刘利军,丁园,等.印染,2004(3):4
[10] 梅允福.浙江化工,2000,31(1):17
[11] 王燕,皇甫慧君.应用化工,2006,35(9):691
[12] 北京大学化学与分子工程学院普通化学实验教学组.普通化学实验.第3版.北京:北京大学出版社,2012
[13] 徐伟亮.基础化学实验.第2版.北京:科学出版社,2010
Preparation of Urea Peroxide and H2O2Content Determination*
Cai Jiqing Li Xiuling**Zeng Xiuqiong He Qiaohong
(DepartmentofChemistry,ZhejiangUniversity,Hangzhou310058,Zhejiang,China)
The preparation of urea peroxide from urea and hydrogen peroxide and the determination of peroxide content are introduced in this paper. The results show that this experimental design is rational and can be used as a basic experiment in the comprehensive experimental course.
Urea peroxide; Peroxide Content; Oxidation-reduction properties; Potassium permanganate
O6-3;G64
国家基础科学人才培养基金(条件建设项目)研究项目(No.J1103301);浙江大学2013年度本科教学方法改革研究项目(Y-7)
**通讯联系人,E-mail:louyu@zju.edu.cn
