小鼠感染流感病毒后外周血IFN-α变化规律的研究
2015-12-07李艳宁秋韩德明姚海虹赵赫楠赵丽辉
李艳,宁秋,韩德明,姚海虹,赵赫楠,赵丽辉
(1.长春理工大学 校医院,长春 130022;2.辽源职业技术学院 医药分院,辽源 136200;3.长春理工大学 生命科学技术学院,长春 130022)
流感病毒与宿主的相互作用通常会产生宿主种间屏障作用抵御流感病毒的感染,导致流感病毒不能感染宿主。流感病毒感染宿主后,宿主表现出以呼吸器官损伤为主的病理过程,引起发病或死亡。病毒也可以在宿主体内复制但不发病,使宿主产生天然性免疫或适应性免疫,从而有效地抵御病毒的侵袭,因此宿主即使被病毒感染也不会表现其致病性,宿主体内的各种细胞因子影响了流感病毒的致病性[1,2]。
干扰素(interferon,IFN)是一种糖蛋白,是一种由淋巴细胞和单核细胞产生的细胞因子。人们目前已发现有α、β、γ三种类型的干扰素,I型的干扰素包括α型(IFN-α)和β型干扰素(IFN-β),IFN-α是由白细胞产生的,IFN-β是由成纤维细胞产生的,而γ型干扰素(IFN-γ)是由免疫系统中的自然杀伤细胞(NK细胞)和T细胞产生的[3]。IFN-α通过调控免疫应答来抑制病毒蛋白的合成,IFN-α和细胞膜上干扰素受体结合后,经过一系列的激活过程会诱导干扰素激活基因的转录,抑制病毒蛋白的合成,也可以通过激活促凋亡蛋白和细胞周期抑制蛋白产生抗病毒作用[4,5]。由干I型IFN-α/β参与的抗病毒感染天然免疫应答是机体在长期进化过程中形成的抵抗病毒入侵的主要防御机制之一,它在机体抗病毒侵染及诱导适应性免疫应答方面起着非常重要的作用[6]。处在流感病毒感染时期患者,最初在病毒感染的几小时之内即被诱导产生IFN-α/β,识别的过程是RNA病毒和胞内RIG-1受体和Toll样受体(TLRs)识别、结合,启动了干扰素应答反应。RNA病毒侵染的是呼吸道上皮细胞,通过识别维甲酸诱导基因I(RIG-1)胞内受体,激活天然免疫系统和哺乳细胞内抗病毒的干扰素通路,诱导I型干扰素的表达,最终清除感染部位的病毒[7,8]。这些研究进一步表明IFN-α/β在抗流感病毒感染、诱导天然免疫及适应性免疫过程中起着至关重要的作用[9-11]。
综上所述,为了进一步研究干扰素在机体抗流感病毒的作用,实验利用普通流感病毒鼻滴感染小鼠,通过测定小鼠外周血中IFN-α含量的变化,来研究普通流感病毒感染小鼠过程中IFN-α的变化规律及IFN-α抗病毒的作用机制,为进一步研制新型通用流感疫苗奠定实验基础。
1 实验材料与方法
1.1 实验材料、仪器
取感染普通流感病毒的患者的血液(患者血液来自长春理工大学校医院),于冰箱4℃保存。6-8周龄Balb/c小鼠(购于吉林大学基础医学院动物实验中心)。乙醚;1640培养基;无血清的DMEM液;IFN-α试剂盒;PBS缓冲液;酒精,聚肌胞Poly(I:C)(主要试剂购买鼎国生物技术有限公司)。超净工作台(FromaScientific);离心机;酶标仪;冰箱;滤菌器;高压锅;离心管;三孔电热恒温水槽(仪器购买上海齐欣科学仪器有限公司)。
1.2 实验方法
1.2.1 动物感染实验
将小鼠随机分为五组,其中设置两组对照组,分别为空白对照组和阳性对照组,剩下的三组分别为普通流感病毒的三个浓度实验组,记为C1组,C2组,C3组。每组小鼠8只,一共40只。小鼠在相同饲养条件下进行饲养。
各组小鼠用乙醚轻度麻醉后,空白对照组滴鼻无血清的DMEM液,阳性对照组滴鼻Poly(I:C)试剂,其余各组分别滴鼻含普通流感病毒的血液,设不同的浓度梯度。
1.2.2 小鼠血清收集与测定
小鼠感染 1d,2d,4d,6d后,断尾取血,离心3000r/min,15min,收集血清,血清置-20℃保存备用。
具体步骤:
(1)设置阴性、阳性、标准品和实验孔,标准品孔加不同浓度的标准品5μL;
(2)阴性、阳性和实验孔先加待测样本10μL,再加样本稀释液40μL;
(3)阴性、阳性孔和实验孔分别加入辣根过氧化物酶(HRP标记的检测抗原)100μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min;
(4)弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次;
(5)每孔加入底物A、B各50μL,37℃避光孵育15min;
(6)每孔加入终止液50μL,15min内,在450nm波长处测定各孔的OD值。
2 结果分析
普通流感病毒通过滴鼻感染小鼠,经过一周的观察,感染病毒的小鼠前三天精神萎靡,活动量少,之后活动量逐渐增加,进食量也有所增加,精神状态良好,恢复正常小鼠表现状态。小鼠滴鼻普通流感病毒1d,2d,4d,6d摘除眼球静脉取血,离心取上清液,ELISA双抗体夹心检测法检测血液IFN-α。
2.1 标准曲线的建立
根据干扰素ELISA试剂盒的要求,需要做标准曲线如图1所示。
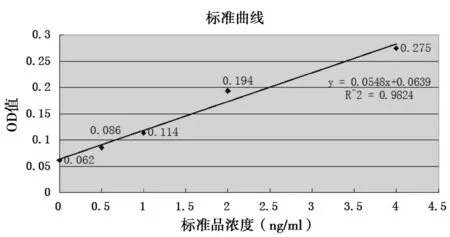
图1 干扰素ELISA试剂盒标准样品的OD值
由标准曲线图可知,样品的OD值与样品浓度成正比。图中标注了趋势线的方程以及方差值R2=0.9824,P<0.01,数据可信,根据标准曲线的方程可以推算出检测样品中IFN-α的含量。
2.2 感染病毒的小鼠血清中IFN-α含量的检测

图2 小鼠体内IFN-α的变化(▲为阳性,■实验组,◆阴性)
实验组小鼠分别滴鼻流感病毒为12.5mg/mL、25mg/mL、37.5mg/mL,1d,2d,4d,6d检测小鼠血清中IFN-α的含量。由图可以看出,阴性对照组中,小鼠体内的干扰素含量保持平衡,而实验组和阳性对照组出现随着感染时间的增加而出现一定的变化规律。在感染的2d,小鼠血清中的IFN-α含量达到最大值,4d时观察,血清中的IFN-α含量下降,到6d时,血清中的IFN-α含量逐渐回落到一定的水平。
阴性组滴鼻小鼠不同浓度的无血清培养液后,小鼠血液中的IFN-α的含量无明显的变化,说明DMEM无血清培养液进入小鼠体内后不会引起机体防御系统的应答,而阳性药物Poly(I:C)滴鼻进入小鼠体内后激活了机体防御系统产生了干扰素。Poly(I:C)导致小鼠血清中IFN-α含量变化随着时间的增加而增加,到2小时达到高峰,然后逐渐回落,第4天血液中的IFN-α含量逐渐降低,第6天血清中IFN-α的含量保持平衡水平。
3 讨论
流感病毒感染小鼠后的临床症状在很大程度上取决于病毒复制与宿主防御反应的平衡关系。流感病毒逃避宿主免疫应答的能力对其致病力是至关重要的[12]。宿主细胞通过模式识别受体(PRRs)识别病毒的病原体相关分子模式(PAMPs),迅速启动了由干扰素和相关的细胞因子介导的抗病毒反应,阻止了病毒的侵染[13]。通过分泌I型IFN-α并和受体结合,利用激活的JAK/STAT途径活化干扰素刺激因子产生抗病毒作用。目前,人们在对流感病毒的致病性进行研究的同时,也在研究宿主自身的抗病毒的作用,尤其对流行的高致病性流感病毒感染小鼠和非人类灵长类动物的研究,同时更多关注的是自身细胞诱导产生的多种细胞因子的抗病毒作用。由于细胞因子能调节炎症反应的进程和发展趋势,在调节免疫应答过程中、促进免疫细胞活化和清除病毒方面的作用非常重要。所以,为了研究I型IFN-α在抗病毒中的作用,实验选择感染流感病毒第三天的患者的血液,取血清给小鼠进行滴鼻实验。在低于12.5μL血清滴鼻实验时,干扰素IFN-α的变化的规律不明显,高于14μL小鼠死亡过半,为此选择12.5mg/mL、25mg/mL、37.5mg/mL三个浓度梯度进行试验。对滴鼻实验小鼠进行观察,分别在1d,2d,4d,6d断尾取血,通过ELISA实验发现第二天血清中的IFN-α含量达到最大值,然后开始下降,最后趋于平稳的表达水平,如图2所示。研究还发现不同量的普通流感病毒的感染小鼠机体后,检测小鼠机体感染不同时间后血液中IFN-α含量,同一剂量的普通流感病毒感染小鼠,小鼠血液中IFN-α含量随着时间的变化而变化,显现出随着时间增加IFN-α含量先增加再降低,然后维持在一定水平。实验结果表明普通流感病毒的感染会引发机体产生免疫反应,促使免疫细胞产生的干扰素通过细胞表面受体产生抗病毒的蛋白抑制了病毒的复制,增强了巨噬细胞、T淋巴细胞和自然杀伤细胞(NK细胞)的活力。实验结果为进一步研制新型通用流感疫苗奠定实验理论基础。
[1]Subhendu Kumar Otta.Host and virus protein interaction studies in understanding shrimp virus gene function[J].Indian J.Virol,2012,23(2):184-190.
[2]Shinichi Yokota,Tamaki Okabayashi,Nobuhiro Fujii.The battle between virus and host:modulation of toll-Like receptor signaling pathways by virus infection[J].Mediators of Inflammation,2010:1-12.
[3]卢年芳,黄爱龙.干扰素抗病毒作用的机制[J].国外医学:流行病学.传染病学分册,2003(4):226-228.
[4]Tetsuo Tsuchida1,Taro Kawai1,Shizuo Akira1.Inhibition of IRF3-dependent antiviral responses by cellular and viral proteins[J].Cell Research,2009(19):3-4.
[5]李小玮,陈泽婷,智绪亭.IFN-α诱导的信号传导通路的研究进展[J].前沿与进展,2012,15(7):548-551.
[6]王怡,周国平.干扰素调节因子3的激活[J].生命的化学,2010,30(4):523-527.
[7]Finlay McNab,Katrin Mayer Barber,Alan Sher,al et.Type I interferons in infectious disease[J].Nature Reviews Immunology,2015(15):87-103.
[8]Takeuchi O,Akira S.Innate immunity to virus infection[J].Immunological Reviews,2009(227):75-86.
[9]Takeuchi O,Akira S.MDA5/RIG-I and virus recognition[J].Current Opinion in Immunology,2008,20(1):17-22.
[10]孙文香,蒋争凡.病毒感染引发天然免疫细胞信号转导研究进展[J].中国细胞生物学学报,2013,35(5):1-11.
[11]游艳,肖建华,廖勇.干扰素抗病毒作用机制的研究进展[J].广东医学,2014,35(11):1795-1797.
[12]赵朴,郑玉姝,乔传玲,等.A型流感病毒逃避免疫应答的策略[J].生物化学与生物物理进展,2008,35(10):1137-1141.
[13]张煜,钟波,杨艳,等.TLRs与RLRs介导的细胞抗病毒反应信号转导及其调节机制[J].细胞生物学杂志,2009,31(4):453-468.
