常见食用植物油中亚油酸的检测方法研究
2015-12-06纪晓娜崔振峰张学伟陈国军张时嘉李冬媛
纪晓娜,崔振峰,张学伟,陈国军,张时嘉,李冬媛
(1.长春工程学院理学院;2.吉林省城市污水处理重点实验室,长春130012;3.北京同仁堂吉林参茸科技开发有限公司,吉林 白山135200)
0 前言
亚油酸是人体不能合成,但又必需的ω-6系列不饱和脂肪酸,具有降低血液中的过量胆固醇、增强细胞膜的透性、阻止心肌组织和动脉硬化的功能[1]。亚油酸要从膳食中补充,最好的途径就是食用植物油。食用植物油相对于动物油脂具有更少饱和脂肪酸而更多不饱和脂肪酸的优点,更利于健康[2]。食用油中不饱和脂肪酸的定量对于指导人们健康饮食具有重要意义[3]。采用气相色谱法(GC)可以对不饱和脂肪酸中的亚油酸高效分离、准确定量[4],尽管质谱(MS)是目前先进的检测器[5],但氢火焰离子化检测器(FID)以其33%的市场占有率更具有推广价值,因此本文选择了GC-FID的检测方法。
目前多以笼统的 n-6/n-3 表征食用油的品质[6],本论文以亚油酸为例寻找一种适合推广使用的检测植物油中不饱和脂肪酸的方法,将针对确定的不饱和脂肪酸直接定量。同时,不饱和脂肪酸含量也可以作为比较不同种类和产地食用油品质的一个指标,通过测试几种常见植物油中亚油酸的含量,为食用油中营养成分的比较提供数据参考。
1 实验部分
1.1 仪器和试剂
Agilent 6820气相色谱仪(FID检测器):美国安捷伦公司;Agilent DB-FFAP聚乙二醇毛细管柱(30m×0.25mm×0.25μm):使用温度为40~250℃,美国安捷伦公司;甲醇(色谱纯):山东禹王实业有限公司化工分公司;正己烷(色谱纯):天津市光复精细化工研究所;0.4mol/mL氢氧化钾—甲醇溶液:称取1.122g氢氧化钾,用甲醇溶解至50mL容量瓶中;亚油酸甲酯标准溶液(1 000mg):P.O.Box 295 109West Main St.,Elysian,MN 56028U.S.A.;十一酸甲酯标准溶液(100mg):P.O.Box 295 109West Main St.,Elysian,MN 56028U.S.A.。
1.2 色谱条件
采用程序升温:柱温为100℃,保持1min,再以15℃/min升到200℃ ,保持19min;载气(氮气):1.04mL/min;辅助气(氮气):23.92mL/min;FID的空气:260mL/min,氢气:26.08mL/min;不分流进样。亚油酸甲酯的保留时间19.0min,十一酸甲酯(内标)的保留时间7.0min。
1.3 标准曲线的制定
分别取亚油酸甲酯标准溶液10μL,20μL,30 μL,40μL,50μL于10mL容量瓶中,并分别加入100μL十一酸甲酯标准溶液,正己烷定容至刻度。根据峰面积比值(标准/内标)与质量浓度的线性关系,对质量浓度 100 μg/mL,200 μg/mL,300 μg/mL,400μg/mL,500μg/mL的混合标准溶液进行测定,采用内标法定量,以质量浓度为横坐标(C),亚油酸甲酯/十一酸甲酯的峰面积比为纵坐标(Y)(见表1)。

表1 亚油酸甲酯标样的回归方程,相关系数和检出限
1.4 甲酯化条件
准确称取样品若干克于10mL具塞比色管中,加入氢氧化钾—甲醇溶液(浓度为0.4mol/mL)使之甲酯化,40℃,超声波震荡,甲酯化反应时间为40 min,。再加入甲苯—正己烷(1︰1)混合溶液4 mL,在一定温度下超声振荡,移入分液漏斗中,比色管用正己烷洗三次,加入2mL二次水,摇匀,静置分层,重复三次萃取,取上清液于3 000r/min下离心6min,移取上清,并洗涤沉淀3次,一并转移,用正己烷定容到10mL,24h内检测。
2 结果与讨论
2.1 甲酯化条件的选择
由于亚油酸具有热不稳定性,所以在测定前要进行甲酯化。
甲酯化方法:准确称取样品于10mL具塞比色管中,加入催化剂和甲醇使之甲酯化,再加入甲苯—正己烷(1︰1)混合溶液4mL,在一定温度下超声振荡,移入分液漏斗中,比色管用正己烷洗3次,加入2mL2次水,摇匀,静置分层,重复3次萃取,取上清液于3 000r/min下离心6min,移取上清,并洗涤沉淀3次,一并转移,用正己烷定容到10mL,经微孔过滤(0.45μm)后待测。
2.1.1 甲酯化试剂的选择
分别使用氢氧化钾—甲醇溶液和硫酸—甲醇溶液作为亚油酸的甲酯化试剂(见表2和表3)。

表2 硫酸—甲醇的条件选择

表3 氢氧化钾—甲醇的条件选择
表2和表3表明,响应值越高说明甲酯化越完全,用0.4mol/mL氢氧化钾—甲醇溶液的甲酯化效果更好。因此本实验采用0.4mol/mL氢氧化钾—甲醇溶液作甲酯化试剂。
2.1.2 甲酯化时间的选择
甲酯化时间太短,亚油酸甲酯化不完全;时间太长,使酯化产物发生水解,则影响甲酯化效率。因此本实验对不同反应时间进行了比较(见表4)。

表4 甲酯化时间对甲酯化效率的影响
表4表明,40min的响应值最大,说明亚油酸甲酯化效率最高,因此本实验甲酯化时间用40min。
2.1.3 甲酯化后稳定性实验
取甲酯化后的溶液,分别在0、2、6、24h测试(见表5)。
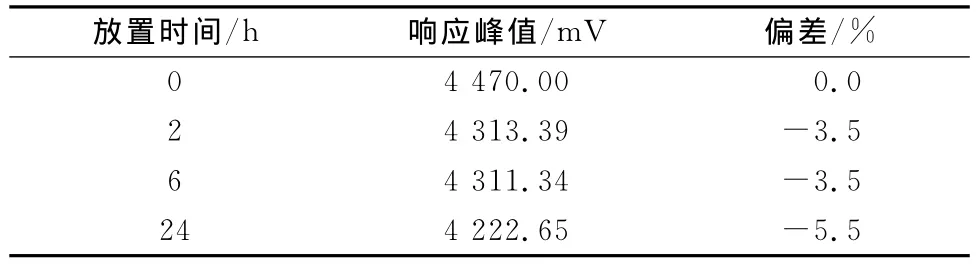
表5 亚油酸甲酯的稳定性试验
表5表明,甲酯化后的溶液在24h内基本稳定。
综上所述:本实验采用0.4mol/L氢氧化钾—甲醇溶液为甲酯化试剂,甲酯化时间为40min,甲酯化后尽快完成测试(24h内)。
2.2 植物油中亚油酸含量的测定
在超市内购得四种植物油:大豆油、花生油、玉米油和葵花仁油,经甲酯化前处理后进行测定,色谱图以花生油为例(见图1)。
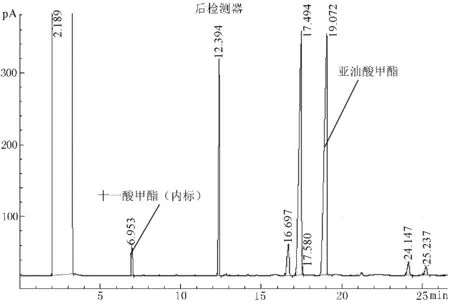
图1 花生油样品谱图
4种样品中亚油酸含量见表6。

表6 植物油中亚油酸的含量
结果显示,大豆油中亚油酸的含量最高,达到了267.54mg/g。
2.3 精密度的测定
连续5次检测样品得到亚油酸甲酯/十一酸甲酯的峰面积比值,计算相对标准偏差(见表7)。
2.4 回收率的测定
通过对各植物油样品中加入相当浓度的标准溶液进行加标回收实验考察方法的准确度(样品回收率见表8)。
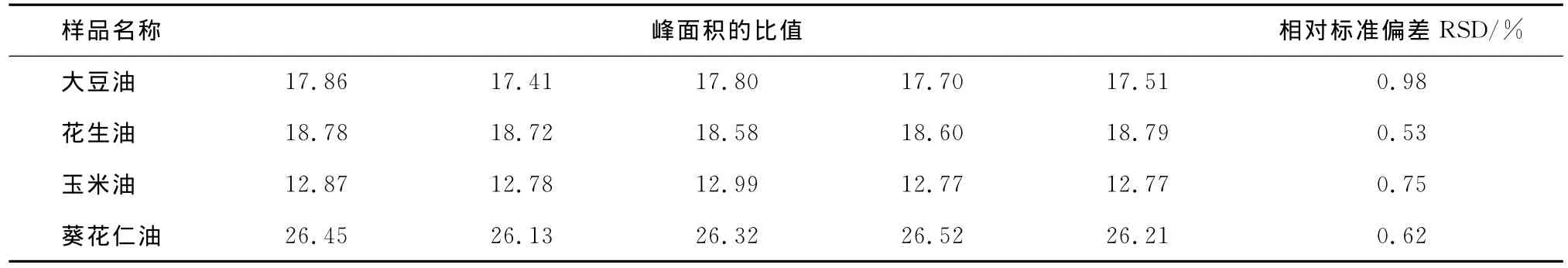
表7 测得油样品的亚油酸甲酯峰面积/十一酸甲酯峰面积的相对标准偏差

表8 植物油中亚油酸加标回收率
2.5 检出限
取100μg·mL-1的混合标准溶液进行多次稀释,至信噪比(S/N)为3,对应亚油酸甲酯的进样含量为0.001pg,因此该方法的最低检出限为0.001 pg(S/N=3)(见表1)。
3 结语
本论文确定了食用植物油中亚油酸甲酯化条件,并测定了目前市场出售的花生油﹑玉米油﹑葵花仁油和大豆油4种食用植物油中亚油酸的含量,其中以大豆油中亚油酸含量为最高,而葵花仁油含量最低,花生油和玉米油居中。该方法的检测范围宽、线性良好,相对标准偏差(RSD<1%)和回收率(96%~110%)均能满足检测要求。综上,该方法对仪器和实验条件要求不高,定量准确、精密度高,操作方便快捷,适合推广用于大批量样品的快速监督检测。
[1]杨春英,刘学明,陈智毅.15种食用植物油脂肪酸的气相色谱-质谱分析[J].食品科学,2013,34(6):211-214.
[2]魏永生,郑敏燕,耿薇,等.常用动、植物食用油中脂肪酸组成的成分分析[J].食品科学,2012,33(16):188-193.
[3]杨帆,薛长勇.常用食用油的营养特点和作用研究进展[J].中国食物与营养,2013,19(3):63-66.
[4]张涛,胡旭,程江南,等.食用油中多不饱和脂肪酸的含量及其不确定度的评定[J].食品安全质量检测学报,2015,6(4):1452-1458.
[5]金华,刘治刚,高艳,等.气相色谱-质谱法测定食用植物油中的脂肪酸[J].食品研究与开发,2015,36(10):107-109.
[6]陆颖,陈月晓,何梅,等.中国市售桶装植物油脂肪酸的研究[J].卫生研究,2012,41(3):445-448.
