湖南石门雄黄矿区矿样中的砷氧化细菌的分离及鉴定
2015-12-05杨宇白飞杨莉许庆邱冠周
杨宇,白飞,杨莉,许庆,邱冠周
1. 中南大学资源加工与生物工程学院,湖南 长沙,410083;2. 中南大学生物冶金教育部重点实验室,湖南 长沙,410083
湖南石门雄黄矿区矿样中的砷氧化细菌的分离及鉴定
杨宇1,2*,白飞1,杨莉1,许庆1,邱冠周1,2
1. 中南大学资源加工与生物工程学院,湖南 长沙,410083;2. 中南大学生物冶金教育部重点实验室,湖南 长沙,410083
绿色的生物学方法处理含砷废水,对于缓解工业发展所带来砷污染问题,提高居民健康生活质量具有重要意义。以湖南石门雄黄矿区的尾矿池积水(SY)、地下400 m处的矿坑水(NY)和尾矿池底泥表层(XY)3个样本为研究对象,利用细菌富集和多次传代的方法,从这3个环境样本中获得可氧化三价砷的3个菌群。在砷质量浓度为l~5 g·L-1的培养基中分别检测上述3个菌群的耐受能力,发现在砷质量浓度高达5 g·L-1的条件下,上述菌群均能在2~ 3 d内达到109cells·mL-1。利用上述菌群处理l g·L-1亚砷酸钠溶液,SY、XY和NY菌群可分别在25、20和35 h内将三价砷完全氧化,并且使溶液中的总砷质量浓度降低66.7%。进一步对3个菌群进行多次平板分离,利用五价砷和硝酸银的颜色反应,获得11株可氧化三价砷的目的菌株。对这些菌株16S rDNA进行NCBI的BLASTN序列比对发现,菌株SMY24、SMY33、SMY22、SMY32、SMY21和SMY31均属于假单胞菌属(Pseudomonas),菌株SMY104属于不动杆菌属(Acinetobacter),菌株SMY17、SMY25、SMY9和SMY1在所有的已知序列中,最大的相似率只有91%,最小的相似率为76%,且都是未曾报道纯培养的细菌。对这些菌株三价砷氧化能力进行测定发现,其中菌株SMY104和SMY21在20 h内能将三价砷几乎完全氧化。通过对这些菌株三价砷氧化酶基因进行初步检测,发现了多个菌株具有三价砷氧化酶基因(AoxB)。
湖南石门雄黄矿;三价砷;五价砷;砷氧化菌;三价砷氧化酶基因
砷是人类活动(如:贵金属采矿、药品生产、木材加工、玻璃制造工业以及电子工业等)(Han等,2003;Köhler等,2011)所产生大量化合物的组成成分之一,而砷在自然界中主要以硫化物的形式存在,如雄黄(As2S2)、雌黄(As2S3)、砷黄铁矿等(何振立等,1998)。众所周知,砷是一种非常有害的物质,能够引起包括癌症在内的多种疾病。世界卫生组织(WHO)在1993年所提出的最新饮用水含砷最低质量浓度标准也从1984年的50 µg·L-1降低到10 µg·L-1(世界卫生组织,2006)。湖南石门雄黄矿,是有着1500余年历史的亚洲最大的雄黄矿。它的开采,对当地的水源和土壤造成了重大污染。此外,其他一些有色金属硫化矿如砷黄铁矿和含砷金矿等的冶金过程,均会产生一定的含砷废水。世界上的许多国家都曾发生过含砷废水的不合理处置,导致大面积的砷中毒事件。
目前,水体修复主要采用沉淀法、絮凝法、吸附法、氧化法、离子交换法、膜分离法等方法去除砷,也都取得了较好的效果。由于物理化学方法较高的代价,且容易造成二次污染,因而运用高效绿色的生物方法来处理含砷废水具有重要意义。微生物对砷的适应性极强,甚至有的微生物以砷作为其生长的能源。微生物参与As(V)和A(III)之间氧化还原过程(Valenzuela等,2009)。As(III)的毒性最强,是As(V)的25~60倍,并且在多数的环境条件下较As(V)更难以被矿物质吸附(范成新等,2002)。因此,砷氧化菌在被用于处理富含三价砷的水体中具有潜在的应用价值。已有学者从土壤(宋卫锋等,2011)、沉积物(汪耀等,2010)及活性污泥(王薇等,2006)中分离、鉴定出具有砷氧化功能的菌株。与此同时,从土壤中分离到了氧化率可达99%的砷氧化细菌(莫于婷等,2009)。截止2001年,国外已发现了至少9个属的30多个菌株可以氧化砷,主要包括无色杆菌属(Achromobacter),假单胞菌属(Pseudomonas),产碱杆菌属(Alcaligenes),根瘤菌属(Rhizobium)等属,它们大多是异养砷氧化菌(Gihrin等,2001)。目前有关微生物除砷的理论和应用研究还处于起步阶段,因而如何运用高效绿色的生物方法来治理含砷废水还需要大量基础研究。
本文以湖南石门雄黄矿区的水样和泥样为研究对象,在前期对湖南石门雄黄矿区环境样品的细菌群落结构及其多样性进行研究(Yang等,2013)的基础上,从这些环境样品中分离、鉴定出多种可氧化三价砷的菌群和菌株及多个三价砷氧化酶基因,并且探讨了菌群和菌株对三价砷耐受性和氧化的规律,为今后开展含砷废水及土壤的生物修复提供一定的菌种资源及理论依据。
1 材料与方法
1.1 研究区概况
湖南石门雄黄矿是已开采了 2000多年的古矿,蕴藏量大、质量好,为我国现有药用雄黄的主产区之一。湖南石门雄黄矿位于石门县城西北界牌峪,直径 3 km,石(门)清(官渡)公路经过矿区,往东42 km接枝柳铁路石门站,往北9 km到沿市。采样区位于磺厂(图1)附近,地理坐标为:东经 29°38′11"~29°38′43",北纬 111°2′06"~111°2′23"。本区地处武陵山脉北西部的低山丘陵区,山脉近东西走向,地势西高东低,最高海拔444.5 m,最低161 m,一般相对高差200 m。区内水系发育,溪流呈梳状分布,流经的小河主要有黄水,向北7 km汇入澧水支流渫水河。本区属亚热带湿润季风气候,全年平均气温 16.7 ℃,年降水量1367 mm。居民主要种植水稻,副业有柑桔、油茶及林业。
图1 研究区位置图Fig. 1 The location of the research area
1.2 样品采集
湖南石门雄黄矿的2个水样样品(SY和XY)是用灭菌的塑料瓶直接在水面下约0.5 m处采集,盖上瓶盖,回实验室再分别用中速无菌滤纸过滤获得;雄黄矿的尾矿池底泥样品(NY)是用采样器在的表层2 cm处用多点混样的方法得到,放入封口袋密封。所有样品做好标签并4 ℃冰箱储存待用。
1.3 3个菌群和目的菌株的筛选
采用含20 mg·L-1亚砷酸钠的CDM培养基(Liao等,2011)的250 mL锥形瓶中分别接种10 mL的水样接种5 g泥样,泥样多加10 mL的无菌水。然后在25 ℃,170 r·min-1过夜进行培养,经3次以上的传代培养,使菌群稳定,获得所需的目的菌群。
对获得的 3个菌群(浓度可达到 2×107cells·mL-1)菌液分别均匀涂布在固体CDM培养基上,同样25 ℃过夜培养,待长出单菌落且不相接时,经过多次的平板划线分离,得到多个菌的纯培养并进行标记。通过采用定性硝酸银筛选法(qualitative AgNO3screening method)(Simeonova等,2004),通过五价砷可以和硝酸银的颜色反应,将得到具有三价砷的氧化能力的纯种菌株进行鉴定,即得到不同目的菌株。
1.4 3个菌群的三价砷耐受能力的测定
分别配制三价砷质量浓度为1、2、3、4、5 g·L-1的培养基100 mL,接种对数生长期细菌0.1 mL,每5 h镜检菌浓变化,以菌群的生长速度反映该菌群对三价砷的耐受能力,每组设3个平行实验。
1.5 3个菌群和目的菌株的三价砷氧化能力的测定
采用砷钼蓝法(周月雯,1990),在864 nm波长下用分光光度计检测,依据生成的终产物砷钼蓝的吸光度和砷质量浓度呈正相关的关系,制作标准曲线(见图2)。
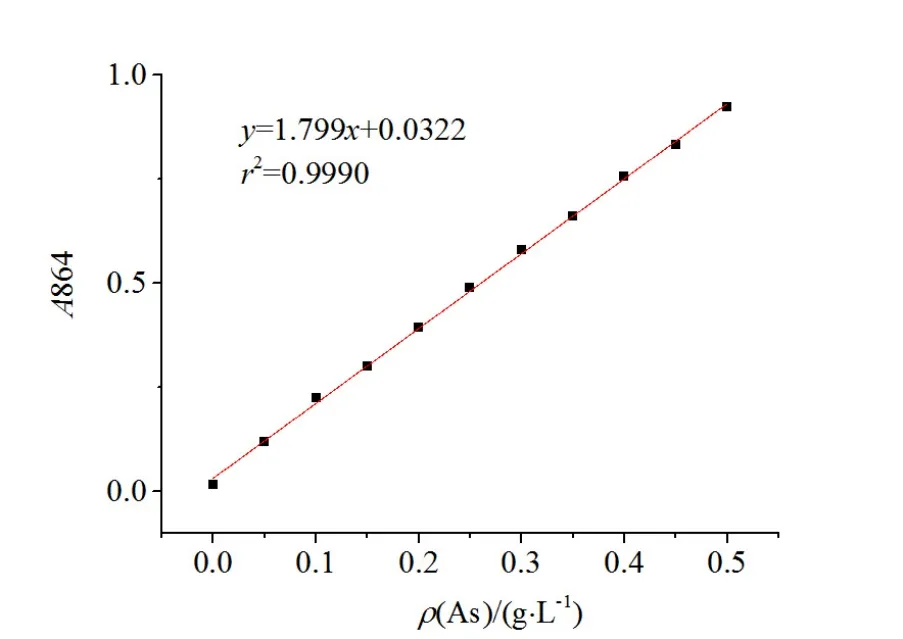
图2 砷质量浓度的标准曲线Fig. 2 The standard curve of arsenic mass concentration
根据原始样品砷质量浓度数据,采用0.6 g·L-1的三价砷质量浓度的100 mL培养基,接种对数生长期的菌液1 mL,每隔5 h检测培养基中三价砷、五价砷及总砷的质量浓度的变化。根据菌种对三价砷氧化速率及最终的氧化率,检测不同目的菌群的氧化能力。为测定目的菌株的三价砷氧化能力,配制l g·L-1亚砷酸钠溶液,并设计对照组(CK),每隔10 h测定溶液中三价砷质量浓度的变化。每组设3个平行实验。
1.6 目的菌株的鉴定
利用天根公司的细菌基因组DNA提取试剂盒提取目的菌株的基因组 DNA,用通用引物 27F,1492R(Deng等,2007)扩增细菌的16S rDNA基因序列。PCR扩增的程序为:94 ℃预变性5 min;94 ℃变性45 s;55 ℃退火45 s;72 ℃延伸90 s;返回至步骤2(共32个循环);72 ℃最后延伸10 min。将扩增产物进行回收和纯化。利用Rsa I和Msp I对16S rDNA基因扩增片段进行双酶切,经琼脂糖凝胶电泳检测,分析其带型。对典型带型的 16S rDNA克隆子进行测序,通过 NCBI的BLASTN进行序列比对,获得这些菌株相关的具体信息。
1.7 氧化砷基因的克隆
对具有氧化能力菌株中可能存在的 AoxB(Arsenic oxidase gene B)(Heinrich-Salmeron等,2011)进行克隆。采取巢式 PCR(Nested PCR)(Gundersen等,1996)和降落 PCR(Touchdown PCR)(Tran等,2014)结合方式对目的序列进行扩增。引物名称序列(Fan等,2008)如下:AoxA-F:5’-ACVTTCAASTGYCCHKGYCAYTTC-3’;AoxAR1:5’-TGRTTNAGRAARTARTTNGTYTG-3’;AoxB-F:5’-TGYCAYTTYTGYATHGTNGGNTG-3’;AoxB-R2:5’-TANGCNGGNCGRTTRTGDAT-3’。首先用AoxA-F和AoxA-R1进行第一轮巢式PCR,降落PCR程序为:95 ℃预变性15 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,(9个循环,每个循环降低1 ℃);94 ℃变性l min,46 ℃退火1 min,72 ℃延伸1 min,(25个循环);72 ℃最后延伸5 min;4 ℃,保存。再用AoxB-F和AoxB-R2以第1次PCR扩增的产物为模板,进行第2轮巢式PCR。
1.8 数据处理
采用Microsoft Excel和Origin Pro 9.0软件,对数据进行统计分析并作图。
2 结果与分析
2.1 目的菌株的筛选
将3个样品中的细菌经过多次的富集和平板分离,得到多种可能具有氧化三价砷能力的菌株。通过五价砷和硝酸银的颜色反应来判别培养菌株是否具有三价砷的氧化能力,筛选出具有三价砷的氧化能力的菌株(如图3所示)。

图3 三价砷氧化菌株的硝酸银颜色反应Fig. 3 The color reaction between strains and AgNO3

图4 SY菌群(a)、XY菌群(b)和NY菌群(c)的三价砷耐受能力Fig. 4 As(Ⅲ) tolerance ability for SY floras (a), XY floras (b), NY floras (c)
2.2 混合菌群的三价砷耐受能力的测定
将SY、XY和NY 3个样品经过富集培养并多次传代培养使菌群达到稳定,在三价砷质量浓度为l~5 g·L-1的培养基中培养,镜检菌种的生长情况如图4所示。SY菌群(a)在分别1、2和3 g·L-1的质量浓度下,菌群的增长速率基本相同,最高菌浓可达1.6×109cells·mL-1,在约70 h达到稳定期。在高于3 g·L-1的三价砷质量浓度时,菌种的生长速率明显降低,最高菌浓可达109cells·mL-1。对数生长期较长,在约120 h后才趋于达到稳定期。XY菌群(b)总体生长趋势和SY类似,但XY具有更高的三价砷耐受能力,能稍快地达到对数期。在低砷质量浓度时的最高菌浓可达2.0×109cells·mL-1,在高砷质量浓度的条件下,最高也可达 1.3×109cells·mL-1,在约50 h达到对数期。NY菌群(c)在低砷质量浓度时菌浓可达1.1×109cells·mL-1,随着砷质量浓度的增高,到达稳定期的时间逐渐增加,在最高砷质量浓度下前滞期约70 h。在约110 h的时候,菌浓也只有0.4×109cells·mL-1。因此,从最高的菌浓及高三价砷质量浓度下菌群的生长情况可知,XY具有最广泛的砷适应浓度,SY次之,NY最差。
2.3 混合菌群的三价砷氧化能力的测定
用3个菌群分别处理含有1 g·L-1亚砷酸钠溶液,根据各价态砷质量浓度制作曲线(图 5)。SY菌群(a)的处理的溶液中三价砷和总砷的质量浓度持续递减,三价砷在约 10 h氧化率便达到约75%,在约25 h三价砷被完全氧化。五价砷质量浓度在约前15 h内以相对较快的速度持续增加,之后逐渐降低。总砷质量浓度在约35 h降至最低,去除率约为 60%。XY菌群(b)处理该质量浓度溶液时,各价态砷质量浓度的降低相对于SY来说更快速。三价砷在约20 h就已被氧化完全。总砷质量浓度在约30 h降至最低,去除率约为67%。在一定的阶段内 NY菌群(c)的处理效果相对较差,曲线的趋势也较不同于前两者。三价砷在约35 h被氧化完全。五价砷的质量浓度基本呈一个递增的趋势。总砷质量浓度在约35 h降至最低,去除率约为66%。因此,在一定砷质量浓度下,XY菌群的氧化能力最强,其次为SY,最差的为NY。
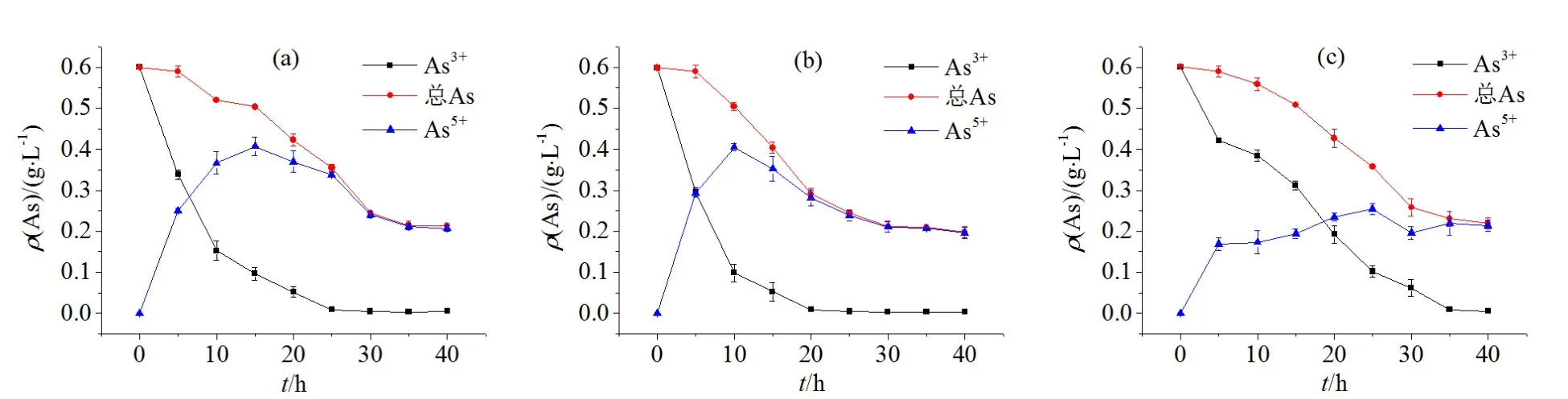
图5 SY菌群(a)、XY菌群(b)和NY菌群(c)的三价砷氧化速率Fig. 5 As(Ⅲ)-oxidating rate of SY floras (a), XY floras (b), NY floras (c)
2.4 目的菌株的鉴定
对分离得到的目的菌株,先进行16S rDNA扩增及测序,再通过NCBI的BLASTN软件进行序列比对,所得结果见表1。菌株SMY24、SMY33、SMY22、SMY32、SMY21和SMY31均属于假单胞菌属(Pseudomonas),SMY104属于不动杆菌属(Acinetobacter),SMY17、SMY25、SMY9和SMY1经NCBI比对,在所有的已知序列中,最大的相似率只有91%,最小的相似率为76%,且都是未曾报道纯培养的细菌。
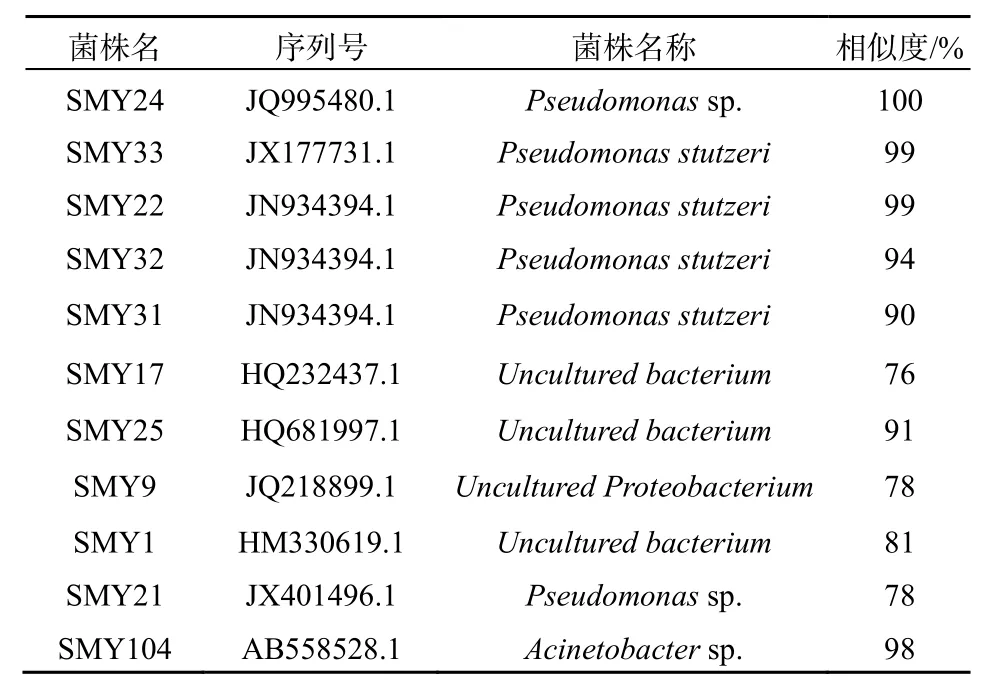
表1 目的菌株16S rDNA序列NCBI比对结果Table 1 The objective strains’ 16S rDNA sequence alignment results from NCBI
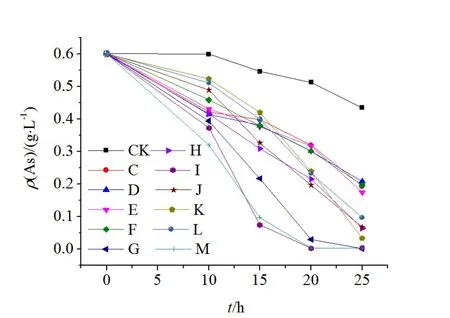
图6 目的菌株三价砷氧化能力Fig. 6 As(Ⅲ)-oxidating ability of the isolated objective strains
2.5 目的菌株氧化能力的检测
在一定砷质量浓度存在条件下,检测筛选出的目的菌株的三价砷氧化性。通过和CK比较(图6),可以知道所获得的目的菌株均可在一定程度上氧化三价砷,只是氧化的速度不同。
2.6 砷氧化酶基因的克隆
以目的菌株的基因组总DNA为模板,结合巢式PCR和降落PCR的方法,分别扩增目的菌株的三价砷氧化酶基因,经琼脂糖凝胶电泳检测分析所得结果(见图7)。分析检测结果,第1次PCR产物为一条大约1000 bp长度的DNA片段,第2次PCR产物为一条大约为700 bp左右长度的片段。大多数的筛选出的的目的菌株均可以成功扩增并克隆出三价砷氧化酶基因,但也存在个别菌株的PCR扩增结果没有条带,或者不存在目的条带。类似研究结果也被很多科学家发现(Deng等,2007;Anderson等,2004)。这可能与菌株自身的电子传递相关,或者是与物种自身中间代谢产物或最终代谢产物发生作用,起到类似于三价砷氧化酶的功能。
图7 目的菌株三价砷氧化酶基因的克隆Fig. 7 The As(Ⅲ) oxidase gene cloning of the isolated objective strains
3 结论
分别检测3个菌群进行砷耐受能力,在5 g·L-1亚砷酸钠溶液中培养,生长状态都相对较好。处理一定质量浓度的亚砷酸钠溶液时,三价砷快速被氧化,总砷的质量浓度也有显著的降低,随着时间的延长,总砷持续降低至一定质量浓度。从3个样品中共筛选到11株三价砷氧化菌,对其进行三价砷氧化能力的检测发现,它们都能在一定程度上将三价砷氧化为五价砷,只是氧化的速度不同,因此这些菌株为目的菌株。对这些菌株 16S rDNA通过NCBI的BLASTN序列比对发现,4株属于假单胞菌属(Pseudomonas),1菌株属于不动杆菌属(Acinetobacter),3菌株在所有的已知序列中,最大的相似率只有91%,最小的相似率为76%,且都是未曾报道纯培养的细菌。通过对目的菌株的三价砷氧化酶基因进行初步检测,发现了多个菌株具有三价砷氧化酶基因(AoxB)。上述菌株的分离纯化及鉴定工作,为下一步开展含砷废水的生物处理以及砷污染土壤的生物修复等工作奠定了基础。
ANDERSON C R, COOK G M. 2004. Isolation and characterization of arsenate-reducing bacteria from arsenic contaminated sites in New Zealand[J]. Current Microbiology, 48(5): 341-347.
DENG W, WANAPAT M, MA S, et al. 2007. Phylogenetic analysis of 16S rDNA sequences manifest rumen bacterial diversity in Gayals (Bos frontalis) fed fresh bamboo leaves and twigs (Sinarumdinaria)[J]. ASIAN AUSTRALASIAN JOURNAL OF ANIMAL SCIENCES, 20(7): 1057-1066.
FAN H, SU C, WANG Y, et al. 2008. Sedimentary arsenite-oxidizing and arsenate-reducing bacteria associated with high arsenic groundwater from Shanyin, Northwestern China[J]. Journal of Applied Microbiology, 105(2): 529-539
GIHRING T M, BANFIELD J F. 2001. Arsenite oxidation and arsenate respiration by a new Thermus isolate[J]. FEMS microbiology letters, 204(2): 335-340.
GUNDERSEN D E, LEE I M. 1996. Ultrasensitive detection of phytoplasmas by nested-PCR assays using two universal primer pairs[J]. Phytopathologia mediterranea, 35(3): 144-151.
HEINRICH-SALMERON A, CORDI A, BROCHIER-ARMANET C, et al. 2011. Unsuspected diversity of arsenite-oxidizing bacteria as revealed by widespread distribution of the aoxB gene in Prokaryotes[J]. Apply Environ Microbiol. 77(13): 4685-92.
KÖHLER M, HOFMANN K, VÖLSGEN F, et al. 2001. Bacterial release of arsenic ions and organoarsenic compounds from soil contaminated by chemical warfare agents[J]. Chemosphere, 42(4): 425-429.
LIAO V H C, CHU Y J, SU Y C, et al. 2011. Arsenite-oxidizing and arsenate-reducing bacteria associated with arsenic-rich groundwater in Taiwan[J]. Journal of contaminant hydrology, 123(1): 20-29.
SIMEONOVA D D, LIEVREMONT D, LAGARDE F, et al. 2004. Microplate screening assay for the detection of arsenite-oxidizing and arsenate-reducing bacteria[J]. FEMS Microbiology Letters, 237(2): 249-253.
TRAN T, NAPIER G, ROWAN T, et al. 2014. Development and evaluation of an ITS1 “Touchdown” PCR for assessment of drug efficacy against animal African trypanosomosis[J]. Veterinary parasitology, 202(3): 164-170.
VALENZUELA C, CAMPOS V L, YAÑEZ J, et al. 2009. Isolation of arsenite-oxidizing bacteria from arsenic-enriched sediments from Camarones River, Northern Chile[J]. Bulletin of environmental contamination and toxicology, 82(5): 593-596.
World Health Organization. 2006. Guidelines for drinking-water quality: First addendum to volume 1, Recommendations[M]. World Health Organization.
YANG Y, YANG L, XIANG X M. 2013. Bacterial diversity and community structure analysis for two samples of mine drainage from Shimen Realgar Mine, China[J]. Advanced Materials Research, 641: 246-252.
范成新, 张路, 杨龙元, 等. 2002. 湖泊沉积物氮磷内源负荷模拟[J]. 海洋与湖沼, 33(4): 370-378.
何振立, 周启星, 谢正苗. 1998. 污染及有益元素的土壤化学平衡[M].中国环境科学出版社: 147-160.
莫于婷, 宋卫锋, 孙国萍, 等. 2009. 土壤中砷氧化细菌的分离及其培养条件研究[J]. 广西轻工业, 2: 046.
宋卫锋, 罗丽丽, 林梓河, 等. 2011. 广东鼎湖山土壤中砷氧化菌的分离与鉴定[J]. 安徽农业科学, 39(5): 2715-2717.
汪耀, 涂书新, 王革娇. 2010. 亚砷酸氧化菌 Sinorhizobium sp. GW3 的鉴定与亚砷酸氧化酶基因的分离[J]. 湖北农业科学: 49(1).
王薇, 王君琴, 杨洁, 等. 2006. 三价砷氧化菌株的筛选及其培养条件初探[J]. 中国地方病学杂志, 25(1): 96-98.
周月雯. 1990. 砷钼蓝法测定三价砷和五价砷[J]. 环境保护科学, 16(4): 45-47.
Isolation and Identification of Arsenic-oxidizing Bacteria from Shimen Realgar Mine, Hunan
YANG Yu1,2*, BAI Fei1, YANG Li1, XU Qing1, QIU Guanzhou1,2
1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China; 2. Key Laboratory of Biometallurgy, Ministry of Education Central South University, Changsha 410083, China
With the rapid industrialization, especially the arsenic containing gold ore mining, arsenic contamination has become a universal concerned eco-environmental problem. How to make better use of a rapid and green approach in biology to disposal of arsenic wastewater could be of great value in relieving arsenic contamination brought by industrial development, improving residents' quality of life and improving human settlements. In the present study, three samples were used as the research objects, which were collected from the water of tailings pond (SY), mine drainage from the mine tunnel 400 m below the surface (XY) and the sediment of tailings pond (NY) in the Shimen Realgar Mine, respectively. Three kinds of As(Ⅲ)-oxidizing microfloras were obtained from these three samples by enrichment culture with arsenic containing medium and subculture after several generation. The As(Ⅲ) tolerance ability was determined in the medium with l~5 g·L-1of arsenic. Results showed that the cell density of these microfloras reached 109cells·mL-1within 2~3 d under 5 g·L-1of arsenic. Results also showed that the solution containing 1 g·L-1of sodium arsenite could be completely oxidized by SY, XY and NY within 25 h, 20 h and 35 h respectively, with the decrease of total arsenic mass concentration by 66.7%. 11 As(Ⅲ)-oxidizing bacteria were obtained from those microfloras by repeated plate streaking and qualitative AgNO3screening method. The 16S rDNA of these strains were examined by sequence alignment of the BLASTN in NCBI. Results showed strains SMY24, SMY33, SMY22, SMY32, SMY21 and SMY31 are Pseudomonas, SMY104 is Acinetobacter. of all known sequences, the maximum rate of sequence similarity of SMY17, SMY25, SMY9 and SMY1 is only 91%, while the minimum is 76%, indicating they are pure culture bacteria that never been reported. By measuring the As(Ⅲ)-oxidizing ability of each strain, results showed SMY104 and SMY21 could completely remove As(Ⅲ) within 20 h. Preliminary tests for the As(Ⅲ) oxidase gene showed that most of these strains had the arsenic oxidase gene (AoxB).
Shimen realgar mine in Hunan; As(Ⅲ), As(Ⅴ); arsenic-oxidizing bacteria; arsenic oxidase gene
X172
A
1674-5906(2015)01-0133-06
10.16258/j.cnki.1674-5906.2015.01.020
杨宇,白飞,杨莉,许庆,邱冠周. 湖南石门雄黄矿区矿样中的砷氧化细菌的分离及鉴定[J]. 生态环境学报, 2015, 24(1): 133-138.
YANG Yu, BAI Fei, YANG Li, XU Qing, QIU Guanzhou. Isolation and Identification of Arsenic-oxidizing Bacteria from Shimen Realgar Mine, Hunan [J]. Ecology and Environmental Sciences, 2015, 24(1): 133-138.
国家重点基础研究发展计划(“973”计划)项目(2010CB630901);教育部新世纪人才项目(NCET-07-0869)
杨宇(1972年生),男,副教授,博士,主要从事环境微生物学研究。Email:csuyangyu@ csu.edu.cn;*通讯作者
2014-09-28
