潮间带湿地碳循环及其环境控制机制研究进展
2015-12-05仲启铖王开运周凯来琦芳
仲启铖,王开运,周凯,来琦芳*
1. 中国水产科学研究院东海水产研究所盐碱地渔业工程技术研究中心,上海 200090;2. 华东师范大学上海市城市化生态过程和生态恢复重点实验室,上海 200241
潮间带湿地碳循环及其环境控制机制研究进展
仲启铖1,2,王开运2,周凯1,来琦芳1*
1. 中国水产科学研究院东海水产研究所盐碱地渔业工程技术研究中心,上海 200090;2. 华东师范大学上海市城市化生态过程和生态恢复重点实验室,上海 200241
有高等植被覆盖的潮间带湿地(红树林沼泽、盐沼)植被生产力高,有机碳分解速率低,CH4排放较弱,碳沉积速度快,是单位面积碳封存速率最高的生态系统之一。作为全球“蓝色碳汇”的主要贡献者,潮间带湿地在减缓含碳温室气体排放,降低全球温室效应方面具有重要潜力。潮间带湿地大多地处经济发达和人口密集的河口海岸地区,近年来其碳汇功能受到了越来越多人为干扰的威胁,正在发生着的气候变化则更增加了这种碳汇功能的不确定性。在全球变化背景下,对潮间带湿地碳循环及其环境控制机制的深入了解可以帮助更好地管理这种具有重要碳减排潜力的生态系统。文章综述国内外的相关研究,分析了潮间带湿地碳循环的基本过程和环境影响因素,探讨了多种人为干扰和气候变化要素对潮间带湿地碳循环的影响。潮间带湿地碳循环的基本过程主要包括垂直方向土壤(水)-大气界面和植被-大气界面CO2、CH4交换和沉积过程驱动的碳封存,以及水平方向与近海的碳交换。潮间带湿地的碳循环主要受潮汐/流、光合有效辐射、温度、盐度、水位、植物群落特征等非生物和生物因素的影响。围垦、富营养化、放牧很可能削弱潮间带湿地的碳汇功能,而外来植物入侵却可能在一定程度上增加其碳汇潜能。海平面上升、气温升高会增加潮间带湿地碳汇功能的脆弱性,CO2浓度升高的作用依赖于优势植物群落的光合作用途径,而多种并存气候变化要素的作用则更为复杂。全球范围内大量潮间带湿地已经遭受破坏甚至丧失,水文调控是对受损潮间带湿地碳汇功能进行修复和重建的有效措施。未来的研究需要更好的理解多种并存气候变化要素,及人为干扰和气候变化同时存在对潮间带湿地碳循环的交互效应,利用过程模型预测不同人为干扰和气候变化情境下潮间带湿地碳收支变化规律,并完善受损潮间带湿地碳汇功能修复的基础理论和实施方法。
潮间带湿地;碳循环;碳汇;气候变化;人为干扰
IPCC报告显示,由于化石燃料的大量使用和土地利用的急剧变化,从 1750年开始,大气中含碳温室气体(CO2、CH4)浓度持续增加,到 2011年,大气中CO2、CH4的体积分数已达到319×10-6、1803×10-9,分别比工业革命前上升40%和150%。在1880年到2012年间,陆地与海洋表面的气温已经升高了0.85 ℃,到21世纪末,全球温度可能超过 1850─1900年水平 1.5 ℃甚至更高(IPCC,2013)。为避免气候变化给人类生存和发展带来的潜在威胁,碳减排(carbon mitigation)是当前最迫切的工作,而保育和修复包括森林和湿地在内的各种具有碳汇功能的生态系统是其中的重要措施之一。
近年来,作为全球“蓝色碳汇”的主要贡献者,有高等植被覆盖的潮间带湿地(红树林沼泽和盐沼)的碳循环受到了极大的关注(Chmura等,2003; Moffett等,2010;Laffoley和Grimsditch,2009;Mcleod等,2011)。盐沼广泛存在于世界中高纬度地区滨海淤泥质海岸的潮间带(Chmura等,2003;Friess等,2011),以温带分布最为广泛,其植被类型以多年生维管束草本植物为主;据不完全统计,全球现存盐沼的面积约为 0.22×106km2(Laffoley和Grimsditch,2009)。而在大部分亚热带和热带地区的潮间带,红树林沼泽取代了盐沼,其植被类型以红树植物为主体的常绿灌木或乔木为主(Mitsch和Gosselink,2000),最新的数据清单表明全球现存红树林面积约为 0.152×106km2(FAO,2007)。
尽管全球潮间带总面积比陆地森林要小1~2个数量级,但是其单位面积的碳封存能力却不容忽视(Mcleod等,2011)。除了拥有高植被生产力和低有机质分解速率以外,潮间带湿地植被的根冠比较大,大量碳被储存在地下生物量及通过根系周转而储存在土壤中。潮间带湿地较高SO42-含量还可以限制厌氧微生物产生CH4(Bartlett和Harriss,1993)。最关键的是,河口海岸独特的泥沙沉积过程会将大量内源或外源有机碳快速掩埋(Chapman,1977)。因此,潮间带湿地的碳汇功能通常比较显著(Livesley和 Andrusiak,2012)。据统计,全球范围内红树林沼泽、盐沼和海草床的总碳封存速率超过100 Tg·a-1(以C计),因此潮间带湿地在减缓含碳温室气体排放,降低全球温室效应方面具有重要潜力(Hopkinson等,2012)。
然而,过去一个世纪,随着河口海岸地区的人口迅速增长和经济快速发展,潮间带湿地受到了严重的人为干扰,大量被破坏及丧失(Kirwan和Megonigal,2013)。据估计,世界范围内有高等植被覆盖的潮间带湿地正以每年 1%~7%的速率丧失(Hopkinson等,2012)。在我国,近几十年来也有大量潮间带湿地由于港口和住宅区的建设而消失,或被转为种植业和水产业用地(He等,2014)。这些人为干扰给潮间带湿地的碳汇功能带来了极大威胁(Pendleton等,2012)。同时,多种气候变化要素也增加了潮间带湿地碳汇功能的不确定性(Hopkinson等,2012)。因此,了解潮间带湿地碳循环的基本过程和环境影响因素,探讨人为干扰和气候变化对植被光合、土壤呼吸、生态系统净碳交换等碳循环过程的影响,对于预测未来潮间带湿地碳收支的变化趋势,加强对其碳汇功能的可持续管理与利用具有重要意义。
本文主要关注有高等植被覆盖的潮间带湿地,综述了国内外的相关研究,初步总结了潮间带湿地碳循环的基本过程,评述了这些过程的主要特征和关键影响因素,重点分析了人为干扰和气候变化对潮间带湿地碳汇功能的潜在影响,介绍了保育或修复受损潮间带湿地碳汇功能的主要手段,并提出了未来潮间带湿地碳循环的研究重点。在全球变化背景下,对潮间带湿地碳循环及其环境控制机制的深入了解可以帮助更好地管理这种具有重要碳减排潜力的生态系统。
1 潮间带湿地碳循环的基本过程
潮间带湿地碳循环涉及一系列发生在不同时空尺度上的过程,其涵盖时间从短期到长期,涵盖空间从个体到景观。
其中与CO2有关的过程包括1)净生态系统CO2交换(NEE:Net ecosystemexchange of CO2):表示生态系统和大气之间的CO2交换量。一般定义当生态系统净固定CO2时,NEE为负值;净排放CO2时,NEE为正值。2)净生态系统生产力(NEP: Net ecosystem productivity):表示生态系统通过光合作用净固定大气中CO2的能力,NEP和NEE在数值上相等。3)总生态系统生产力(GEP:gross ecosystem productivity):是减去光呼吸后单位时间内生态系统光合同化CO2的量,决定了进入生态系统的初始碳量。4)总初级生产力(GPP:gross primary productivity):表示植被同化的有机碳总量,又称总第一性生产力,在生态系统尺度上,可以认为GPP与GEP相等。5)生态系统呼吸(Re:Ecosystem respiration):表示生态系统所有组分的总CO2排放量,主要包括植物地上部分呼吸(Ra:Aboveground plant respiration)和土壤呼吸(Rs:Soil respiration)。6)净初级生产力(NPP:Net primary productivity):表示植被同化的有机碳扣除其本身呼吸产生的CO2,用于植被的生长和生殖,也被称为净第一性生产力。
以上过程主要涉及发生在潮间带湿地土壤(水)-大气界面和植被-大气界面垂直方向的CO2交换(FCO2),另外,在这些界面也可能同时存在CH4交换(Matthews和Fung,1987)。除了垂直方向的气态碳交换以外,土壤中可溶性有机碳(DOC)和可溶性无机碳(DIC),及颗粒有机碳(POC)也会随着潮汐/流迁移进出潮间带湿地而形成水平方向碳交换(Flc),并在潮间带湿地的碳收支中占据重要地位(Wetzel,1992;Stern等,2007;Guo等,2009)。
对于潮间带湿地,河口海岸潮汐/流介导的碳沉积实现了在垂直方向的碳封存(Fsq),这个过程会使大量碳在短时间内离开碳循环而被掩埋在沉积物中。这种潮汐/流驱动的碳封存是潮间带湿地与内陆湿地碳获取方式的重要区别之一(Chapman,1977)。
综上,潮间带湿地的碳收支可以用下式表示:
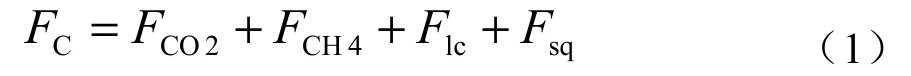
上式也可以演变成下式:
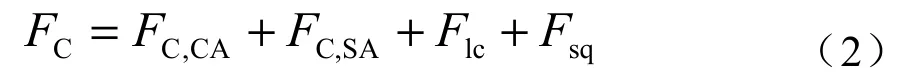
其中:

而:

式(2)中,CA和SA分别表示植被-大气界面和土壤(水)-大气界面的CO2和CH4交换。
2 潮间带湿地碳循环的特征及其影响因素
2.1 潮间带湿地碳循环的主要特征
盐沼和红树林沼泽的生产力都很高,可以媲美生产性的农业用地(Odum,1971)。不同地区盐沼植被地上生产力有很大差异,在北美地区,盐沼植被的地上生产力范围可从加拿大北部和阿拉斯加的60 g·m-2·a-1(以C计)到中北墨西哥湾的812g·m-2·a-1(以C计)(Mendelssohn和Morris,2002)。盐沼植被的根冠比较大(1.4~50),有大量的初级生产力被储存在地下生物量中,进而通过根系周转进入土壤碳库(Smith和 DeLaune,1983)。盐沼植被根冠比一般大于淡水沼泽,这有利于其垂直方向的碳积累(Murphy等,2009)。另外,盐沼中的光合微生物和浮游植物同样是初级生产力的重要来源(Sullivan和Currin,2002)。对于红树林沼泽,据 Bouillon等(2012)估算,全球范围红树林沼泽平均NPP大约为1360 g·m-2·a-1(以C计),其碳积累也主要通过地下生物量的分解和周转实现。
尽管潮间带湿地的土壤碳含量偏低,但由于这类湿地土壤容重较大,故其土壤碳密度往往相当可观(Laffoley和 Grimsditch,2009)。潮间带湿地的土壤碳动态还具有其特殊性。一方面,潮间带湿地淹水程度通常会伴随潮汐而变化,使土壤有机碳分解也产生与潮汐协同的周期性(Guo等,2009;马安娜等,2011)。另一方面,潮间带湿地土壤中SO42-含量一般较高,在通气性较差的土层,高SO42-含量会限制产CH4细菌的活性而降低CH4产生;较深不饱和土层产生的CH4也可能会在向上传输的过程中被氧化(Bridgham等,2006)。因此,潮间带湿地的 CH4排放通常较弱(Forster等,2007;Poffenbarger等,2011)。另外,由于河口海岸潮汐/流驱动的沉积过程对碳的掩埋作用,潮间带湿地的碳封存速率可达到北方泥炭沼泽的 10倍以上(Chmura等,2003)。
因此,潮间带湿地植被生产力高,有机碳分解速率低,CH4排放较弱,碳沉积速度快,是单位面积碳封存速率最高的生态系统之一(Chmura等,2003;Donato等,2011;Hopkinson等,2012)。潮间带湿地大部分稳定形态的碳储存在土壤中(78%~99%)。据Chmura等(2003)估算,在全球范围内至少有430 Tg碳储存在盐沼表层0~50 cm的土壤中;红树林沼泽同一土层碳储量则可以达到(5000±400)Tg C。
潮间带湿地还会将部分同化碳以多种形式输出到近岸海域中,从而形成水平方向的碳通量(Richard,1982)。Teal(1962)估测有 45%的盐沼生物量会通过潮汐作用进入近岸海域以支持其较高的动物多样性。对于红树林沼泽,DIC随潮汐从系统中迁出可能尤为重要,Bouillon等(2012)预测这一水平碳通量能达到红树林初级生产力的一半。另外,红树林沼泽还是海洋中DOC的主要来源(Dittmar等,2006)。
2.2 潮间带湿地碳循环关键影响因素
潮汐/流、光合有效辐射、温度、盐度等是影响潮间带湿地碳循环的关键非生物因素。潮汐/流可以通过沉积物的供给直接影响潮间带湿地碳封存能力(Chmura等,2001),还可以通过周期性淹水直接作用于植被生产力(Ewanchuk和 Bertness,2004)和土壤呼吸(Barr等,2010),或通过影响营养物质可用性、土壤温度、盐度和氧化还原电位等环境因素间接作用于这些碳过程(Armstrong等,1985;Pennings和Callaway,1992)。Guo等(2009)采用涡度协方差技术观测了上海崇明东滩盐沼植被—大气界面CO2通量,发现其在10~20 d的时间尺度上表现出由潮汐驱动的规律性变化。Kathilankal等(2008)在美国弗吉尼亚东海岸互花米草盐沼发现潮汐淹水会使 CO2通量下降(46%±26%)。Moffett等(2010)研究认为,潮汐对盐沼-大气界面 CO2通量的影响是周期性的,持续短暂但却作用强烈。
在有高等植被覆盖的潮间带湿地,光合有效辐射的强度直接决定植被碳同化能力的强弱。光合有效辐射的变化往往驱动植被生产力的昼夜和季节变化。光合有效辐射越大,潮间带湿地NEP也越大,两者通常展现出良好的非线性正相关(Guo等,2009;Zhou等,2009;马安娜等,2011)。
作为酶促反应,潮间带湿地植物自养呼吸对温度变化有很强的敏感性,温度变化会通过影响植物自养呼吸而改变湿地NPP。另外,潮间带湿地土壤呼吸的温度敏感性也很强,通常会随温度增加而呈指数型增长,温度变化往往驱动土壤呼吸的日变化和季节变化(Zhong等,2013)。Kirwan和Blum(2011)在美国弗吉尼亚州盐沼研究发现,温度每升高 1 ℃会将互花米草凋落物的分解速率提高12%。聂明华等(2011)在长江口的研究则发现,土壤呼吸季节变化是温度以及近岸水体盐度季节变化协同作用的结果。
高盐度是潮间带湿地的独特环境因素,过高的盐度会通过渗透压胁迫使植物失水,只有适应高盐度的植物才能存活,并形成潮间带湿地多样的植物分布格局和生产力状况(Heinsch等,2004)。Barr等(2012)研究发现,红树林沼泽的光利用效率在高盐度(>34 ppt)比低盐度(<17 ppt)低46%。Neubauer(2013)在美国南卡莱罗那潮间带湿地通过原位试验发现,盐度增加会使NEP降低55%。另外,盐度增加也会通过渗透压胁迫抑制土壤微生物活性而降低有机质分解速率(Wichern等,2006)。潮间带湿地盐度和土壤水分对 NEP的作用可能耦合在一起,Heinsch等(2004)研究发现美国德克萨斯湾的潮间带湿地在盐度较低、土壤水分较高的情况下固定CO2,而在盐度较高、土壤水分较低的情况下则排放CO2。
植被则是影响潮间带湿地碳循环的关键生物因素,Rothman和Bouchard(2007)对比了美国俄亥俄州伊利湖沿岸芦苇、香蒲(Typha spp.)和宽叶慈姑(Sagittaria latifolia)3种植物群落的碳动态,发现慈姑被另外两种植物取代会显著影响该湿地的碳循环。植物群落的空间差异会导致潮间带湿地碳汇功能的空间变异(Guo等,2009)。Magenheimer等(1996)研究发现,植被生物量和水位可以共同解释盐沼CO2通量 63%的变异。另外,多种湿地植物的气生组织也是温室气体排放的重要通路(Ford等,2012)。
潮间带湿地 CH4排放受到植物生物量、水位、温度、盐度和SO42-含量等环境因素的影响。植物生物量和 CH4排放之间通常具有较强的正相关性(Whiting等,1991)。水位决定了土壤缺氧状况,而温度决定了微生物活性,在相似水位下,温度越高,CH4排放量越大(Bartlett等,1985)。CH4排放不仅受水位影响,还随盐度变化而改变(King和Wiebe,1978;DeLaune等,1983)。在芬迪湾的盐沼,当水位较高且盐度较低时,CH4释放量较高,CH4排放量和盐度呈显著负相关(Magenheime等,1996)。原位试验表明CH4的产生对SO42-含量很敏感,高浓度SO42-会显著限制CH4的产生(DeLaune等,1983)。
3 人为干扰对潮间带湿地碳循环的影响
尽管潮间带湿地具有卓越的碳汇功能,然而这种重要的生态功能却可能会由于各种人为干扰(围垦等土地利用变化、生物入侵、富营养化、放牧等)而退化或丧失(Farnsworth和 Ellison,1996;Pendleton等,2012)。受损潮间带湿地的碳库规模会迅速降低,Pendleton等(2012)估算表明盐沼、红树林沼泽及海草床在全球尺度上每年有150~1020 Tg C因为土地利用变化而释放到大气中,这一数字等同于全球森林砍伐导致碳排放的3%~19%,造成经济损失每年可达60~420亿美元。然而,到目前为止,人为干扰导致潮间带湿地的碳损失没有被包括在任何碳排放核算和市场协议中。近几十年来,人口迅速增长和经济快速发展对工农业用地的需求使全球海岸带地区的土地利用发生着剧烈的变化(Kirwan和Megonigal,2013)。作为获取新生土地资源的重要手段,围垦(land reclamation)是对潮间带湿地影响最大的人为干扰方式。以中国为例,Yang和Chen(1995)指出中国在近现代被围垦盐沼面积大约为1.167×105hm2,超过 1995年中国拥有盐沼的总面积。除了直接导致潮间带湿地面积的快速下降,围垦还会显著改变其多种碳循环过程。一方面,围垦区不再受潮汐活动的影响,水位下降,厌氧环境减弱,土壤微生物群系的结构和活性均会发生变化,好氧微生物活性加强会加速有机质分解,使湿地在围垦前封存于土壤的碳大量排放。一项在杭州湾的研究发现,2003年围垦区土壤有机碳含量显著低于天然盐沼所有植被类型(邵学新等,2011)。对西班牙冲积沼泽的研究也发现围垦显著降低了土壤总有机碳、微生物碳和土壤酶活性,并增加了土壤微生物的呼吸商(Laudicina等,2009)。另一方面,围垦区的盐水动态也会发生改变,在地势低洼的地方土表常有盐渍化发生。盐水动态的改变会影响湿地植物群落结构,降低初级生产力(葛振鸣等,2005;巩晋楠等,2009)。另外,围垦区和近岸海域之间的物质能量交换基本停滞,潮汐/流驱动的泥沙沉积过程也不复存在,潮间带湿地的快速碳封存过程和水平碳通量受到极大干扰(Wang等,2010)。
生物入侵也会在很大程度上影响潮间带湿地的碳循环。研究表明,盐沼的入侵植物通常较本地植物具有更强的光合能力和初级生产力(赵广琦等,2005;Valéry等,2004)。入侵植物还会改变盐沼的凋落物数量和质量,改变土壤微生物群系和土壤酶活性,从而影响凋落物分解、营养物质还原和碳输出(Liao等,2008)。在上海九段沙湿地,入侵种互花米草增进了引进区域的土壤微生物呼吸(贾建伟等,2010),但互花米草群落土壤有机碳含量明显高于土著种海三棱藨草(Scirpus Mariqueter)群落(Cheng等,2006)。Liu等(2007)发现互花米草的扩展显著增强了江苏省潮间带湿地的碳汇潜能。Zhang等(2010)也认为互花米草入侵导致土壤碳储量的增加,并指出这主要由互花米草凋落物和根系新产生碳的积累实现。但也有研究得出互花米草入侵没有显著影响土壤碳库(Windham和Lathrop,1999),甚至降低了土壤有机碳含量的结论(邵学新等,2011)。
富营养化能够显著促进盐沼植物的地上生物量(Wigand等,2004)并改变其根冠比(Morris,1982),地下生物量下降会导致盐沼沉积速率下降及滩面高程下降,使其更容易受海平面上升的影响(Darby和Turner,2008)。富营养化还能增加盐沼植物凋落物产量并改变植被群落结构(Valiela等,1985)。在美国纳拉甘西特海湾,Wigand等(2004)研究发现提高的养分(氮、磷)负荷会增加狐米草的叶绿素含量并增强其叶绿素荧光动力。对于土壤呼吸,Morris和Bradley(1999)在美国南卡莱罗那州贫营养盐沼的施肥试验中,发现施加氮、磷显著增强了土壤呼吸速率。Wigand等(2009)对美国纳拉甘西特海湾盐沼的研究也发现,土壤呼吸速率在流域内沿着氮浓度的升高而增加。
还有一些研究评估了放牧对潮间带湿地碳循环的影响。Olsen等(2011)发现放牧能够显著增加温带盐沼土壤微生物量和土壤呼吸,改变土壤微生物群落储存、利用碳的方式,从而影响碳在土壤中的寿命。而Ford等(2012)在温带盐沼研究则发现,放牧显著降低了CO2排放,但对由CH4和CO2排放一起核算的升温潜势却没有显著影响。
4 气候变化对潮间带湿地碳循环的影响
多种气候变化要素(海平面上升、气温升高、CO2浓度升高等)均可能会对潮间带湿地碳汇功能产生显著影响。由于全球变暖导致冰川融化、海水膨胀,从1901年到2010年,全球海平面平均上升了0.19 m,而且这种上升还在继续。根据IPCC报告,即使在减排强度最大的预估情景下,到 21世纪末,海平面也会比 20世纪末升高 0.26~0.55 m(IPCC,2013)。上升的海平面会不断侵蚀海岸线,淹没潮间带湿地(Nicholls,2004)。与此同时,当前普遍存在的河流大型水利工程(如长江三峡水电站)会大大消减泥沙下泄量,从而可能加剧海平面上升条件下潮间带湿地的侵蚀(仲启铖等,2010)。针对海平面上升对潮间带湿地碳汇功能的潜在影响,Mudd等(2006)采用模型模拟研究指出,由于盐沼的垂直沉积,碳积累会随着海平面的上升而增加,直到海水完全淹没盐沼植被,这种积累才会停止;因此,盐沼碳汇功能的维持依赖于其垂直沉积能力和海平面上升水平之间的平衡。针对不断上升的海平面,人们采取了一系列的应对策略,如修建护岸堤坝,但堤坝等工程设施会阻断潮间带湿地向内陆扩展,在海平面继续上升的情况下,潮间带湿地可能会因为不能向内陆扩展而逐渐被海水淹没,从而削弱其碳汇功能。另一项对美国佛罗里达州盐沼植被和土壤稳定同位素比率的研究发现,因为海平面上升导致了湿地的向陆性扩展,当地植被优势种经历了由C3植物转变为C4植物的演替过程(Choi等,2001)。海平面上升还可能会增加风暴潮等恶劣天气的强度,从而使潮间带湿地碳汇功能变得更为脆弱(DeLaune和White,2012;Barr等,2012)。
在全球温度升高与潮间带湿地碳循环的关系方面,现有的控温试验表明温度升高会增强盐沼入侵植物物种的扩散(Loebl等,2006),影响植物生长(Zhong等,2014),改变植被群落结构和地理分布等(Bertness等,2002)。在美国马萨诸塞州盐沼进行的升温试验结果表明,白天适度的升温显著提高了互花米草群落地上生物量,同时稍增加了有机质分解速率。这项研究认为,只要盐沼不会因为海平面上升而被淹没,那么未来变暖的条件将有利于盐沼植物的生长,并进一步增加其固碳能力(Charles和Dukes,2009)。另一项控温试验则表明,低于3 ℃的升温幅度可以在生长季末期将盐沼植物群落优势种互花米草和狐米草的生产力增加15%~54%(Gedan和Bertness,2010)。然而,在生态系统尺度上,Hopkinson等(2012)依据通用代谢理论认为,由于呼吸作用的活化能显著高于光合作用的活化能,温度升高对呼吸作用的影响高于光合作用,因此必然会导致潮间带湿地 NEP的下降,进而降低其碳汇功能和碳库储量。另外,升温可能会改变潮间带湿地土壤盐度,土壤盐度改变不仅会影响土壤呼吸对升温的响应(Zhong等,2013),而且还会通过改变植物群落结构而影响植被生产力(Zhong等,2014)。升温还有可能使冬季霜冻的发生频率降低,使不耐北方霜冻的红树林往北扩展进入盐沼,从而改变潮间带湿地植物群落结构及生产力(Guo等,2013)。
在美国的Chesapeake湾盐沼,在将CO2浓度升高340 ppm的条件下,C3植物群落的光合速率、净CO2吸收(Drake等,1996)及生态系统碳交换(Rasse等,2005)都会增加,而光合速率的增加促进了细根生产力(Dakora和 Drake,2000)及甲烷产生(Dacey等,1994)。在另一项类似研究中,CO2浓度升高将C3植物群落的生物量增加了大约35%,对C4植物群落无显著影响,但却显著增加了C3-C4混合植物群落的生物量(Erickson等,2007)。Marsh等(2005)对C3和C4两种植物群落碳循环的研究发现,CO2浓度升高会使两种群落0~30 cm土壤中的DIC含量显著升高;对于C3植物群落,CO2浓度升高增加了土壤中DOC和溶解性CH4,并通常会促进CO2和CH4排放;而C4植物群落碳循环对CO2浓度升高的响应则很微弱或者不存在;总体上CO2浓度升高可以通过影响潮间带植物群落而增加对近海的DIC输出。鉴于C3和C4植物对CO2浓度响应的差异,在CO2浓度升高的条件下,盐沼的优势种可能会从C3转变成C4植物,进而改变盐沼碳循环(Anderson等,2004)。对于红树植物,CO2浓度升高也会显著增加其生物量、相对生长速率和净同化速率等(Farnsworth和Elliso,1997)。
多种气候变化要素可能会同时作用于潮间带湿地的碳循环。Langley等(2009)在美国Chesapeake湾研究发现,两年CO2浓度升高处理通过促进植物地下部分生产力将盐沼高程提高了3.9 mm·a-1,而海平面上升带来的盐度和淹水程度增加会进一步增强CO2浓度升高的效果,使盐沼高程持续增加来抵抗海平面上升。然而Kirwan和Blum(2011)却发现,盐沼有机质分解对升温响应程度大约为植被生产力对升温响应程度的2倍,接近于植被生产力对CO2浓度升高响应程度,因此气温升高条件下有机质分解速率的增加会抵消植被生产力和土壤碳积累速率的增加。Kirwan和Mudd(2012)研究则认为气温升高对土壤碳积累速率的直接影响相对于升温导致海平面上升的间接影响是很微弱的,他们采用模型模拟表明气候变化的净效应会在 21世纪前半段增加盐沼碳积累速率,但这种正反馈可能会随着时间的推移而逐渐消失。在中西佛罗里达的潮间带湿地,海平面上升导致的淹水增加降低了土壤矿化速率,而温度从 23 ℃增加到 27 ℃能够将潜在矿化碳提高40%,两种气候变化要素对土壤有机质矿化产生了相反的影响(Lewis等,2014)。另外,CO2浓度和温度同时升高会减缓盐度对潮间带湿地植物的影响,有利于它们扩展进入盐度更高的区域从而改变植物群落结构和生产力(Eller等,2014)。Luo等(2010)采用生化模型Biome-BGC模拟了未来气候条件下红树林沼泽NPP动态,发现CO2浓度升高对NPP的影响仅有不到7%;而CO2浓度和气温同时升高能够将3个不同地理类群红树林沼泽的生产力提高14%~19%。
5 受损潮间带湿地碳汇功能保育和修复
潮间带湿地在遭受到人为干扰破坏或转化,以及在后续的开垦、种养等过程中,原本稳定存在的土壤有机碳会快速损失。最有效地维持潮间带湿地碳汇功能的方式是对其进行保育,避免进一步破坏。另一方面,对受损潮间带湿地进行修复或重建也可以减缓或反转其碳汇功能丧失(Morris等,2012)。在受损湿地修复过程中,水文因子是人为可以控制的最直接、有效的环境因素。随着人们逐渐意识到潮间带湿地碳汇功能重要性,采用水文调控对滨海围垦区或潮汐隔绝区等受损潮间带湿地进行修复或重建的案例也多有报道(Bernhardt等,2003;Wolters等,2005)。Cui等(2009)和Song等(2012)在中国黄河口和东北滨海平原分别采用水文调控对受损芦苇湿地进行修复,发现土壤有机碳、微生物生物量碳及土壤酶的含量都持续增加。仲启铖等(2013,2014)在长江口崇明东滩围垦区滩涂湿地的研究也发现,提高水位可以降低土壤呼吸速率,减缓围垦后土壤有机碳损失速率;另外还可以提高湿生植物芦苇在群落中的优势度,并增加植被生产力。Howe等(2009)研究也表明,与天然潮间带湿地相比,采用恢复潮汐淹水对受损潮间带湿地进行修复会增加其碳封存速率,这种增加主要由修复后相对更高的垂直沉积速率实现。
然而,即便采取了修复措施,受损潮间带湿地的碳汇功能在短期内也并不能完全恢复到初始状态。Crooks等(2011)对一个重新营造的半咸水盐沼研究发现,植被地上生物量恢复速率相对较快,但土壤碳存储的恢复至少需要几十年时间。Burden等(2013)对英国埃塞克斯一个从农田到盐沼过渡带的研究也发现,围垦样地在采用修复措施(managed realignment:将沿海防护设施后撤,使先前被围垦湿地再次被潮水淹没)后预计需要100年的时间才能积累到等同于天然盐沼的碳储量。无论如何,这种对受损潮间带湿地进行修复的措施可能比单纯的植树造林在增加碳封存方面更加有效。Connor等(2001)估计如果加拿大芬迪湾被围垦用于农业的湿地面积可以全部被修复,其每年封存CO2的速率相当于加拿大在京都议定书框架下基于1990年减排目标的4%~6%。IPCC同样推荐修复退化或受损湿地作为增加碳封存的重要战略。以英国为例,政府计划在1999─2015年间,采用managed realignment重新创造2240 ha盐沼(Burden等,2013)。人类介入去修复受损潮间带湿地是增加全球自然碳汇的有效措施,但是这种措施必须被扩大到产业规模时才可能产生明显效果(Irving等,2011)。
6 总结
尽管对全球潮间带湿地总碳封存能力的评估还存在很大不确定性(因总面积和单位面积碳封存速率估算尚不精确),但这类生态系统在全球碳收支中无疑扮演着重要角色。然而,全球潮间带湿地的碳汇功能和碳库储量在过去一个世纪已显著降低,并且未来很有可能在围垦、富营养化等人为干扰,和海平面上升、气温升高等气候变化要素作用下持续下降。管理者在认清这一趋势的同时,必须采取有效的保育或修复措施来缓解这种重要自然碳汇的丧失。只有对潮间带湿地的碳汇功能进行可持续管理和利用,才能充分发挥其在碳减排方面的生态功能。
在全球变化背景下,未来的研究需要更好的理解不同类型、不同地域的潮间带湿地碳循环与人为干扰和气候变化的关系,分析并预测其对全球碳循环的贡献,为潮间带湿地碳汇功能的可持续管理和利用提供更加精准和有效的依据。例如开展长期生态系统控制实验,研究多种并存的气候变化要素对潮间带湿地碳循环的交互效应,研究人为干扰和气候变化同时存在对潮间带湿地碳循环的潜在影响;开发基于水动力-生化过程的潮间带湿地碳收支模型,结合遥感手段,对潮间带湿地碳源/汇时空格局进行分析评估,并预测不同人为干扰和气候变化情境下潮间带湿地碳收支变化规律;加强受损潮间带湿地碳汇功能修复和重建的基础研究、工程示范和效果评估,完善该类受损湿地碳汇功能修复的基础理论和实施方法。
ANDERSON M C, NEALE C M U, LI F, et al. 2004. Upscaling ground observations of vegetation water content, canopy height, and leaf area index during SMEX02 using aircraft and Landsat imagery[J]. Remote Sensing of Environment, 92(4): 447-464.
ARMSTRONG W, WRIGHT E J, LYTHE S, et al. 1995. Plant zonation and the effects of the spring-neap tidal cycle on soil aeration in a Humber salt marsh[J]. The Journal of Ecology, 73(1): 323-339.
BARTLETT K B, HARRISS R C, SEBACHER D I. 1985. Methane flux from coastal salt marshes[J]. Journal of Geophysical Research: Atmospheres (1984─2012), 90(D3): 5710-5720.
BARTLETT K B, HARRISS R C. 1993. Review and assessment of methane emissions from wetlands[J]. Chemosphere, 26(1): 261-320.
BARR, J G, ENGEL V, FUENTES J D, et al. 2010. Controls on mangrove forest-atmosphere carbon dioxide exchanges in western Everglades National Park[J]. Journal of Geophysical Research, 115(G2): G02020.
BERNHARDT K G, KOCH M. 2003. Restoration of a saltmarsh system: Temporal change of plant species diversity and composition[J]. Basic and Applied Ecology, 4(5): 441-451.
BERTNESS M D, EWANCHUK P J, SILLIMAN B R. 2002. Anthropogenic modification of New England salt marsh landscapes[J]. Proceedings of the National Academy of Sciences, 99(3): 1395-1398.
BOUILLON S, BORGES A V, CASTAÑEDA-MOYA E, et al. 2008. Mangrove production and carbon sinks: a revision of global budget estimates[J]. Global Biogeochemical Cycles, 22(2): 1-12.
BRIDGHAM S D, MEGONIGAL J P, KELLER J K, et al. 2006. The carbon balance of North American wetlands[J]. Wetlands, 26(4): 889-916.
BURDEN A, GARBUTTA, EVANS C, et al. 2013. Carbon sequestration and biogeochemical cycling in a saltmarsh subject to coastal managed realignment[J]. Estuarine, Coastal and Shelf Science, 120: 12-20.
CHARLES H, DUKES J S. 2009. Effects of warming and altered precipitation on plant and nutrient dynamics of a New England salt marsh[J]. Ecological Applications, 19(7): 1758-1773.
CHENG X, LUO Y, CHEN J, et al. 2006. Short-term C4plant Spartina alterniflora invasions change the soil carbon in C3plant-dominated tidal wetlands on a growing estuarine Island[J]. Soil Biology and Biochemistry, 38(12): 3380-3386.
CHOI Y, WANG Y, HSIEH Y P et al. 2001. Vegetation succession and carbon sequestration in a coastal wetland in northwest Florida: Evidence from carbon isotopes[J]. Global Biogeochemical Cycles, 15(2): 311-319.
CHMURA G L, HELMER L L, BEECHER C B, et al. 2001. Historical rates of salt marsh accretion on the outer Bay of Fundy[J]. Canadian Journal of Earth Sciences, 38(7): 1081-1092.
CHMURA G L, ANISFELD S C, CAHOON D R, et al. 2003. Global carbon sequestration in tidal, saline wetland soils[J]. Global Biogeochemical Cycles, 17(4): 1111.
CHAPMAN V J. 1977. Wet coastal ecosystems[M]. Amsterdam: Elsevier scientific publishing company: 428.
CONNOR R F, CHMURA G L, BEECHER C B. 2001. Carbon accumulation in Bay of Fundy salt marshes: Implications for restoration of reclaimed marshes[J]. Global Biogeochemical Cycles, 15(4): 943-954.
CROOKS S, HERR D, TAMELANDER J, et al. 2011. Mitigating climate change through restoration and management of coastal wetlands and near-shore marine ecosystems: challenges and opportunities[R]. Environment Department Paper 121. Washington, DC: World Bank.
CUI B, YANG Q, YANG Z, et al. 2009. Evaluating the ecological performance of wetland restoration in the Yellow River Delta, China[J]. Ecological Engineering, 35(7): 1090-1103.
DACEY J W H, DRAKE B G, KLUG M J. 1994. Stimulation of methane emission by carbon dioxide enrichment of marsh vegetation[J]. Nature, 370: 47-49.
DAKORA F D, DRAKE B G. 2000. Elevated CO2stimulates associative N2fixation in a C3plant of the Chesapeake Bay wetland[J]. Plant, Cell & Environment, 23(9): 943-953.
DONATO D C, KAUFFMAN J B, MURDIYARSO D, et al. 2011. Mangroves among the most carbon-rich forests in the tropics[J]. Nature Geoscience, 4(5): 293-297.
DARBY F A, TURNER R E. 2008. Effects of eutrophication on salt marsh root and rhizome biomass accumulation[J]. Marine Ecology Progress Series, 363: 63-70.
DELAUNE R D, SMITH C J, PATRICK W H. 1983. Methane release from Gulf coast wetlands[J]. Tellus B, 35(1): 8-15.
DELAUNE R D, WHITE J R. 2012. Will coastal wetlands continue to sequester carbon in response to an increase in global sea level? A case study of the rapidly subsiding Mississippi river deltaic plain[J]. Climatic Change, 110(1-2): 297-314.
DITTMAR T, HERTKORN N, KATTNER G, et al. 2006. Mangroves, a major source of dissolved organic carbon to the oceans[J]. Global Biogeochemical Cycles, 20(1): 1-7.
DRAKE B G, PERESTA G, BEUGELING E, et al. 1996. Long-term elevated CO2exposure in a Chesapeake Bay wetland: ecosystem gas exchange, primary production, and tissue nitrogen[M]. San Diego : Academic Press: 197-214.
ERICKSON J E, MEGONIGAL J P, PERESTA G, et al. 2007. Salinity and sea level mediate elevated CO2effects on C3-C4plant interactions and tissue nitrogen in a Chesapeake Bay tidal wetland[J]. Global Change Biology, 13(1): 202-215.
ELLER F, LAMBERTINI C, NGUYEN L X, et al. 2014. Increased invasive potential of non-native Phragmites australis: elevated CO2and temperature alleviate salinity effects on photosynthesis and growth[J]. Global Change Biology, 20(2): 531-543.
EWANCHUK P J, BERTNESS M D. 2004. The role of waterlogging in maintaining forb pannes in northern New England salt marshes[J]. Ecology, 85(6): 1568-1574.
FARNSWORTH E J, ELLISON A M. 1997. The global conservation status of mangroves[J]. Ambio, 26(6): 328-334.
FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (FAO). 2007. The World's Mangroves, 1980-2005: A Thematic Study in the Framework of the Global Forest Resources Assessment[R]. Rome, Italy: FAO.
FORD H, GARBUTT A, JONES L, et al. 2012. Methane, carbon dioxide and nitrous oxide fluxes from a temperate salt marsh: Grazing management does not alter Global Warming Potential[J]. Estuarine, Coastal and Shelf Science, 113: 182-191.
FORSTER P, RAMASWAMY V, ARTAXO P, et al. 2007. Changes in atmospheric constituents and in radiative forcing[J]. Climate Change, 20: 129-234.
FRIESS D A, KRAUSS K W, HORSTMAN E M, et al. 2012. Are all intertidal wetlands naturally created equal? Bottlenecks, thresholds and knowledge gaps to mangrove and saltmarsh ecosystems[J]. Biological Reviews, 87(2): 346-366.
GEDAN K B, BERTNESS M D. 2010. How will warming affect the salt marsh foundation species Spartina patens and its ecological role[J]? Oecologia, 164(2): 479-487.
GUO H, NOORMETS A, ZHAO B, et al. 2009. Tidal effects on net ecosystem exchange of carbon in an estuarine wetland[J]. Agricultural and Forest Meteorology, 149(11): 1820-1828.
GUO H, ZHANG Y, LAN Z, et al. 2013. Biotic interactions mediate the expansion of black mangrove (Avicennia germinans) into salt marshes under climate change[J]. Global Change Biology, 19(9): 2765-2774.
HE Q, BERTNESS M D, BRUNO J F, et al. 2014. Economic development and coastal ecosystem change in China[J]. Scientific Reports, 4: 5995.
HEINSCH F A, HEILMAN J L, MCINNES K J, et al. 2004. Carbon dioxide exchange in a high marsh on the Texas Gulf Coast: effects of freshwater availability[J]. Agricultural and Forest Meteorology, 125(1): 159-172.
HOWE A J, RODRIGUEZ J F, SACO P M. 2009. Surface evolution and carbon sequestration in disturbed and undisturbed wetland soils of the Hunter estuary, southeast Australia[J]. Estuarine, Coastal and Shelf Science, 84(1): 75-83.
HOPKINSON C S, CAI W J, HU X. 2012. Carbon sequestration in wetland dominated coastal systems—a global sink of rapidly diminishing magnitude[J]. Current Opinion in Environmental Sustainability, 4(2): 186-194.
IRVING A D, CONNELL S D, RUSSELL B D. 2011. Restoring coastal plants to improve global carbon storage: reaping what we sow[J]. PloS one, 6(3): e18311.
KATHILANKAL J C, MOZDZER T J, FUENTES J D, et al. 2008. Tidal influences on carbon assimilation by a salt marsh[J]. Environmental Research Letters, 3(4): 044010.
KIRWAN M L, BLUM L K. 2011. Enhanced decomposition offsets enhanced productivity and soil carbon accumulation in coastal wetlands responding to climate change[J]. Biogeosciences Discussions, 8(1): 707-722.
KIRWAN M L, MUDD S M. 2012. Response of salt-marsh carbon accumulation to climate change[J]. Nature, 489(7417): 550-553.
KIRWAN M L, MEGONIGAL J P. 2013. Tidal wetland stability in the face of human impacts and sea-level rise[J]. Nature, 504(7478): 53-60.
KING G M, WIEBE W J. 1978. Methane release from soils of a Georgia salt marsh[J]. Geochimica et Cosmochimica Acta, 42(4): 343-348.
LAFFOLEY D, GRIMSDITCH, G D. 2009. The management of natural coastal carbon sinks[R]. Gland, Switzerland: IUCN.
LANGLEY J A, MCKEE K L, CAHOON D R, et al. 2009. Elevated CO2stimulates marsh elevation gain, counterbalancing sea-level rise[J]. Proceedings of the National Academy of Sciences, 106(15): 6182-6186.
LAUDICINA V A, HURTADO M D, BADALUCCO L, et al. 2009. Soil chemical and biochemical properties of a salt-marsh alluvial Spanish area after long-term reclamation[J]. Biology and Fertility of Soils, 45(7): 691-700.
LEWIS D B, BROWN J A, JIMENEZ K L. 2014. Effects of flooding and warming on soil organic matter mineralization in Avicennia germinans mangrove forests and Juncus roemerianus salt marshes[J]. Estuarine, Coastal and Shelf Science, 139: 11-19.
LIAO C, PENG R, LUO Y, et al. 2008. Altered ecosystem carbon and nitrogen cycles by plant invasion: a meta-analysis[J]. New Phytologist, 177(3): 706-714.
LIVESLEY S J, ANDRUSIAK S M. 2012. Temperate mangrove and salt marsh sediments are a small methane and nitrous oxide source but important carbon store[J]. Estuarine, Coastal and Shelf Science, 97: 19-27.
LIU J, ZHOU H, QIN P, et al. 2007. Effects of Spartina alterniflora salt marshes on organic carbon acquisition in intertidal zones of Jiangsu Province, China[J]. Ecological Engineering, 30(3): 240-249.
LOEBL M, VAN BEUSEKOM J E E, REISE K. 2006. Is spread of the neophyte Spartina anglica recently enhanced by increasing temperatures[J]? Aquatic Ecology, 40(3): 315-324.
LUO Z, SUN O J, WANG E, et al. 2010. Modeling productivity in mangrove forests as impacted by effective soil water availability and its sensitivity to climate change using Biome-BGC[J]. Ecosystems, 13(7): 949-965.
MAGENHEIMER J F, MOORE T R, CHMURA G L, et al. 1996. Methane and carbon dioxide flux from a macrotidal salt marsh, Bay of Fundy, New Brunswick[J]. Estuaries, 19(1): 139-145.
MATTHEWS E, FUNG I. 1987. Methane emission from natural wetlands: Global distribution, area, and environmental characteristics of sources[J]. Global Biogeochemical Cycles, 1(1): 61-86.
MARSH A S, RASSE D P, DRAKE B G, et al. 2005. Effect of elevated CO2on carbon pools and fluxes in a brackish marsh[J]. Estuaries, 28(5): 694-704.
MOFFETT K B, WOLF A, BERRY J A, et al. 2010. Salt marsh–atmosphere exchange of energy, water vapor, and carbon dioxide: Effects of tidal flooding and biophysical controls[J]. Water Resources Research, 46(10): W10525.
MENDELSSOHN I A, MORRIS J T. 2002. Eco-physiological controls on the productivity of Spartina alterniflora Loisel[C] // MICHAEL P W, DANIEL A K. Concepts and controversies in tidal marsh ecology. Netherlands: Springer: 59-80.
MORRIS J T. 1982. A model of growth responses by Spartina Alterniflora to nitrogen limitation[J]. The Journal of Ecology, 71(1): 25-42.
MORRIS J T, BRADLEY P M. 1999. Effects of nutrient loading on the carbon balance of coastal wetland sediments[J]. Limnology and Oceanography, 44(3): 699-702.
MORRIS J T, EDWARDS J, CROOKS S, et al. 2012. Assessment of carbon sequestration potential in coastal wetlands[C]//LAL R, LORENZ K, HÜTTL R F, et al. Recarbonization of the Biosphere. Netherlands: Springer: 517-531.
MUDD S M, HOWELL S M, MORRIS J T. 2009. Impact of dynamic feedbacks between sedimentation, sea-level rise, and biomass production on near-surface marsh stratigraphy and carbon accumulation[J]. Estuarine, Coastal and Shelf Science, 82(3): 377-389.
MURPHY P, THACKRAY D, WILSON E. 2009. Coastal heritage and climate change in England: assessing threats and priorities[J]. Conservation and Management of Archaeological Sites, 11(1): 9-15.
NEUBAUER S C. 2013. Ecosystem responses of a tidal freshwater marsh experiencing saltwater intrusion and altered hydrology[J]. Estuaries and Coasts, 36(3): 491-507.
NICHOLLS R J. 2004. Coastal flooding and wetland loss in the 21st century: changes under the SRES climate and socio-economic scenarios[J]. Global Environmental Change, 14(1): 69-86.
ODUM E P. 1971. Fundamentals of Ecology[M]. 3rd ed. Philadelphia: WB Saunders: 546.
OLSEN Y S, DAUSSE A, GARBUTT A, et al. 2011. Cattle grazing drives nitrogen and carbon cycling in a temperate salt marsh[J]. Soil Biology and Biochemistry, 43(3): 531-541.
PENDLETON L, DONATO D C, MURRAY B C, et al. 2012. Estimating global “blue carbon” emissions from conversion and degradation of vegetated coastal ecosystems[J]. PloS one, 7(9): e43542.
PENNINGS S C, CALLAWAY R M. 1992. Salt marsh plant zonation: the relative importance of competition and physical factors[J]. Ecology, 73(2): 681-690.
POFFENBARGER H J, NEEDELMAN B A, MEGONIGAL J P. 2011. Salinity influence on methane emissions from tidal marshes[J]. Wetlands, 31(5): 831-842.
RASSE D P, PERESTA G, DRAKE B G. 2005. Seventeen years of elevated CO2exposure in a Chesapeake Bay wetland: Sustained but contrasting responses of plant growth and CO2uptake[J]. Global Change Biology, 11(3): 369-377.
RICHARD F D. 1982. The flux of floating macrodetritus in the North inlet estuarine ecosystem[J]. Estuarine, Coastal and Shelf Science, 15(3): 337-344.
ROTHMAN E, BOUCHARD V. 2007. Regulation of carbon processes by macrophyte species in a Great Lakes coastal wetland[J]. Wetlands, 27(4): 1134-1143.
STERN J, WANG Y, GU B, et al. 2007. Distribution and turnover of carbon in natural and constructed wetlands in the Florida Everglades[J]. Applied Geochemistry, 22(9): 1936-1948.
SMITH C J, DELAUNE R D, PATRICK JR W H. 1983. Nitrous oxide emission from Gulf Coast wetlands[J]. Geochimica Cosmochimica Acta, 47(10): 1805-1814.
SONG Y, SONG C, YANG G, et al. 2012. Changes in labile organic carbon fractions and soil enzyme activities after marshland reclamation and restoration in the Sanjiang Plain in northeast China[J]. Environmental Management, 50(3): 418-426.
INTERGOVERNMENTAL PANEL ON CLIMATE CHANGE (IPCC). 2013. Climate Change 2013: The physical science basis: Working group I contribution to the fifth assessment report of the Intergovernmental Panel on Climate Change[R]. London: Cambridge University Press: IPCC.
SULLIVAN M J, CURRIN C A. 2002. Community structure and functional dynamics of benthic microalgae in salt marshes[C]//WEINSTEIN M P, KREEGER D A. Concepts and controversies in tidal marsh ecology. Netherlands: Springer: 81-106.
TEAL J M. 1962. Energy flow in the salt marsh ecosystem of Georgia[J]. Ecology, 43(4): 614-624.
VALÉRY L, BOUCHARD V, LEFEUVRE J C. 2004. Impact of the invasive native species Elymus athericus on carbon pools in a salt marsh[J]. Wetlands, 24(2): 268-276.
VALIELA I, WILSON J, BUCHSBAUM R, et al. 1984. Importance of chemical composition of salt marsh litter on decay rates and feeding by detritivores[J]. Bulletin of Marine Science, 35(3): 261-269.
WANG L, SONG C, SONG Y, et al. 2010. Effects of reclamation of natural wetlands to a rice paddy on dissolved carbon dynamics in the Sanjiang Plain, Northeastern China[J]. Ecological Engineering, 36(10): 1417-1423.
WETZEL R G. 1992. Gradient-dominated ecosystems: sources and regulatory functions of dissolved organic matter in freshwater ecosystems[C]//SALONEN K, KAIRESALO T, JONES R I. Dissolved Organic Matter in Lacustrine Ecosystems. Netherlands: Springer: 181-198.
WHITING G J, CHANTON J P, BARTLETT D S, et al. 1991. Relationships between CH4emission, biomass, and CO2exchange in a subtropical grassland[J]. Journal of Geophysical Research: Atmospheres, 96(D7): 13067-13071.
WICHERN J, WICHERN F, JOERGENSEN R G. 2006. Impact of salinity on soil microbial communities and the decomposition of maize in acidic soils[J]. Geoderma, 137(1/2): 100-108.
WIGAND C, MCKINNEY R A, CHINTALA M M, et al. 2004. Denitrification enzyme activity of fringe salt marshes in New England (USA)[J]. Journal of Environmental Quality, 33(3): 1144-1151.
WIGAND C, BRENNAN P, STOLT M, et al. 2009. Soil respiration rates in coastal marshes subject to increasing watershed nitrogen loads insouthern New England, USA[J]. Wetlands, 29(3): 952-963.
WINDHAM L, LATHROP R G. 1999. Effects of Phragmites australis (common reed) invasion on aboveground biomass and soil properties in brackish tidal marsh of the Mullica River, New Jersey[J]. Estuaries, 22(4): 927-935.
WOLTERS M, GARBUTT A, BAKKER J P. 2005. Salt-marsh restoration: Evaluating the success of de-embankments in north-west Europe[J]. Biological Conservation, 123(2): 249-268.
YANG S L, CHEN J Y. 1995. Coastal salt marshes and mangrove swamps in China[J]. Chinese Journal of Oceanology and Limnology, 13(4): 318-324.
ZHANG Y, DING W, LUO J, et al. 2010. Changes in soil organic carbon dynamics in an Eastern Chinese coastal wetland following invasion by a C4plant Spartina alterniflora[J]. Soil Biology and Biochemistry, 42(10): 1712-1720.
ZHOU L, ZHOU G, JIA Q. 2009. Annual cycle of CO2exchange over a reed (Phragmites australis) wetland in Northeast China[J]. Aquatic Botany, 91(2): 91-98.
ZHONG Q, DU Q, GONG J, et al. 2013. Effects of in situ experimental air warming on the soil respiration in a coastal salt marsh reclaimed for agriculture[J]. Plant and soil, 371(1/2): 487-502.
ZHONG Q, GONG J, WANG K, et al. 2014. Effects of 3-year air warming on growth of two perennial grasses (Phragmites australis and Imperata cylindrica) in a coastal salt marsh reclaimed for agriculture[J]. Aquatic Botany, 117: 18-26.
葛振鸣, 王天厚, 施文彧, 等. 2005. 崇明东滩围垦堤内植被快速次生演替特征[J].应用生态学报, 16(9): 1677-1681.
巩晋楠, 王开运, 张超, 等. 2009. 围垦滩涂湿地旱生耐盐植物的入侵和影响[J]. 应用生态学报, 20(1): 33-39.
贾建伟, 王磊, 唐玉姝, 等. 2010. 九段沙不同演替阶段湿地土壤微生物呼吸的差异性及其影响因素[J]. 生态学报, 30(17): 4529-4538.
马安娜, 陆健健. 2011. 长江口崇西湿地生态系统的二氧化碳交换及潮汐影响[J]. 环境科学研究, 24(7): 716-721.
聂明华, 刘敏, 侯立军, 等. 2011. 长江口潮滩土壤呼吸季节变化及其影响因素[J]. 环境科学学报, 31(4): 824-831.
邵学新, 杨文英, 吴明, 等. 2011. 杭州湾滨海湿地土壤有机碳含量及其分布格局[J]. 应用生态学报, 22(3): 658-664.
赵广琦, 张利权, 梁霞. 2005. 芦苇与入侵植物互花米草的光合特性比较[J]. 生态学报, 25(7): 1604-1611.
仲启铖, 杜钦, 张超, 等. 2010. 滨岸不同植物配置模式的根系空间分布特征[J]. 生态学报, 22: 6135-6145.
仲启铖, 关阅章, 刘倩, 等. 2013. 水位调控对崇明东滩围垦区滩涂湿地土壤呼吸的影响[J]. 应用生态学报, 24(8): 2141-2150.
仲启铖, 王江涛, 周剑虹, 等. 2014. 水位调控对崇明东滩围垦区滩涂湿地芦苇和白茅光合, 形态及生长的影响[J]. 应用生态学报, 25(2): 408-418.
Research Advances on Carbon Cycling and Its Environmental Controlling Mechanisms in Intertidal Wetlands
ZHONG Qicheng1,2, WANG Kaiyun2, ZHOU Kai1, LAI Qifang1*
1. Research Center for Saline-alkali Water Fisheries Technology, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai, 200090, China; 2. Shanghai Key Laboratory of Urbanization and Ecological Restoration, East China Normal University, Shanghai, 200241, China
Vegetated intertidal wetlands (mangrove and salt marsh) often have high vegetation productivity, low organic carbon decomposition rate, low CH4emission rate and high carbon deposition rate, thereby performing as one of the ecosystems with the fastest carbon sequestration rate per unit area. As a major contributor to global “blue carbon” sink, intertidal wetlands have great potential in mitigating carbon greenhouse gas emission and eliminating the global greenhouse effect. Intertidal wetlands are mainly distributed at coast and estuary areas with developed economy and dense population. In recent years, the carbon sink function of intertidal wetlands has been threatened by more and more human disturbances, and the ongoing climate changes also added uncertainties to their function of carbon sink. In the context of global change, an insight into the carbon cycling and its environmental controlling mechanisms in intertidal wetlands can help the authorities better manage these ecosystems possessing important carbon mitigation potential. Related studies at home and aboard were summarized, in which the basic processes of the carbon cycling and its environmental affecting factors in intertidal wetlands were analyzed, and the effects of multiple human disturbances and climate change elements on the carbon cycling in intertidal wetlands were investigated. The main processes of the carbon cycling in intertidal wetlands include CO2and CH4exchanges across the soil (water)-atmosphere and the canopy-atmosphere interfaces, and sediment deposition-derived carbon sequestration at the vertical direction, as well as the carbon exchanges with offshore sea at the lateral direction. The carbon cycling in intertidal wetlands can be influenced by many abiotic and biotic factors, such as tide, photosynthetically active radiation (PAR), temperature, salinity, water level, and plant community characteristics. Land reclamation, eutrophication, and grazing are likely to weaken the carbon sink function of intertidal wetlands, whereas the exotic plant invasions may bring a higher carbon acquisition capacity to some degree. Sea level rise and global warming can increase the vulnerability of the carbon sink function of intertidal wetlands, while the effects from elevated CO2concentration are dependent on the photosynthetic pathways of dominant plant communities. The influences of multiple synchronous climate change elements on the carbon sink function of intertidal wetlands are much more complex. In the globe scope, large areas of intertidal wetlands have been suffering severe damages or even been lost, and the hydrological regulation is a promising measure to remedy and restore the carbon sink function of the disturbed intertidal wetlands. Future studies should: (1) Focus on understanding the interactive effects of multiple synchronous climate change elements, together with those of human disturbances coexisted with climate changes on the carbon cycling in intertidal wetlands. (2) Predict possible changes of carbon balances of intertidal wetlands that under different scenarios of human disturbances and climate changes. (3) Improve the basic theories and implementation methods for the carbon sink remediation of the disturbed intertidal wetlands.
intertidal wetland; carbon cycling; carbon sink; climate changes; human disturbances
X142
A
1674-5906(2015)01-0174-09
10.16258/j.cnki.1674-5906.2015.01.025
仲启铖,王开运,周凯,来琦芳. 潮间带湿地碳循环及其环境控制机制研究进展[J]. 生态环境学报, 2015, 24(1): 174-182. ZHONG Qicheng, WANG Kaiyun, ZHOU Kai, LAI Qifang. Research Advances on Carbon Cycling and Its Environmental Controlling Mechanisms in Intertidal Wetlands [J]. Ecology and Environmental Sciences, 2015, 24(1): 174-182.
农业部中国水产科学研究院基本科研业务费项目(2013A01YY02)
仲启铖(1986年生),男,助理研究员,博士,主要从事湿地生态学研究。E-mail:dddzqc@163.com *通讯作者:来琦芳,研究员,E-mail: laiqf@ecsf.ac.cn
2014-10-15
