磁性Fe3O4/石墨烯异质结固定漆酶特性及其对水中双酚A的降解研究
2015-12-05欧阳科谢珊赵雅王雷超方琪惠
欧阳科,谢珊,赵雅,王雷超,方琪惠
1. 广东省五邑大学化学与环境工程学院,广东 江门 529020
磁性Fe3O4/石墨烯异质结固定漆酶特性及其对水中双酚A的降解研究
欧阳科,谢珊*,赵雅,王雷超,方琪惠
1. 广东省五邑大学化学与环境工程学院,广东 江门 529020
以磁性石墨烯为载体制备了磁性石墨烯固定化漆酶,考察了固定化漆酶的酶学特性及其对双酚A(BPA)的降解效能。结果表明,氧化石墨烯的比表面积高达726.34 m2·g-1,与游离漆酶相比,经过石墨烯固定化后漆酶对酸的适应能力、耐热性和贮存稳定性均有所提高,pH值2.0~4.0范围内固定化漆酶活性较为稳定;加入变性剂尿素(1 mol·L-1)后,固定化漆酶的相对活性为87%,游离漆酶相对活性仅为63.02%,固定化导致抗变性剂能力增强。固定化漆酶和游离漆酶活性分别在45和40 ℃时达到最大值。与游离漆酶相比,固定化漆酶最佳反应温度升高了5 ℃,且在50 ℃时,固定化漆酶的相对活性依然保持在95.11%;25 ℃,pH值4.0条件下保存10 d,固定化漆酶活性为最初活性的82.57%;固定化漆酶具有良好的重复利用性,重复利用10次后,漆酶活性仍为最初活性的82.01%。固定化酶的米氏常数Km为5.38×10-4mol·L-1,较游离酶的大,说明固定化酶与底物的亲和力比游离酶小。磁性石墨烯固定化漆酶具有良好的吸附能力,可吸附-催化氧化水中的BPA,且石墨烯良好的吸附作用促进了催化反应,水中BPA质量浓度为15 mg·L-1时,经过18 h反应,BPA的去除率能达到82.14%左右。本研究的结果为石墨烯新型材料固定化漆酶及其应用提供了参考。
磁性石墨烯,固定化漆酶,酶学性质,双酚A
双酚A(BisphenolA,CAS 80057,BPA)是一种环境内分泌干扰物,是一种重要的化工原料(Safe等,2002)。随着塑料制品的广泛应用,BPA造成了严重的环境污染。目前在水、沉积物、土壤和大气环境中均有检出(Heemken等,2001)。作为典型内分泌干扰素,BPA对生物体产生广泛的不良作用,如:影响内分泌系统、生殖系统和神经系统,影响组织发育以及致畸性等(秦伟程,2001),双酚A的环境影响已经引起广泛关注。
漆酶是一种常见的含铜的多酚氧化酶, 具有较强的氧化还原能力,并且对底物的专一性要求不高。在氧气存在条件下,漆酶通过4个铜离子协同传递电子和价态变化催化氧化水中的多种有机污染物(Lee等,2012;Nicolucci等,2011),如氯酚类、多环芳烃、多氯联苯、芳胺及其衍生物、生物色素、杀虫剂、杂环烃类、炸药、染料等(Lioret等,2012;Ben等,2012;Kumar等2012)。由于漆酶降解水中有机污染物所需的反应条件温和、操作简单、对环境无污染等优点,目前已经得到广泛研究。然而,目前漆酶的实际应用依然受到很大的限制,这主要是因为游离态的漆酶是水溶性的,很难回收及再次利用,使用成本过高。
将漆酶固定到载体上使用是行之有效的解决方法(Peralta等,2003;Rekuć等,2010)。与游离酶相比,固定化酶在保持其高效专一及温和的酶催化反应特性的同时,又克服了游离酶的不足之处,呈现储存稳定性高、分离回收容易、可多次重复使用、操作连续可控、工艺简便等优点。固定化酶技术是近十几年发展起来的酶应用技术,在工业生产、化学分析和医药等方面有诱人的应用前景。
石墨烯是一种二维平面结构材料,作为纳米材料的石墨烯具有巨大的比表面积,对有机污染物有良好的吸附能力,同时单层的石墨烯又能为酶促反应提供大量的活性点位。基于石墨烯的复合材料已展现许多优良的特性,在催化、储能、环境治理和生物医药等领域中的应用前景宽广(Li等,2008)。石墨烯的这些独特特性都为其在酶固定化及酶催化领域中的应用提供了坚实的理论依据。然而目前漆酶固定化载体研究较多的主要还是硅胶、活性炭、海藻酸钙和壳聚糖等常规材料(Khani等,2006;Jiang等,2005)。采用石墨烯作为载体,并且将之应用于催化氧化处理水中内分泌干扰素的研究报道却很少见。
在本研究中,将通过优化制备工艺制得了性能稳定的石墨烯固定化漆酶。并探讨所制备的固定化漆酶的主要酶学性质,针对水中内分泌干扰素双酚A(BPA),研究固定化漆酶催化降解效能,为固定化漆酶在水处理中的使用提供理论依据。
1 实验方法
1.1 试剂与仪器
除漆酶(Laccase,50 U·mg-1)购自Sigma公司外,所有试剂均为国产分析纯。乙腈、二氯甲烷,均为色谱纯。PBS缓冲溶液的配置,按标准方法配制(王颖等,2013)。
立式压力蒸汽灭菌锅(YXQ-LS-30SⅡ,上海博讯实业有限公司医疗设备厂),全温震荡培养箱(THZ-82A,金坛国盛仪器),无菌实验台(FLC-3,哈尔滨市东联公司),高效液相色谱仪为Agilent公司1100型,色谱柱为AgilentC18柱,超声波细胞破碎仪(JY92-2D,宁波新芝生物科技股份有限公司),电热恒温水浴锅(HH-6,国华仪器),台式 pH计(雷磁 pHS-3C,上海精科),紫外可见分光光度计(UV2450,岛津),移液枪(Appendorf公司)。
1.2 Fe3O4/graphene异质结制备及漆酶的固定化
以石墨片为原料,釆用Hummers法(Hummers等,1958)来制备氧化石墨烯(GO),采用多羟基法,通过铁离子与氧化石墨烯表面官能团的离子交换作用制备了磁性Fe3O4/石墨烯异质结,具体方法见文献(Li等,2013),将一定量的Fe3O4/graphene异质结加入 2 mL柠檬酸-磷酸氢二钠缓冲溶液(pH5.0)和5 mL 0.8 mg·mL-1的漆酶溶液,在25 ℃恒温摇床中搅拌8 h,4 ℃条件下静置,24 h后,用缓冲溶液多次洗涤以除去表面游离的漆酶,抽虑干燥后得磁性固定化酶,在4 ℃条件下密封保存备用。
1.3 酶活力测定
漆酶活性测定方法:以2,2'-连氮-双(3-乙基苯并噻唑-6-磺酸铵(ABTS)作为底物,采用分光光度法检测漆酶酶活(Johannes等,2001)。漆酶作用ABTS,产物在420 nm处有吸收峰。把漆酶催化氧化1 µmol ABTS所需的酶量定义为一个酶活单位。
游离酶和固定化酶活力测定:取一定量的游离酶和固定化酶,加入柠檬酸-磷酸氢钠缓冲溶液中(pH 2.0~7.0)加入一定量的1 mmol·L-1的ABTS水溶液,在一定温度下(25~85 ℃)反应5 min,冰浴终止反应10 min,离心取上清液,用紫外-可见分光光度计测定420 nm处的吸光度,计算酶活性。在25 ℃条件下,每分钟使1 µmol的底物吸光度升高0.001所需的酶量定义为1个酶活力单位(U)。在相同条件下以试剂空白为参比。
1.4 固定化漆酶主要酶学性质
酶学性质测定:按照上述酶活力测定方法,利用柠檬酸-磷酸氢二钠缓冲溶液调节不同 pH值(2.0~7.0)、不同温度(25~70 ℃)、不同时间(1~10 d)的ABTS水溶液,在420 nm处测定反应上清液吸光度数值(以酶活最高者为100%),计算酶活性,每个样品做3次平行测定,取平均值。
热稳定性:将游离漆酶(稀释2×103倍)和固定化漆酶分别在不同温度的水浴中保温1 h后冷却至室温,按照上述方法测定酶活(pH=3.0,假定室温下酶活为100%),每个样品做3次平行测定,取平均值。
1.5 动力学参数
利用 PBS缓冲溶液配制 ABTS底物溶液为0.01~0.05 mmol·L-1的溶液,按照上述方法,分别测定反应起始1 min内游离漆酶和固定化漆酶于不同底物浓度下在420 nm处的吸光度数值,每隔10 s记录吸光度变化(ΔA),利用ΔA与时间t作图求得初始速度,每个样品做 3次平行测定。根据Hanes-Woolf方程:
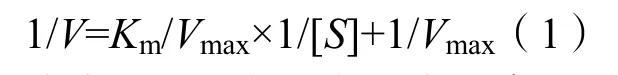
式中:Vmax为最大反应速率,V为酶反应速率,[S]为底物浓度,Km是米氏常数,常用mol·L-1表示。以1/V对1/[S]作图即可得Km值。
1.6 固定化漆酶降解BPA
150 mL锥形瓶中加入15 mg·L-1的BPA溶液(pH3.0),与75 mg固定化漆酶混合均匀,在室温下摇床中缓慢搅拌,按照不同反应时间取样分析水中BPA的浓度。
1.7 固定化漆酶降解BPA
BPA浓度的测定:对双酚A浓度的测定采用高效液相色谱法(Kang等,2001)。将培养液样品在高速离心机上以13000 r·min-1离心20 min,上清液直接于高效液相色谱(HPLC)测定。高效液相色谱仪为Agilent公司1100型,色谱柱为Agilent C18柱。色谱条件:流动相为V(乙腈)∶V(水)=50∶50,流速1 mL·min-1,柱温40 ℃,进样量为10 µL。

图1 (a)氧化石墨烯的SEM;(b)Fe3O4/GO的SEM图Fig. 1 (a) SEM picture of graphene oxide; (b) Fe3O4/GO SEM figure
2 结果与讨论
2.1 磁性石墨烯的表征及分析
图1(a)是氧化石墨烯的扫描电镜(SEM)图片,由图1(a)可知,所制得的氧化石墨烯呈现厚度较薄的片状结构。图1(b)是Fe3O4/GO异质结构的扫描电镜图片,与单纯氧化石墨烯的SEM图片比较,磁性Fe3O4纳米颗粒依附于氧化石墨烯的表面。磁性Fe3O4纳米颗粒为纳米级,粒径均一,比表面积较大,经测定,磁性石墨烯的比表面为726.34 m2·g-1,石墨烯的比表面积为648.68 m2·g-1。相比传统吸附材料如活性炭等,其比表面积要大很多,有利于漆酶的固定和BPA的吸附。
图2是氧化石墨烯和磁性Fe3O4/GO异质结构的红外光谱图,在氧化石墨烯中,有明显的特征峰,3400 cm-1为O-H的伸缩振动,1712 cm-1为-COOH官能团中C=O键的伸缩振动,1100 cm-1为C-O-C的伸缩振动,这些键的存在确认了在石墨烯氧化的过程中,其碳基骨架上存在很多的含氧官能团。与氧化石墨烯相比,磁性Fe3O4/GO异质结构的红外谱图变化并不大,较大的区别是在587 cm-1处的出现的较尖锐的特征吸收峰则来源于 Fe-O的伸缩振动,从而证明了Fe3O4的存在。
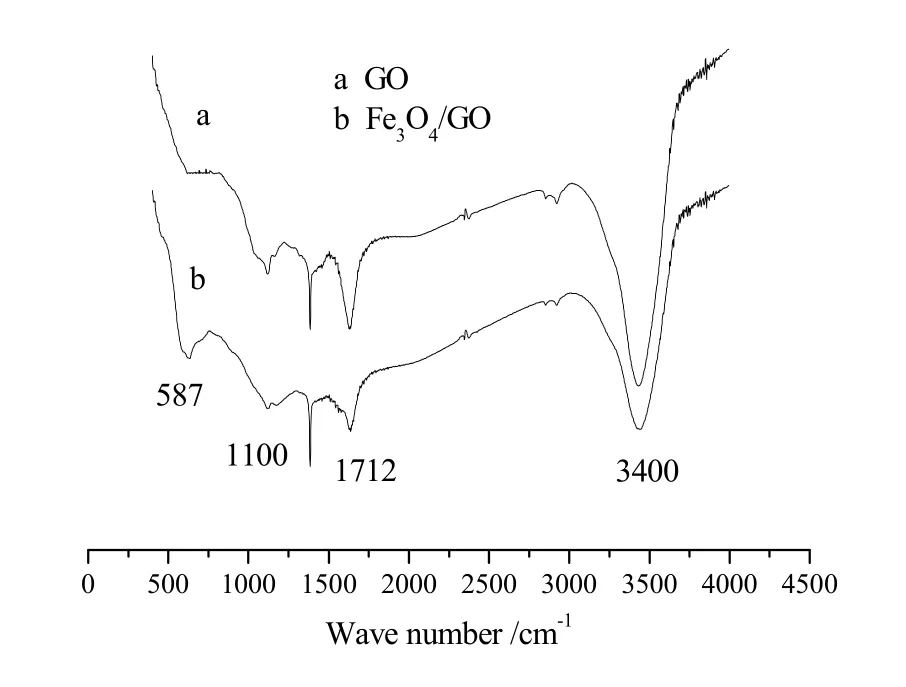
图2 (a)氧化石墨烯;(b)磁性Fe3O4/GO异质结的红外谱图Fig. 2 (a) FIRT spectra of GO; (b)FIRT spectra of Magnetic Fe3O4/GO
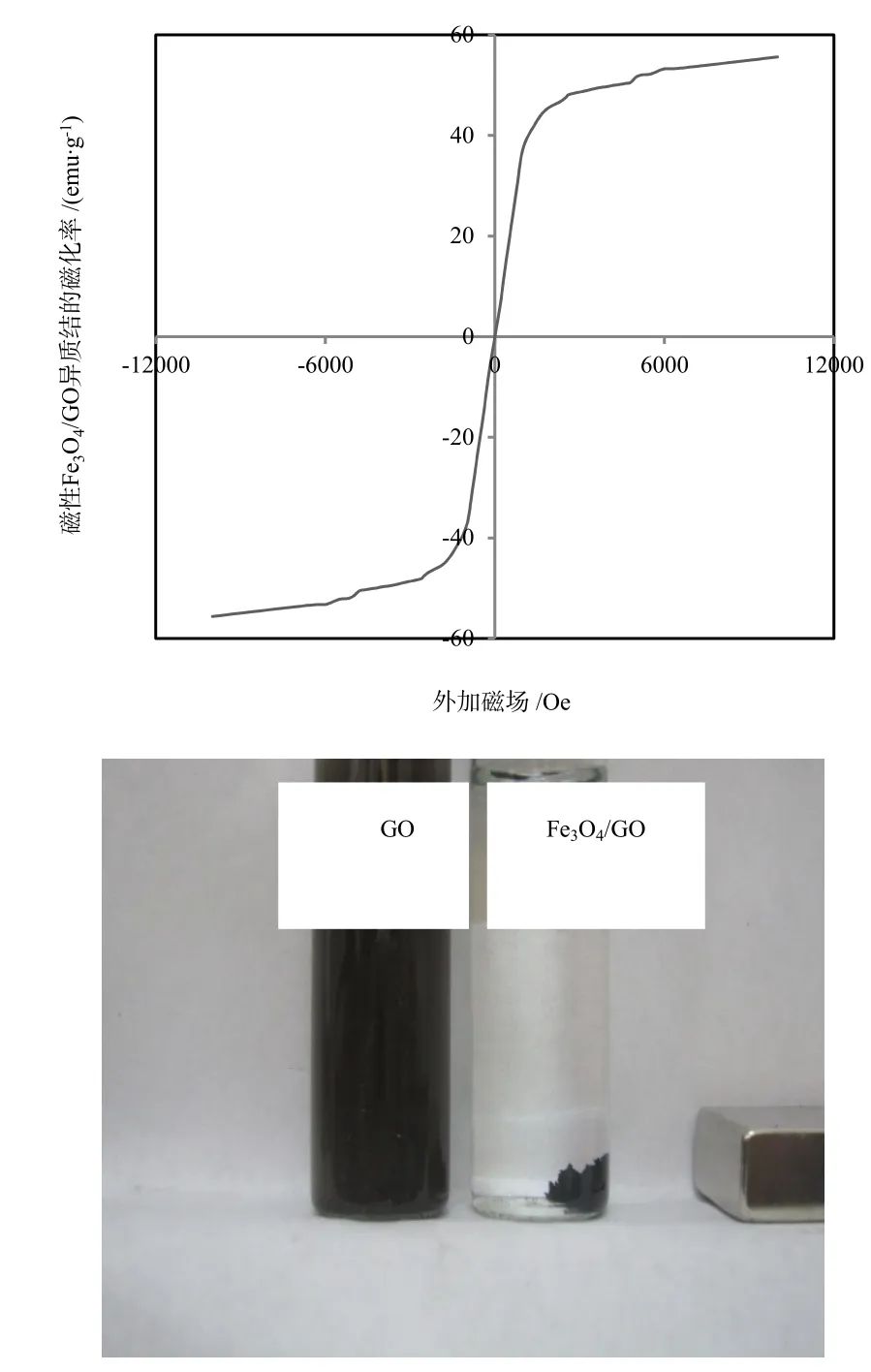
图3 (a)磁性Fe3O4/GO异质结的室温磁滞回线图;(b)磁性Fe3O4/GO异质结的磁吸附图Fig. 3 (a)Magnetic hysteresis loops of Fe3O4/GO heterojunction; (b) The photograph of GO and magnetic Fe3O4/GO after the presence of the magnet
在室温下测定±10000 Oe范围内磁性Fe3O4/GO异质结的磁滞回线。如图3所示,室温磁滞回线显示S形状,其矫顽力为280e,表现为室温铁磁性,其饱和磁化强度为55.6 emu·g-1,且在外加磁场的作用下磁性Fe3O4/GO异质结分离良好。如图3(b)所示为磁性Fe3O4/GO异质结的被磁铁从水中分离的表观图,左右两瓶是在外加磁场作用下10 mg·L-1浓度的GO和Fe3O4/GO溶液,由图3(b)可见磁性Fe3O4/GO异质结的分离效果良好,而GO因无磁性,不受磁场影响。
2.2 pH、温度和变性剂对固定化漆酶性质影响
不同pH值(2.0~7.0)条件下固定化漆酶和游离漆酶活性变化,如图4(a)所示。可以看出,固定化漆酶与游离漆酶活性随pH值变化的趋势基本一致。pH值在2.0~3.0范围内,固定化漆酶与游离漆酶活性随pH值的增加而升高,pH值为3.0时,游离漆酶活性达到最大,继续增加pH值,其相对活性减小,而固定化漆酶在pH值为2.0~4.0范围内,其活性保持增加趋势,在pH值为4的时候,固定化漆酶相对酶活依然保持为95.82%,而此时游离漆酶活性仅为56.18%。显然,漆酶在固定化后有更宽泛的pH适应范围。
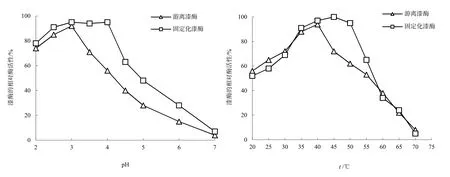
图4 (a)25 ℃条件下,pH值对酶活性的影响;(b)pH3.0条件下,温度对酶活性的影响Fig. 4 (a) the influence of pH on enzyme activity(25 ℃); (b) the influence of temperature on enzyme activity(pH3.0)
由于氧化石墨烯巨大的比表面积、表面能和带电状态提供了不同于游离态漆酶所处的独特微环境,从而影响漆酶活性部位(催化基团、结合基团)或者底物的局域浓度以及吸附状态,进而影响酶促反应(Iren等,2008)。一般来说,酶作为蛋白质,对pH值的变化比较敏感。当水溶液中pH发生改变,由于石墨烯巨大的比表面积,能对漆酶分子及其活性部位提供一定的保护作用,同时由于石墨烯表面存在大量的活性官能团,酶与石墨烯表面发生一定的物理和化学作用,从而提高了固定化漆酶对pH变化的适应范围。不同温度(20~70 ℃)条件下固定化漆酶和游离漆酶的活性变化,如图4(b)所示。
随着温度的升高,固定化漆酶和游离漆酶活性均呈先增大后减小的趋势,且与pH值的变化类似,固定化漆酶和游离漆酶活性分别在45和40 ℃时达到最大值。固定化漆酶最佳反应温度升高了5 ℃,且在 50 ℃时,固定化漆酶的相对活性依然保持在95%,漆酶耐热能力明显提高。
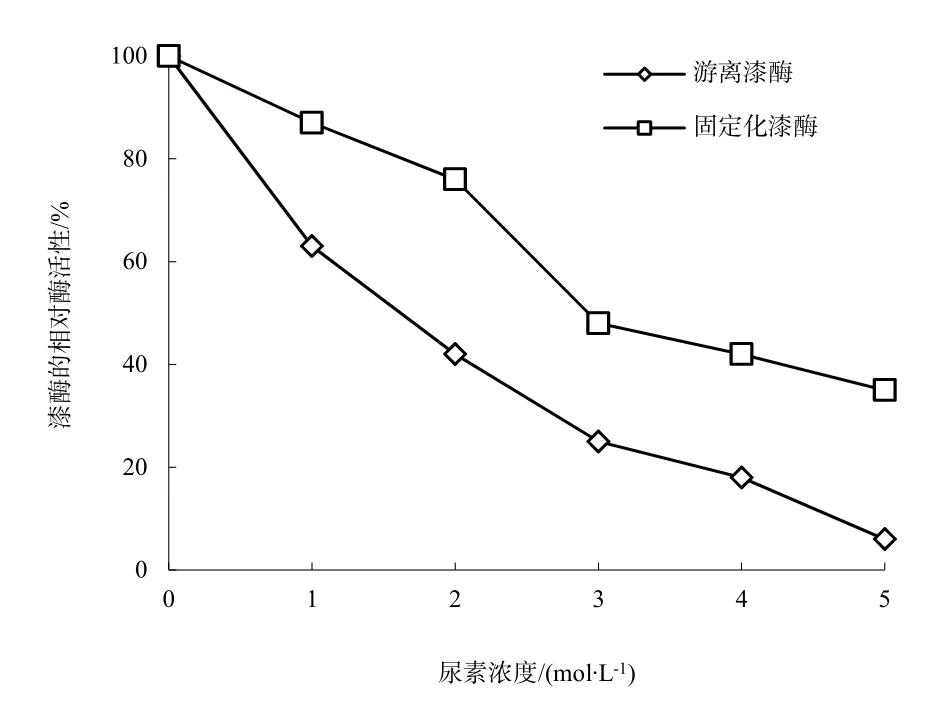
图5 变性剂对漆酶相对活性的影响Fig. 5 Denaturant for laccase relative activity
漆酶是蛋白质,变性剂可以导致蛋白质变性,因此会影响漆酶的实际应用。使用不同浓度的尿素为变性剂,对游离漆酶和固定化漆酶的活性进行了测定。图5是游离漆酶和固定化漆酶的相对活性随变性剂浓度变化的关系图。当变性剂浓度升高时,酶的相对活性明显降低,但总体上来说,固定化漆酶的下降幅度要大大低于游离漆酶。尿素浓度为 1 mol·L-1的时候,固定化漆酶的相对活性为87%,游离漆酶相对活性仅为63%;在尿素浓度为6 mol·L-1的时候固定化漆酶的相对活性依然保有35%,而此时游离漆酶几乎已经完全失去活性。
2.3 固定化漆酶的稳定性
图6(a)为固定化漆酶和游离漆酶在不同温度(25~75 ℃)中放置1 h后的相对活性变化。在相同放置温度和时间条件下,两者的剩余活性均随温度的升高而降低,但固定化漆酶的剩余活性相对较高。在 65 ℃以上的极端温度条件下,固定化漆酶仍保持最初活性的32%,而游离漆酶剩余活性仅为8%。由此可见,固定化后漆酶的热稳定性得到明显提高。

图6 (a)pH=3.0时漆酶的热稳定性;(b)pH=3.0时漆酶的储存稳定性Fig. 6 (a)the thermal stability of enzyme (pH 3.0); (b) the storage stability of enzymes (pH 3.0)
图6(b)为固定化漆酶和游离漆酶的储存稳定性图。由图可知,两者的剩余活性都随放置时间的延长而下降,游离漆酶的活性下降更为显著。放置30 d后,固定化漆酶活性依然保持为初始值的48%,而游离酶的活性只有初始值的12%,说明漆酶经过氧化石墨烯的固定化之后,贮存稳定性得到明显的提高。漆酶固定化后,氧化石墨烯独特的空间结构和表面性能对漆酶具有很好保护作用(王颖等,2013)。因此总体上看,固定化漆酶的抵抗化学变性和热变性的能力、热稳定性和贮存稳定性均得到了明显提高。
2.4 重复使用性能
为了减少实际使用成本,磁性微粒固定化酶在反应后可用磁铁分离,重复使用。图7表明,固定化酶在循环使用 10次后,其相对活性仍能保持初始值的82%左右,即磁性固定化酶能够多次反复使用。可见固定化漆酶具有良好的重复操作稳定性。
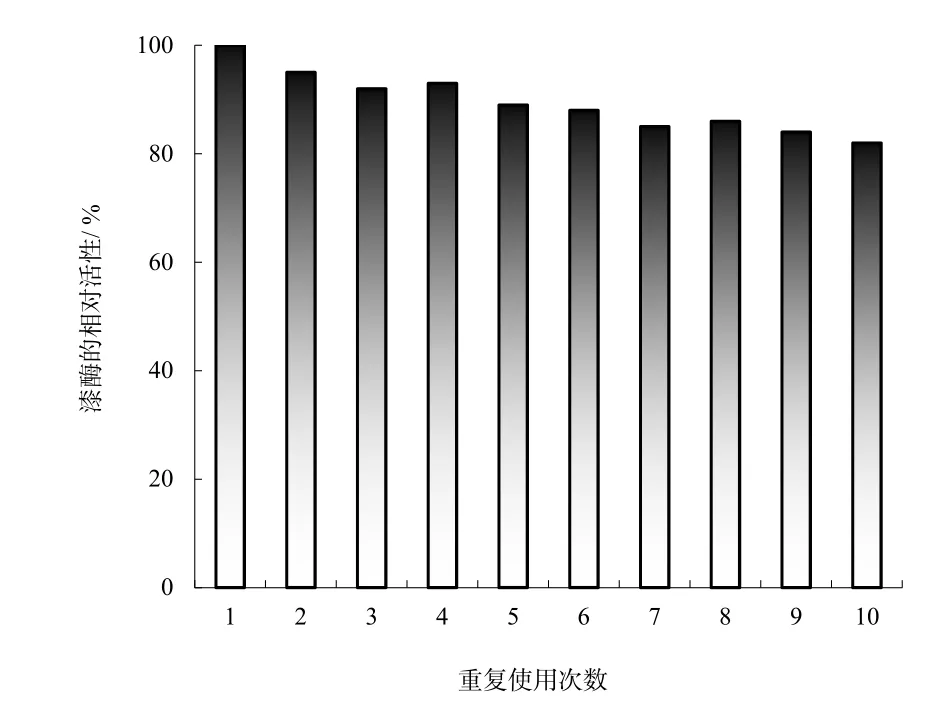
图7 漆酶的重复使用性能Fig. 7 Repeated use properties of laccase
2.5 固定化漆酶的动力学研究
米氏常数 Km是酶动力学的基本常数,表示当酶反应速度达到最大反应速度一半时的底物浓度,用于反映酶与底物的亲和力,即 Km越小,酶与底物的亲和力越大。Km值的物理意义是,即Km值小的酶可以在相对低的底物浓度条件下达到最大反应速度。配制系列浓度的底物,在50 ℃、pH值为3的反应条件下,测定不同浓度的底物开始反应 3 min的平均反应速度,即单位时间内转化底物的量,并按照方程(1)采用双倒数作图法来计算米氏常数(Qiu等,2005)。
由图8和式(1)可计算出,固定化漆酶的Km为 5.38×10-4mol·L-1,游离漆酶的 Km为 3.25×10-4mol·L-1,固定化酶的米氏常数 Km较游离酶的大,说明固定化酶与底物的亲和力比游离酶小。这显然与固定化后石墨烯载体的对酶催化活性中心的空间阻碍有关,同时底物与反应后产物的双向扩散也受到空间位阻的限制,速度会下降,从而导致固定化漆酶催化能力下降(Liu等,2005)。
2.6 固定化漆酶对BPA的降解效能
一般来说,作为一种典型环境内分泌干扰素,BPA在水体中的浓度往往很低。对于这种新型的低浓度有机物,催化剂要想更好的发挥催化性能,催化材料除了要由优良的催化性能外,还必须要有良好的吸附性能,有机物只有首先预富集于催化剂表面附近,在局部形成较高的浓度,才能被酶更有效降解,因此石墨烯的吸附性能对固定化漆酶降解BPA有重要的促进作用。
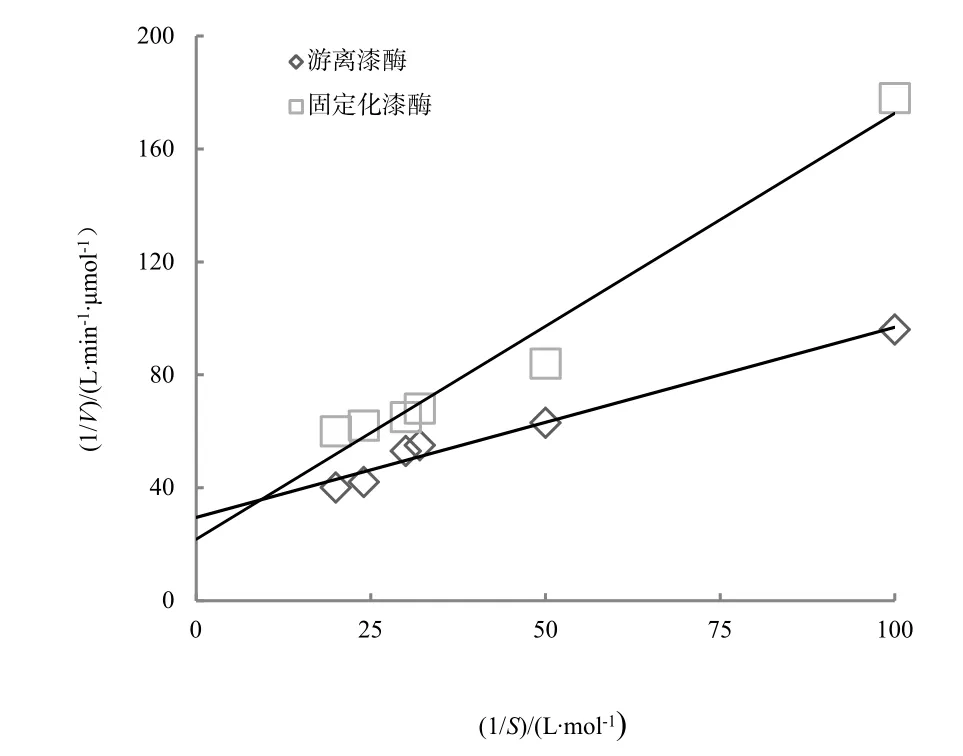
图8 游离酶和固定化酶的米氏方程双倒数Fig. 8 Mie equation of free enzyme and immobilized enzyme double bottom
磁性石墨烯作为载体,本身并不对 BPA具有降解能力,由图9可以看出,其对BPA具有一定的吸附能力,2 h后即达到吸附平衡,吸附率约为23%左右。利用磁性石墨烯固定化漆酶催化氧化BPA,反应18 h后,BPA的浓度由15 mg·L-1下降到2.70 mg·L-1,去除率可达82%,说明磁性石墨烯固定化漆酶对水中的BPA具有较好的催化氧化性能。

图9 石墨烯和固定化酶的吸附和降解效果Fig. 9 The adsorption and degradation of GO and immobilized enzyme
3 结论
以磁性氧化石墨烯为载体通过化学交联法固定漆酶。与游离漆酶相比,固定化漆酶在pH值为2.0~4.0范围内活性较为稳定,最适使用温度为45 ℃,25 ℃下保存50 d,剩余酶活仍为最初活性的95%;与游离漆酶相比,漆酶经过固定化后对pH值的适应能力、耐热性和稳定性均有所提高。对BPA的降解实验表明,磁性氧化石墨烯固定化漆酶对 BPA具有良好的降解性能。漆酶固定在磁性氧化石墨烯上后可经过 10次重复利用后,相对活性依然保持为初始活性的82%,具有良好的重复利用稳定性。
BEN Y S, BOUALLAGUI Z, SAYADI S, et al. 2012. Catalytic behavior and detoxifying abilityof an a typical homotrimeric laccase from the thermophilic strain Scytalidiumthermophilum on selected azo and triaryl methane dyes[J]. Journal of Molecular Catalysis B-Enzymatic, 79: 41-48.
HEEMKEN O P, REINCKE H, STACHEl B. 2001. The occurrence of xenoestrogens in the Elbe river and the North Sea[J]. Chemosphere, 45(3): 245-259.
IREN M, ANTONELLA G, SLIVIA T. 2008. Crystal structure of the blue multicoooer oxidase from the white-rot fungus Trametestrogii complexde with p-toluate[J]. Inorganica Chemica Acta, 361(14): 4129-4137.
JIANG D S, LONG S Y. 2005. Immobilization of pycnoporussanguineus laccase on magnetic chitosan microspheres[J]. Biochemical Engineering Journal, 25 (1): 15-231.
JOHANNES C, AJCHERCZYK M. 2000. Laccase activity tests and laccase inhibitors[J]. J. Biotechnol, 78(2): 193-199.
KANG J H, KONDO F. 2002. Effects of bacterial counts and temperature on the biodegradation of bisphenol A in river water. Chemosphere, 49: 493-498.
KHANI Z, JOLIVALT C, CRETIONM, et al. 2006. Alginate/Carbon composite beads for laccase and glucose oxidase encapsulation: applicat ion in biofuel cell technology[J]. BiotechnologyLetters, 28(22): 1779-17861.
KUMAR V V, KUMAR M P P, THIRUVENKADARAVI K V. 2012. Preparation and characterization of porous cross linked laccase aggregates for the decolorization of triphenyl methane and reactive dyes[J]. Bioresource Technology, 119: 28-34.
LEE K M, KALYANI D, TIWARI. 2012. Enhanced enzymatic hydrolysis of rice straw by removal of phenolic compounds using a novel laccase from yeast Yarrowiali polytica[J]. Bioresource Technology, 123: 636-645.
LI D, MULLER M B, GILJES, et al. 2008. Processable Aqueous Dispersions of Graphene Nanosheets[J]. Nature Nanotechnology 3: 101-105.
LI X, YI H B, ZHANG J W, et al. 2013. FeC-graphene hybrids: nanoscale characterization and their dynamic magnetic properties in gigahertz range, Journal of Nanoparicle Research, 15(3): 1472-1482.
LIU X Q, GUAN Y P, SHEN R, et al. 2005. Immobilization of lipase onto micron size magnetic beads[J]. Journal of Chromatography B, 822(1): 91-97.
LIORET L, HOLLMANN F, EIBES G. 2012. Immobilisation of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J]. Biodegradation, 23(3): 373-386.
NICOLUCCI C, ROSSI S, MENALE C. 2011. Biodegradation of bisphenolswith immobilized laccase or tyrosinase on polyacrylonitrilebeads[J]. Biodegradation, 22(3): 673-683.
PERALTA-ZAMORA P, PEREIRA C M, TIBURTIUS E R L, et al. 2003. Decolorization of reactive dyes by immobilized laccase[J]. Applied Catalysis B-Environmental, 42(2): 131-144.
QIU G M, ZHU B K, XU Y Y. 2005. α-Amylase Immobilized byFe3O4/Poly (styrene-co-maleioanhydride) Magnetic Composite Microspheres: Preparation and Characterization [J]. Journal of Applied Polymer Science, 95(3): 328-335.
QUAN D, SHIN W. 2004. Modification of electrode surface for covalent immobilization of lacease[J]. Materials Science and Engineering: C, 24(1): 113-1151.
REKUĆ A, BRYJAK J, SZYMAŃSKA K. 2010. Very stable silicagelbound laccase biocatalysts for the selective oxidation in continuous systems[J]. Bioresource Technology, 101(7): 2076-2083.
SAFE S H, PALLARONI L, YOON K, et al. 2002. Problems for risk assessment of endocrine active estrogenic compounds[J]. Environmental Health Perspectives, 110: 925-929.
HUMMERS W S, OFLFEMAN R E. 1958. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 80: 1339-1339.
秦伟程. 2001. 双酚 A生产现状与发展趋势[J]. 四川化工与腐蚀控制, 4(5): 32-36.
王颖, 张笛, 茹加, 等. 2013. 壳聚糖固定化漆酶酶学性质及其催化氧化水中2,4-二氯酚的效能与途径[J]. 环境化学, 32 (10): 1901-1907.
Catalytic Capacity and Enzymatic Characteristics of Immobilized Laccase on Magnetic Fe3O4/graphene Hybrids for Bisphenol A degradation
OUYANG Ke, XIE Shan*, ZHAO Ya, WANG Leichao, FANG Qihui
Department of Chemical and Environment Engineering, Wuyi University, Jiangmen 529020, China
Laccase was immobilized on Magnetic Fe3O4/graphenehybrids by the chemical coupling method. The BET of Magnetic Fe3O4/graphene hybrids was 726.34 m2·g-1; The enzymatic properties of the immobilized laccase and its catalytic capacity for BPA degradation were studied. In comparison to free laccase, the immobilized enzyme had better acid adaptability, and thermal and storage stability. Higher activity was observed for immobilized laccase at a pH value range of 2-4; over 95% of the initial activity of immoblized laccase was still observed at 50 ℃. After adding denaturant (1 mol·L-1), the activity of immoblized laccase was still 87%,much larger than that of free laccase(63%). The immoblized laccase possessed excellent reuse ablility, after reused 10 times, the activity of immoblized laccase was still 82.01%. After 10 days, 82.57% of the initial activity of immoblized laccase was retained. The immobilized laccase exhibited good catalytic capacity for removing BPA from aqueous solutions. When the amount of BPA was 15 mg·L-1, the removal efficiency of BPA in water (the concentration of immobilized laccase catalyst was 10 mg·L-1) reached 82% after 18 hours. The results indicated that the excellent absorb ability of graphene had good effect on the remove rate of BPA in water.
immobilized laccase; enzymatic property; 2,4-dichlorophenol; stability
X52
A
1674-5906(2015)01-0106-07
10.16258/j.cnki.1674-5906.2015.01.016
欧阳科,谢珊,赵雅,王雷超,方琪惠. 磁性Fe3O4/石墨烯异质结固定漆酶特性及其对水中双酚A的降解研究[J].生态环境学报, 2015, 24(1): 106-112.
OUYANG Ke, XIE Shan, ZHAO Ya, WANG Leichao, FANG Qihui. Catalytic Capacity and Enzymatic Characteristics of Immobilized Laccase on Magnetic Fe3O4/graphene Hybrids for Bisphenol A Degradation [J]. Ecology and Environmental Sciences, 2015, 24(1): 106-112.
国家自然科学基金项目(51308421);五邑大学青年科学基金项目(2014ZK03);广东省高等学校优秀青年教师培养计划(3211700203)
欧阳科(1978年),男,副教授,博士,从事水污染控制和固体废物资源化研究。*通讯联系人:E-mail: wyuchemxs@126.com
2014-11-21
