干旱胁迫下两种委陵菜叶绿体超微结构及光合生理特性
2015-12-05郭瑶,王玲
郭 瑶,王 玲
(1.吉林建筑大学 城建学院,长春,130111;2.东北林业大学 园林学院,哈尔滨150040)
近年来,在全球气候变化背景下干旱频繁发生且日趋严重,大部分国家和地区都不同程度地受到干旱威胁[1],干旱胁迫已成为限制植物正常生长发育及生理代谢的关键因素。
委陵菜(Potentilla chinensis)和翻白委陵菜(P.discolor)是蔷薇科委陵菜属的多年生宿根草本植物。委陵菜属植物种类较多,约300余种,大多分布在北半球的寒带、温带以及高山地区,我国有80余种,全国各地均有,但主要生长在东北、西北和西南地区[2]。委陵菜属植物叶为指状或羽状复叶,花黄色、白色或红色,瘦果多数,茎直立、上升或匍匐[3]。该属植物抗逆性较强,具有较好的抗旱、抗寒性,还有良好的涵养水源、保持水土及护坡作用,植株也具有一定的观赏性,已陆续的应用在城市园林绿化和景观配置中,能够起到独特的绿化美化作用,并表现出了良好的适应性。当前,城市园林中所应用的委陵菜属植物种类并不多,还有大量的资源可以被开发利用,值得去研究并推广应用。目前对委陵菜属植物的研究,主要集中在药用价值、观赏价值、花粉形态、抗旱性、引种驯化、资源开发利用、叶表皮形态等的研究[4-9]。本研究通过对不同水分胁迫程度下委陵菜和翻白委陵菜叶片超微结构以及光合生理特性的变化进行差异分析,为两种植物适应干旱环境能力强弱的综合评价提供更多的参考数据,也为委陵菜属植物抗旱性评价提供基础参数。
1 材料与方法
1.1 试验材料培养及采集
试验在东北林业大学苗圃中进行,播种、培养委陵菜和翻白委陵菜的一龄幼苗做为试验材料。两种委陵菜的野生种子于2010年8月采集自大庆草原,并于2011年3月开始播种,之后将幼苗移栽至高12cm、口径为9cm的花盆中,保证每盆栽植1株幼苗,基质选用土和草炭比例为3∶1的草炭土,基质量为距离盆口2cm左右。将植株置于同一室内环境中,并保持良好的温度、光照和通风条件,采取一致的养护栽培管理。
1.2 试验处理及取样
于2012年6月选取发育良好、长势一致的植株进行水分处理。设对照组和处理组,采用称重法控制水分。对照组维持正常的土壤含水量,使其土壤含水量保持在35%~40%之间;处理组则持续30d停止供水,试验开始后每5d进行一次取样,测定各干旱胁迫阶段土壤含水量、叶片含水量、叶绿素含量和光合生理因子。当处理组土壤含水量在25%~30%(轻度干旱胁迫)、15%~20%(中度干旱胁迫)、5%~10%(重度干旱胁迫)时,进行植物取样,观察叶绿体超微结构,各试验时间节点取样均要求重复3次。
1.3 试验方法
1.3.1 土壤含水量的测定
每次测定时分别取对照组和处理组的原状土样,所取土样为距离盆口0~6cm的土层,重量10g左右。测量方法采用称重法,将土样放入105℃的烘箱内连续烘干8h,之后放入80℃的烘箱内24h,计算土壤含水量,计算公式如下:
土壤含水量(%)=(湿土质量-烘干后质量)/烘干后质量×100%
1.3.2 叶片相对含水量、叶绿素含量的测定
采用烘干称重法[10]测定叶片含水量;叶绿素含量采用乙醇浸提法测定[11]。
1.3.3 叶片超显微结构样品的制备
取两组植株中部位相同、大小相近的叶片,用刀片切取靠近叶片中脉的部位制备试验样品,样品切成约为1 mm×1 mm的小块,切下后迅速将其放入3%的戊二醛溶液中固定24 h以上,之后在磷酸缓冲液中漂洗20min并重复3次,于4℃条件下移至1%的锇酸中固定4h,去离子水漂洗3次,每次20min;接下来一步是脱水,选用的脱水试剂是乙醇,最后用环氧树脂812包埋。切片采用的超薄切片机型号为LKB-5型;经过醋酸双氧铀和柠檬酸铅双染后;采用H7650型透射电镜观察并照相[12]。
每一土壤含水量下,随机选取15个视野,用面积表示测量叶绿体的大小,每个视野的测量重复3次,取其平均值。
叶绿体变化率=(对照下大小—重度胁迫下大小)/对照下大小×100%
1.3.4 光合作用相关生理指标的测定
在天气晴朗、无风条件下的9:00-11:00期间,采用LI-6400便携式光合测定仪测定叶片净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)、胞间 CO2浓度(Ci,μmol·mol-1),并计算水分利用率(WUE=Pn/Tr,μmol/mmol)。每一土壤含水量下,选取大小相似、生长良好的4片叶子,以自然光为光源进行测定,每次测量重复5次,并将测定的叶片做好标记。
2 结果与分析
2.1 干旱胁迫下土壤含水量、叶片相对含水量和叶绿素含量的变化
2.1.1 干旱胁迫下土壤含水量的变化
从图1可以看出,随着干旱胁迫天数的增加,处理组的委陵菜和翻白委陵菜土壤含水量均呈现逐渐的减小的趋势。胁迫第5d时两种植物的土壤含水量均处于25%~30%之间,此时是轻度胁迫阶段;胁迫进入到第10~15d阶段时,土壤含水量在15%~20%范围内,处于中度胁迫阶段;当胁迫进入到第20~25d时,土壤含水量处在15%~20%之间,属于重度胁迫阶段。
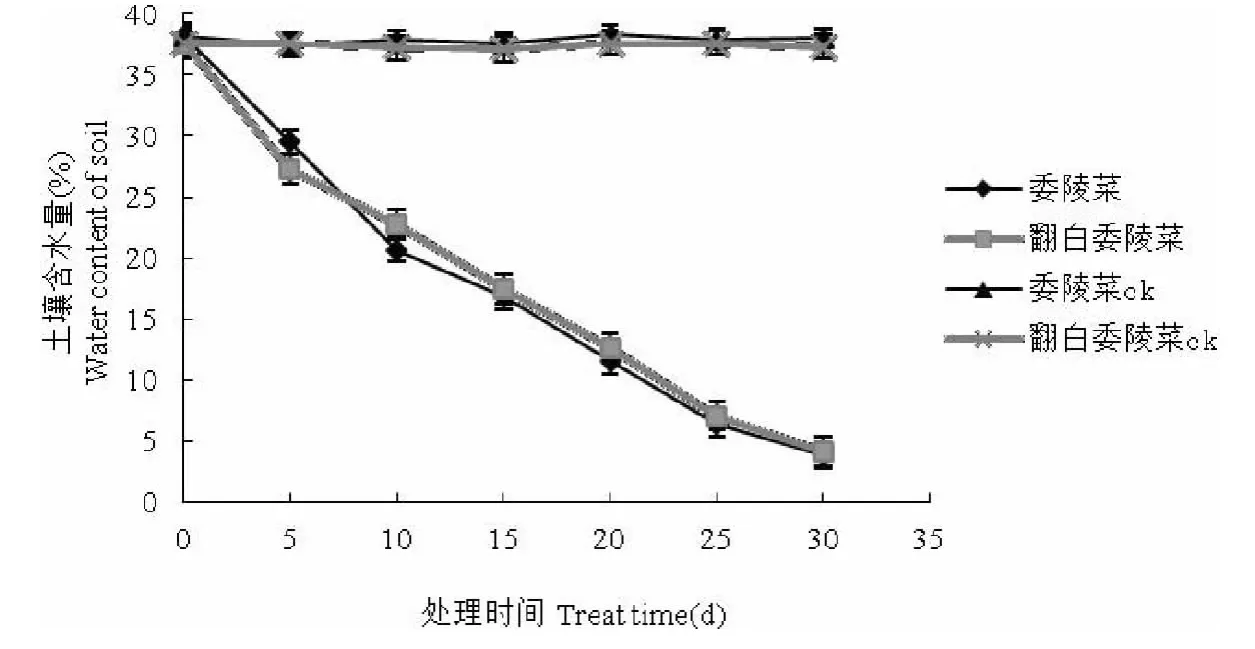
图1 干旱胁迫对土壤含水量的影响Fig.1 The impact of drought stress on water content of soil
2.1.2 干旱胁迫下叶片含水量的变化
逆境条件下植物叶片相对含水量可反映植物的保水能力,是标志植物水分状况的重要指标[13]。由图2可知,随着水分胁迫天数的增加两种植物的叶片含水量均呈现持续下降的趋势,在胁迫的第5d~10d委陵菜下降的幅度最大,为21.53%;翻白委陵菜叶片含水量最大幅度的下降则出现在胁迫的第10d~15d,下降幅度为21.6%。胁迫末期时委陵菜和翻白委陵菜叶片含水量的下降幅度分别达到了78.8%、75.14%,委陵菜叶片含水量的下降幅度大于翻白委陵菜。
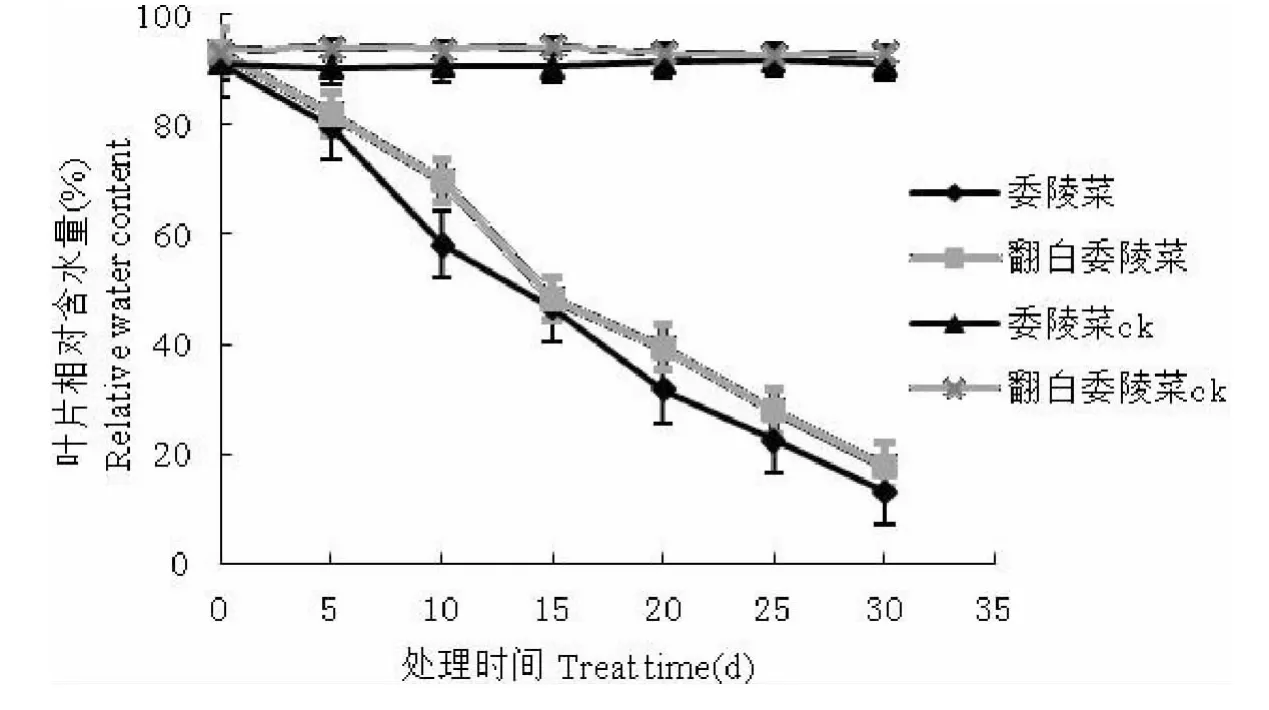
图2 干旱胁迫对叶片含水量的影响Fig.2 The impact of drought stress on leaves relative water content
2.1.3 干旱胁迫下叶片叶绿素含量的变化
由图3可知,两种植物的叶绿素含量均随着干旱胁迫的加重呈持续下降的趋势。委陵菜和翻白委陵菜叶绿素含量最大幅度的下降分别出现在胁迫的第10d~15d和胁迫的第15d~20d。干旱胁迫30d后,同正常状态相比委陵菜和翻白委陵菜叶绿素含量分别下降了56.9%、48.98%,表明受干旱胁迫后委陵菜叶绿素的含量低于翻白委陵菜。
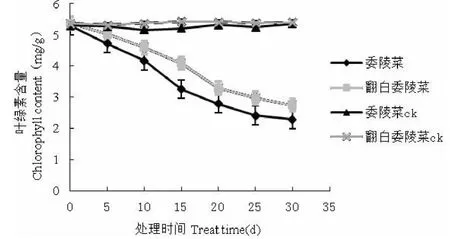
图3 干旱胁迫对叶片叶绿素含量的影响Fig.3 The impact of drought stress on Chlorophyll content
2.2 干旱胁迫下叶绿体超微结构及大小的变化
正常供水条件下,委陵菜和翻白委陵菜的叶肉细胞形态和叶绿体超微结构都基本一致。叶肉细胞结构完整、发育正常,叶绿体数量丰富,结构规则,大多呈长椭圆形,与细胞壁紧密结合并整齐单行排列。叶绿体内片层清晰可见,排列整齐有序,方向与叶绿体长轴基本平行,基质浓厚,可见淀粉粒和少量的嗜锇颗粒(图4-A,图4-E)。此时,植物能够进行正常的光合作用。
轻度干旱胁迫时,部分叶绿体体积变大,渐渐向细胞中央移动,不再与细胞壁紧贴,细胞壁厚度略有增加,少量类囊体片层结构不再是整齐排列开始变得扭曲、膨胀,嗜锇颗粒变多。委陵菜叶绿体超微结构变化的程度要比翻白委陵菜明显(图4-B,图4-F)。
中度胁迫时,叶片细胞壁明显增厚,大部分叶绿体开始膨胀,由正常状态下的长椭圆形变成了球形,叶绿体脱离了细胞壁,出现了质壁分离,外膜不再清晰。委陵菜叶绿体外膜局部出现了破裂,基粒片层排列松散、分辨不清且方向改变,类囊体变得肿胀,已有透明腔产生(图4-C);翻白委陵菜的叶绿体结构同样出现了扩张、分离、扭曲,但依然可以看到一些排列有序的片层结构(图4-G)。
重度胁迫时,委陵菜叶绿体形态变得不规则,边缘粗糙,被膜破裂,内含物外流,完全与质膜分离,片层结构排列紊乱,部分溶解,类囊体膜互相贴叠,嗜锇颗粒膨大(图4-D)。翻白委陵菜的叶绿体团聚在一起,发生了粘连现象,膜结构模糊不清,但少部分尚未破裂,基粒片层模糊不清,嗜锇颗粒明显增多(图4-H)。

图4 干旱胁迫对两种委陵菜叶片叶绿体超微结构的影响Fig.4 Effect of drought stress on chloroplast in leaves of two Potentilla species
Ch,叶绿体;CW,细胞壁;GL,基粒;OG,嗜锇颗粒
随着干旱胁迫程度加重,叶绿体减小,且不同土壤含水量间差异显著(P<0.05)。委陵菜受重度干旱胁迫后叶绿体变化率为77.19%,而翻白委陵菜叶绿体的变化率为71.22%(表1,图4)。
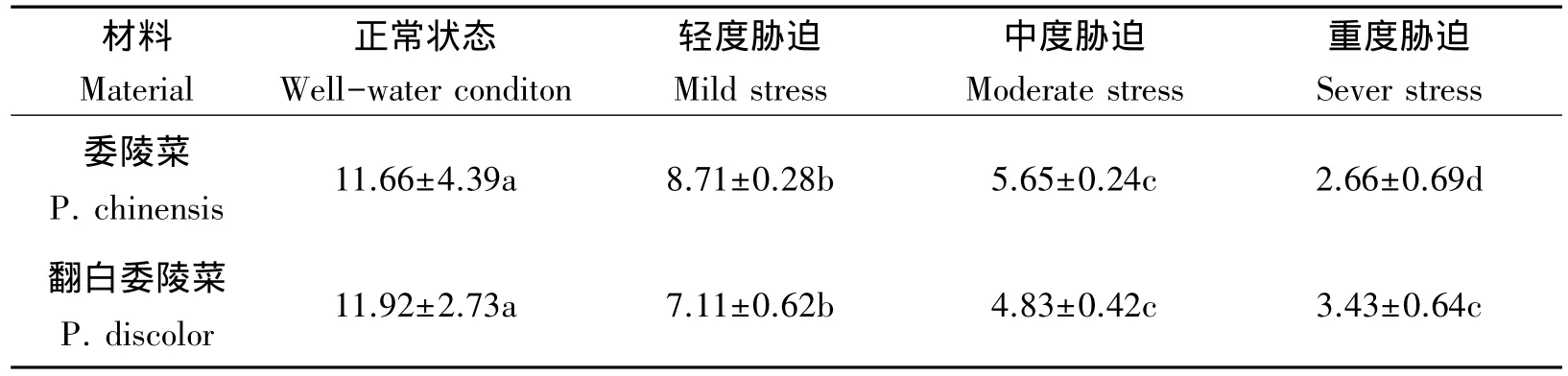
表1 干旱胁迫对两种委陵菜叶绿体大小(μm2)的影响Tab 1 Effects of drought stress on chloroplast size of twoPotentilla species
2.3 干旱胁迫下各光合生理特性的变化
2.3.1 干旱胁迫下叶片净光合速率、蒸腾速率和水分利用率的变化
水分胁迫会导致叶绿体光合机构的破坏,引起光合CO2同化效率的降低,使叶片光合速率降低[14]。在整个干旱胁迫过程中两种委陵菜属植物对照组的净光合速率(Pn)变化不大,且一直维持在较高的水平。处理组则从胁迫开始Pn便呈现出逐渐下降的趋势,在胁迫的第10~15d期间委陵菜Pn下降幅度最大,此时正处于轻度到中度胁迫的过渡期;翻白委陵菜Pn大幅下降出现在胁迫的第15~20d,此时胁迫处于中度到重度的过渡期。委陵菜Pn的下降幅度要大于翻白委陵菜,且相同胁迫天数翻白委陵菜的Pn都要高于委陵菜(图5)。
对照组的蒸腾速率(Tr)一直相对平稳,保持在 5.7μmol·m-2·s-1至 6.4μmol·m-2·s-1之间;处理组随着胁迫时间的延长,两种委陵菜属植物叶片的Tr则越来越小,Tr大幅度的下降均出现在胁迫的第10~15d期间,但胁迫过程中翻白委陵菜Tr的数值均高于委陵菜(图5)。
水分利用效率(WUE)可以反映光合作用与蒸腾作用之间的关系,它提供了有关水分代谢功能的信息[15]。两种植物对照组的WUE变化不大;处理组总体上呈先上升后下降的趋势,委陵菜和翻白委陵菜WUE 的平均值分别为 1.46μmol·mmol-1和 1.49μmol·mmol-1,后者略高于前者(图5)。
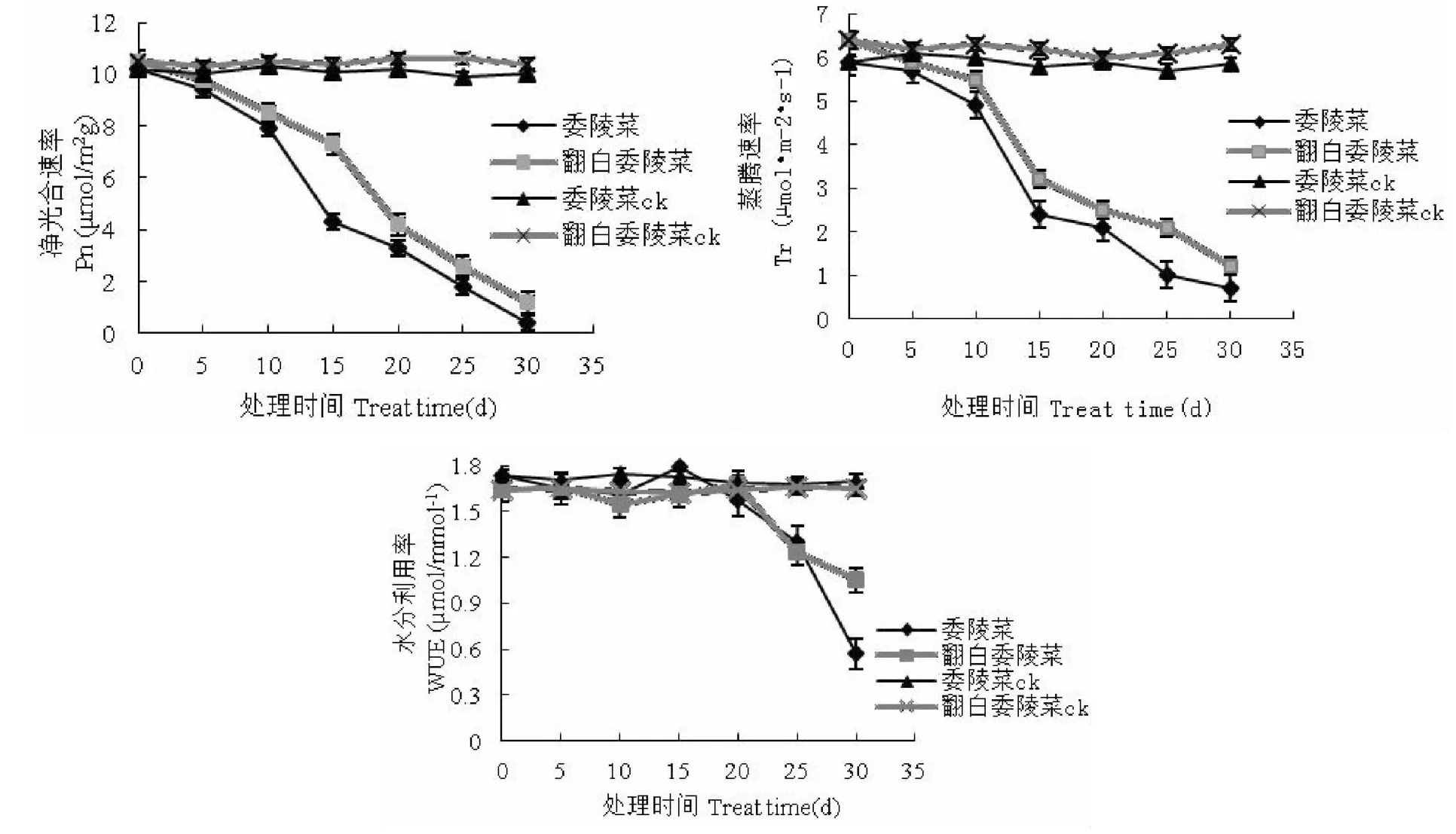
图5 干旱胁迫对叶片净光合速率、叶片蒸腾速率、水分利用率的影响Fig.5 Effect of drought stress on net photosynthetic rate,transpiration rate and WUE of leaf
2.3.2 干旱胁迫下叶片胞间CO2浓度、气孔导度的变化
两种植物对照组的叶片胞间CO2浓度(Ci)变化幅度不大,比较稳定。处理组中Ci的变化基本呈逐渐上升的趋势,干旱胁迫的前10d委陵菜的Ci值同对照组差异不大,数值波动也很小,第10d之后开始明显上升;翻白委陵菜则是在胁迫15d后开始与对照组形成明显的差异,Ci值表现出大幅的升高(图6)。
随着干旱胁迫的加剧,两种委陵菜属植物气孔导度(Gs)总体表现为下降的趋势,Gs的下降均在第15~20d期间表现得最为显著,胁迫开始后委陵菜的Gs基本上都小于翻白委陵菜(图6)。
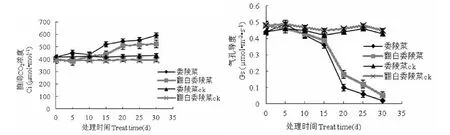
图6 干旱胁迫对叶片胞间CO2浓度、气孔导度的影响Fig.6 Effect of drought stress on Ci and stomata conductance of leaf
2.4 土壤含水量与各光合因子的相关性分析
由表2可见,土壤含水量同委陵菜和翻白委陵菜的Pn、Tr、Gs均呈极显著正相关,同Ci呈极显著负相关,其中同Pn的相关系数最大。说明土壤含水量与各光合因子间均存在一定的相关性,某一指标的改变都会对其它因子产生一定的影响。
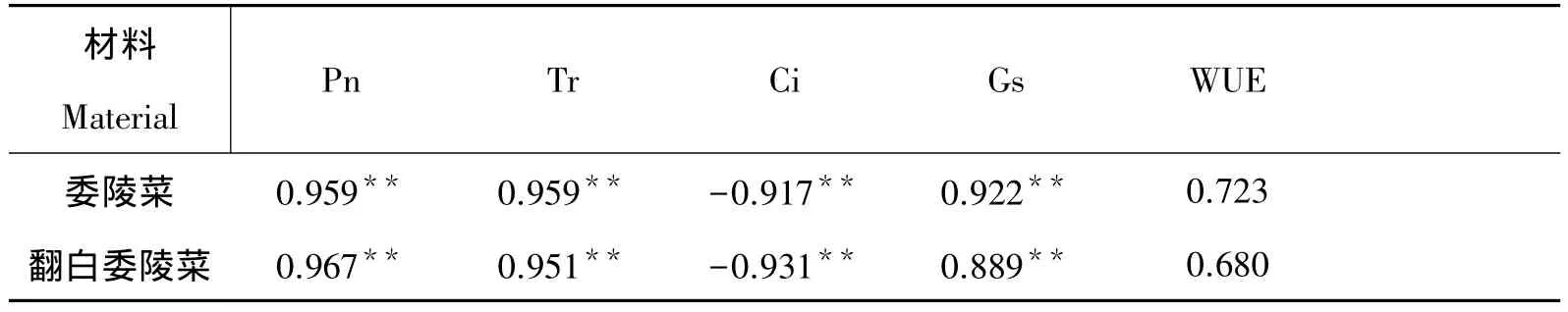
表2 两种委陵菜土壤含水量与光合指标间的相关性分析Tab 2 Correlation analysis between photosynthetic indexes and water
3 讨论和结论
水分亏缺已经成为限制植物生长最普遍的非生物因素之一[16]。植物体直接暴露在环境中面积最大的器官是叶片,因此,当植物受到外界不良环境胁迫时,叶片最容易因适应环境而改变其自身的形态和结构[17-19]。在干旱胁迫下,植物细胞的超微结构会发生明显的变化[20],叶片细胞中叶绿体是对于干旱胁迫表现较为敏感并有着比较重要生理功能的细胞器。本研究对委陵菜和翻白委陵菜采取相同的干旱胁迫处理,通过叶片含水量、叶绿素含量、叶绿体大小变化率、叶绿体超微结构以及光合生理指标的变化来比较两种植物耐旱能力的强弱。研究结果表明,两种植物的抗旱能力为翻白委陵菜>委陵菜。
叶片含水量可以反映植物体内水分的状况以及叶片的保水能力;叶绿素含量的高低在很大程度上反映了某种植物叶片光合作用的强弱,并在一定程度上可以作为衡量叶片衰老的指标[21]。试验还测定了叶绿体大小的变化率,它可以作为判断和比较植物抵抗外界不良环境能力的依据。郁慧[22]、白志英[23]、张金政[24]、宋家壮[25]、初晓辉[26]分别对干旱胁迫下不同植物叶绿体结构受损程度、叶绿素含量进行研究,结果表明当植物受到相同程度的干旱胁迫时,叶绿体被破坏的程度越严重,植物的抗旱能力越弱。本研究中,受干旱胁迫后委陵菜的叶片含水量、叶绿素含量均比翻白委陵菜低,但叶绿体的变化率却比翻白委陵菜大,表明受相同程度干旱胁迫时委陵菜叶绿体的受损程度更为严重。
叶绿素是植物进行光合作用的物质基础,在光合作用中起着吸能和转能的作用[27]。干旱胁迫条件下,气孔导度与叶片蒸腾的强弱同步变化,随着气孔闭合数量的增加,植物的蒸腾作用相应的受到了抑制,光合速率也随之下降[28]。叶绿体基粒和基粒片层数越多,基粒片层排列越致密,光合能力越强[29]。当叶绿体基粒片层和基质片层受到外界环境胁迫而破坏解体甚至消失时,会抑制光合作用的正常进行[28]。本研究表明,干旱胁迫开始后随着土壤含水量的降低,叶绿体受损程度的加重,两种植物的Pn、Tr和Gs均呈现逐渐下降的趋势,Ci则在胁迫初期时有所下降,之后便一直处于不断升高的趋势。光合作用受气孔和非气孔因素影响,委陵菜属的这两种植物受到轻度干旱胁迫时,Ci都下降了,说明此时造成光合速率下降的主要因素是气孔关闭;随着胁迫程度的加重,光合速率仍然在不断的减小,但Ci却开始升高,表明此时光合速率的下降受非气孔因素的限制。光合速率的减弱有一个从气孔限制向叶肉细胞光合活性限制转变的过程,也就是由气孔限制因素向非气孔因素转变的过程,表现为光合器官活性的下降[30]。WUE是反映植物光合特性和蒸腾特性的综合指标,用来说明植物消耗单位质量的水分能够固定CO2的数量[31],WUE若下降说明Pn下降的幅度要大于Tr,若升高则说明Tr下降的幅度要大于Pn。土壤含水量和光合因子相关性分析表明了干旱对于植物光合性能的影响。通过分析比较受干旱胁迫后两种委陵菜光合性能的变化发现,两者光合生理指标的变化趋势基本一致,但胁迫天数相同时委陵菜叶绿体超微结构和各光合指标的变化基本都比翻白委陵菜显著,各阶段数值变化的幅度也基本大于翻白委陵菜,说明和翻白委陵菜相比委陵菜的抗旱能力相对较弱。
综上所述,干旱胁迫条件相同时,对翻白委陵菜的影响要小于委陵菜,两种植物均具有一定的抗旱能力,但委陵菜的抗旱能力比翻白委陵菜弱。叶片含水量、叶绿素含量、叶绿体超微结构和光合生理指标均可作为综合评价不同委陵菜属植物抗旱能力强弱的基础参数,本研究结果可作为干旱地区绿化植物种类选择的重要参考依据,还可为植物种类的抗旱性选育提供生理方面以及细胞学方面的资料。
[1]田其云,曹艳英.我国干旱半干旱地区治理环境资源问题的技术规范探讨[J].干旱区资源与环境,2005,19(3):98-103.
[2]韦梅琴,李军乔.委陵菜属四种植物茎叶解剖结构的比较研究[J].青海师范大学学报(自然科学版),2003(3):48-54.
[3]李书心.辽宁植物志[M].沈阳:辽宁科学技术出版社,1992:732-880.
[4]卞勇,吕冬霞,张玉泉,等.扁蓄和叉叶委陵菜的草坪利用研究[J].草业科学,2004,21(7):66-68.
[5]王晓红,王索玲,姜殿勤,等.野生地被植物光叉委陵菜的引种栽培[J].长春大学学报(自然科学版),2006,16(3):69-71.
[6]郝庆云,张英丽,乔建国,等.匍枝委陵菜引种驯化试验[J].河北林果研究,2005,20(4):407-410.
[7]由凤丽,梁彦涛,曲丽娜,等.大庆地区委陵菜属植物花粉形态研究[J].中国农学通报,2010,26(16):337-340.
[8]田丽,周新宗,孙航,等.7种委陵菜属植物叶表皮微形态的研究[J].草业科学,2009,26(2):53-56.
[9]吴建慧,崔艳桃,赵倩竹,等.干旱胁迫下4种委陵菜属植物叶片的超微结构[J].草业科学,2012,29(11):1724-1730.
[10]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004.
[12]郭瑶.干旱胁迫对绢毛委陵菜结构和生理的影响[D].哈尔滨:东北林业大学,2012.
[13]霍红,张勇,陈年来,等.干旱胁迫下五种荒漠灌木苗期的生理响应和抗旱评价[J].干旱区资源与环境,2011,25(1):185-189.
[14]郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):643-649.
[15]王磊,张彤,丁圣彦.干旱和复水对不同倍性小麦光合生理生态的影响[J].生态学报,2008,28(4):1593-1600.
[16]杜建雄,师尚礼,刘金荣,等.干旱胁迫和复水对草地早熟禾3个品种生理特性的影响[J].草地学报,2010,18(1):73-77.
[17]Castro-Diez P,Puyravaud J P,Cornelissen J H C.Leaf structure and anatomy as related to leaf mass per area variation in seedlings of a wide range of woody plant species and types[J].Oecologia,2000(124):476-486.
[18]England Jacqueline R,Attiwil Peter M.Changes in leaf morphology and anatomy with tree age and heigh in the species,Eucalyptu regnans F.Muell[J].Trees Structure and Function,2006(20):79-90.
[19]Kocsis M,Darok J,Borhidi A.Comparative leaf anatomy and morphology of some neotropical Rondeletia(Rubiaceae)species[J].Plant Systematics and Evolution,2004(248):205-218.
[20]任丽花,黄敏敏,江枝和,等.干旱胁迫对圆叶决明叶片超微结构的影响[J].中国草地学报,2008,30(1):30-34.
[21]赵莉,潘远智,朱峤,等.6-BA、GA3和IBA对香水百合叶绿素含量及抗氧化物酶活性的影响[J].草业学报,2012,21(5):248-256.
[22]郁慧,刘中亮,胡宏亮,等.干旱胁迫对5种植物叶绿体和线粒体超微结构的影响[J].植物研究,2011,31(2):152-158.
[23]白志英,李存东,屈平.干旱胁迫对小麦中国春-Synthetic 6x代换系叶片超微结构的影响[J].电子显微学报,2009,28(1):68-73.
[24]张金政,张起源,孙国峰,等.干旱胁迫及复水对玉簪生长和光合作用的影响[J].草业学报,2014,23(1):167-176.
[25]宋家壮,李萍萍,付为国.水分胁迫及复水对虉草生理生化特性的影响[J].草业学报,2012,21(2):62-69.
[26]初晓辉,刀丽琼,谢堂民,等.马蹄金草坪草对干旱胁迫的生理响应研究[J].草地学报,2014,22(1):134-138.
[27]贾学静,董立花,丁春邦,等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响[J].草业学报,2013,22(5):248-255.
[28]吴建慧,郭瑶,崔艳桃.水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响[J].草业科学,2012,29(3):434-439.
[29]段瑞军,胡新文,符少萍,等.盐胁迫下海马齿叶肉细胞超微结构观察[J].热带作物学报,2010,31(3):397-403.
[30]姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制[J].热带农业科学,2005,4(25):80-85.
[31]廖行,王百田,武晶,等.不同水分条件下核桃蒸腾速率与光合速率的研究[J].水土保持研究,2007,14(4):30-34.
