低温胁迫下外源水杨酸对栝楼幼苗抗寒性影响*
2015-12-05王利华徐根娣
刘 鹏, 曹 林, 王利华, 刘 丹, 徐根娣, 马 丽, 郦 枫
(浙江师范大学生态研究所,浙江金华 321004)
低温胁迫下外源水杨酸对栝楼幼苗抗寒性影响*
刘 鹏, 曹 林, 王利华, 刘 丹, 徐根娣, 马 丽, 郦 枫
(浙江师范大学生态研究所,浙江金华 321004)
以耐寒性较强的三门峡栝楼和耐寒性较弱的安庆栝楼为实验材料,研究了低温(4℃)胁迫下喷施不同浓度(0,0.25,0.5,1和2 mmol/L)的水杨酸溶液对栝楼幼苗叶片生理生长特性及抗氧化酶活性的影响.实验结果表明:在低温处理下,2个品种栝楼幼苗的细胞膜透性、游离脯氨酸(Pro)含量和可溶性蛋白含量均增加(P<0.05),而相对水含量出现了相反的变化趋势,植株超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)、酯酶(EST)和细胞色素氧化酶(CYT)的活性呈现增加的现象,显示出2个栝楼品种的耐寒性差异;喷施低浓度的水杨酸溶液能够显著降低植株的相对电导率、质膜透性及Pro和可溶性蛋白的含量,而高浓度的水杨酸对于降低植株SOD,POD,PPO,EST和CYT的活性均没有低浓度的显著.由此可知,适宜浓度的水杨酸有缓解栝楼低温胁迫的效果,但不能消除冷胁迫对栝楼生长的抑制作用.外源水杨酸缓解栝楼低温胁迫的最适浓度是0.5 mmol/L.
水杨酸;栝楼;低温胁迫;抗寒性
栝楼(Trichosanthes kirilowii Maxim)是一种多年生的攀缘草本植物,也称瓜萎、吊瓜,属葫芦科.近年来对于栝楼的研究主要侧重于种质资源[1]、亲缘关系[2]、繁殖[3]及耐铝性[4-5]等方面,而对栝楼抗寒性的研究较少.水杨酸(Salicylic acid)是一种简单的酚类化合物,广泛存在于植物体内,在植物抗逆生理中具有重要的作用,为植物对逆境反应的信号传导分子,能够诱导相关蛋白基因表达,引发系统获得性抗性.水杨酸已被证明能够调节植物许多抗逆生理过程,如抗病性、抗盐性、抗寒性和抗旱性等[6].目前,栝楼产业已在我国开始蓬勃发展,已经在生产中创造了很大的经济效益,但也面临一些问题,尤其是面对冬季昼夜温差较大、气候异变等冷冻害带来的经济损失.近年来国内外在作物寒害方面做了许多的研究工作,但有关水杨酸对栝楼抗寒性的系统研究在国内外至今还少见报道.本实验以耐寒性不同的三门峡栝楼和安庆栝楼为材料,研究了在低温胁迫下不同浓度的水杨酸处理时膜脂的过氧化水平和体内酶保护系统的变化规律,探讨了水杨酸与栝楼幼苗抵抗低温的关系,为栝楼耐低温的营养机理提供理论基础.
1 材料与方法
1.1 材料及处理
以耐寒性较强的三门峡栝楼和耐寒性较弱的安庆栝楼为实验材料.选取颗粒饱满、大小一致的三门峡栝楼和安庆栝楼的种子,破壳后播种于盛有沙土的盆中,待苗长至10 cm左右时选取长势一致的幼苗,移到完全营养液中进行培养,3 d换一次营养液,营养液参照文献[7]配制,待幼苗长至10~12片真叶时进行处理.
将实验材料进行分组,每组3次重复.对照(CK)组为 25℃正常生长植株;T0组,喷施0 mmol/L水杨酸溶液;T1组,喷施0.25 mmol/L水杨酸溶液;T2组,喷施0.5 mmol/L水杨酸溶液;T3组,喷施1 mmol/L水杨酸溶液;T4组,喷施2 mmol/L水杨酸溶液.各组在低温胁迫前24 h喷施水杨酸一次,24 h后再喷施一次,然后4℃低温处理,5 d后采样测定指标并进行数据分析.
1.2 生理指标测定
叶片相对含水量参考文献[8]的方法测定.细胞膜透性的测定参照文献[9]的方法.抗氧化物质的测定:游离脯氨酸采用茚三酮法[10];可溶性蛋白质含量利用考马斯亮蓝法[11];超氧化物岐化酶(SOD)活性、过氧化物酶(POD)活性的测定分别采用NBT光化还原法[12]和愈创木酚法[13];多酚氧化酶(PPO)、酯酶(EST)和细胞色素氧化酶(CYT)的活性测定分别参照文献[14]、[15]和[16]的方法.
利用模糊数学隶属函数法进行综合评估,具体公式为:

式(1)、式(2)表示i处理水平下j指标的抗胁迫隶属函数值,其中:xij表示i处理水平下j指标的测定值;xjmax和xjmin分别为该处理水平下所测指标的最大值和最小值.在计算各生理指标胁迫系数的隶属函数值时,如果耐胁迫系数与胁迫呈正相关,则用式(1)计算;如果耐胁迫系数与胁迫呈负相关,则用式(2)计算.式(3)表示在i水平下抗胁迫隶属函数的平均值.
1.3 数据处理
数据为3次独立试验所得.所有数据采用SPSS 18.0软件计算平均值和标准误,分析差异显著性;Origin 8.0软件制图.
2 结果与分析
2.1 外源水杨酸对低温胁迫下栝楼生理特性的影响
2.1.1 对叶片相对含水量的影响
叶片相对含水量表示植株在遭受逆境胁迫后植株叶片的含水量,可以直接反映出植株叶片细胞的水分生理状态[17].如图1所示:在低温胁迫下,T0组较对照组叶片含水量,三门峡栝楼下降25.7%,安庆栝楼下降31.8%,可见,低温逆境胁迫下三门峡栝楼叶片的保水能力大于安庆栝楼;喷施水杨酸后,2种栝楼叶片的相对含水量均有所升高.由此说明,喷施水杨酸可以减少低温胁迫对植株水分的亏损.安庆栝楼叶片相对含水量下降的程度高于三门峡栝楼,说明三门峡栝楼叶片能保持较高的含水量.因此,三门峡栝楼维持生命活动正常进行的能力大于安庆栝楼.
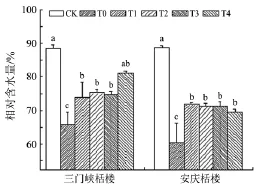
图1 外源水杨酸对低温胁迫下栝楼叶片相对水含量的影响
2.1.2 对细胞膜透性的影响
胁迫逆境下,植株细胞受到损伤的重要特征之一是细胞膜透性增加[18].从图2中看出:低温胁迫下,三门峡栝楼和安庆栝楼的细胞膜透性均增加,安庆栝楼各处理组的细胞膜透性均高于三门峡栝楼;2种栝楼的T0组均较对照组升高,三门峡栝楼升高44.3%,安庆栝楼升高44.1%;喷施水杨酸后,2种栝楼的细胞膜透性均下降,且T1和T2组下降幅度最大,但安庆栝楼T4组的细胞膜透性值高于其他各组.可见,2 mmol/L的水杨酸不能降低安庆栝楼的细胞膜透性,相反地增加了栝楼受伤害的程度.由此可见,喷施适宜浓度的水杨酸可以显著降低低温对栝楼细胞膜的伤害,从而发挥抗冷的作用.

图2 外源水杨酸对低温胁迫下栝楼细胞膜透性的影响
2.1.3 对游离脯氨酸含量的影响
低温胁迫下,细胞通过积累大量的相容性物质使细胞的渗透压升高,保水能力加强,冰点降低,从而增强植株的抗冷性[19].如图3所示:低温处理5 d后,2种栝楼不同处理组的脯氨酸含量均增加,三门峡栝楼和安庆栝楼的T0组较对照组分别增加58.5%和200.9%;喷施水杨酸后,叶片脯氨酸含量显著高于对照组,但低于T0组.由此可见,低温胁迫可以提高栝楼叶片脯氨酸含量,这可能是植物对低温条件的一种适应,喷施水杨酸则降低脯氨酸在植株体内的积累,减少低温胁迫的伤害作用.
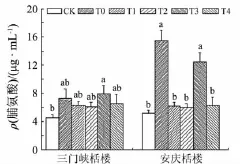
图3 外源水杨酸对低温胁迫下栝楼脯氨酸含量的影响
2.1.4 对可溶性蛋白质含量的影响
可溶性蛋白质含量参与维持植物细胞稳定的渗透势水平,可溶性蛋白质的含量越高,细胞的保水能力、保护细胞的结构稳定性和整体性的能力越强,同时还可以延缓细胞的衰老,最终起到抵御胁迫带来伤害的作用[17].近年来的研究表明,可溶性蛋白质含量的高低是植株抵抗逆境能力大小的一个重要因素.冯晓英等[20]的研究表明,植物处于逆境胁迫时,蛋白质的合成速率及其含量都会有所下降.
低温胁迫下,水杨酸处理对不同耐寒性栝楼叶片可溶性蛋白质含量的影响如图4所示.三门峡栝楼,T1组可溶性蛋白质含量较对照组增加,且有显著性差异;其他水杨酸处理组(T1~T4组)可溶性蛋白质含量均较T0组下降,但均高于对照组.安庆栝楼,T1组可溶性蛋白质含量较对照组增加,但无显著性差异;而其他水杨酸处理组可溶性蛋白质含量均低于T0组和对照组,T2~T4组与T0组有显著性差异.喷施水杨酸后,三门峡栝楼和安庆栝楼的可溶性蛋白含量的变化不一样,可能是由于品种的差异性导致植株对逆境的生理反应不同.
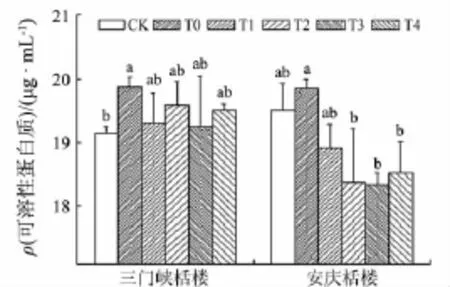
图4 外源水杨酸对低温胁迫下栝楼可溶性蛋白质含量的影响
2.2 外源水杨酸对低温胁迫下栝楼抗氧化酶活性的影响
2.2.1 SOD,POD和PPO的活性
三门峡栝楼和安庆栝楼POD活性变化趋势(见图6)一致.低温胁迫显著增加了2种栝楼的POD活性.由此说明,植物在受到低温逆境的胁迫时通过增加POD活性来提高抗寒性是一个重要的途径.而不同浓度水杨酸的加入降低了2种栝楼的POD活性.
PPO为多酚氧化酶,被认为是植物抵抗不良环境胁迫的物质之一,提高植株PPO的活性可以增强植株的抗逆性.如图7所示:低温胁迫5 d后,2种栝楼PPO活性均增加,且T0组较对照组分别增加了67.9%(三门峡栝楼)和43.4%(安庆栝楼);喷施水杨酸组,三门峡栝楼的PPO活性低于T0组但高于对照组,安庆栝楼的PPO活性除T1组外其余均高于对照组和T0组.安庆栝楼PPO活性整体上均低于三门峡栝楼各处理组.

图5 外源水杨酸对低温胁迫下栝楼SOD活性的影响

图6 外源水杨酸对低温胁迫下栝楼POD活性的影响

图7 外源水杨酸对低温胁迫下栝楼PPO活性的影响
2.2.2 CYT和EST的活性
细胞色素氧化酶(CYT)是细胞色素代谢途径中的关键酶,其活性的高低直接影响细胞色素途径所占的比例[21],影响植株的总呼吸强度,进一步影响植株生理代谢的强度和抵抗逆境的能力.如图8所示:低温胁迫下,水杨酸处理后,三门峡栝楼和安庆栝楼CYT活性均增加;三门峡栝楼T0组较对照组CYT活性升高39.4%且有显著性差异,喷施水杨酸组CYT活性较T0组略有下降但仍高于对照组,且T1~T3组与对照组和T0组均呈显著性差异;安庆栝楼T0组较对照组CYT活性升高39.85%,喷施水杨酸后CYT活性较T0组升高,其中T1组较对照组和T0组分别增加了119.5%和57.0%.
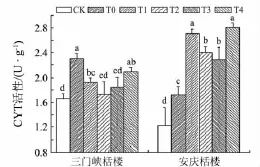
图8 外源水杨酸对低温胁迫下栝楼CYT活性的影响
从图9可以看出:T0组较对照组EST活性升高,安庆栝楼EST活性升高幅度高于三门峡栝楼;三门峡栝楼T1和T2组EST活性明显高于其他处理组,T3和T4组EST活性大小与对照和T0组相似,无显著性差异;安庆栝楼水杨酸处理后EST活性较对照组降低,无显著差异,但与T0组有显著性差异.

图9 外源水杨酸对低温胁迫下栝楼EST活性的影响
2.3 隶属函数均值耐寒性分析
采用模糊隶属函数方法对实验中所测的9个生理指标进行了计算分析,综合评价了不同浓度水杨酸处理缓解低温伤害的能力.如表1所示,不同浓度水杨酸对2个品种栝楼缓解低温胁迫的作用大小均为0.5 mmol/L>0.25 mmol/L>1 mmol/L>0 mmol/L>2 mmol/L.由此可知,0.5 mmol/L水杨酸处理对提高栝楼抗寒性的效果最好.
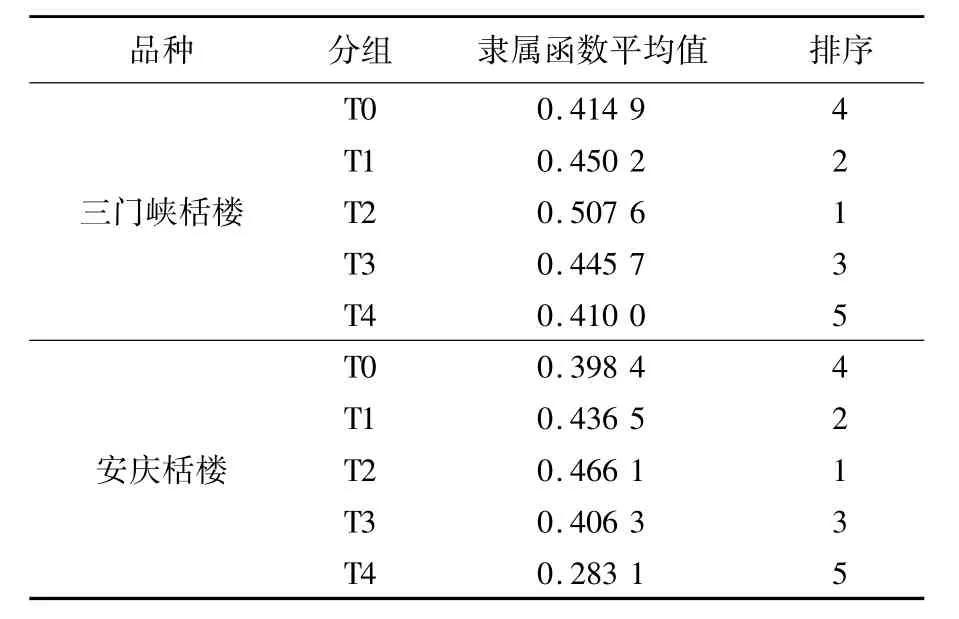
表1 2个品种栝楼耐寒隶属函数指标及评价
3 讨论
细胞膜是植物细胞与外界环境的屏障,细胞膜系统的稳定性与植物抵抗逆境密切相关.逆境条件下,细胞膜受到破坏,细胞膜蛋白结构发生变化,电解质向细胞外渗透,导致电导率增加.电导率可衡量细胞膜的损伤程度,电导率的值越大,细胞质膜透性越大,质膜受损伤程度就越严重[22].细胞膜透性增加是植株受到低温伤害的一个重要标志[23].本实验中,0.25~0.5 mmol/L水杨酸处理显著降低了低温胁迫下栝楼幼苗叶片的相对电导率和质膜透性.这可能是由于水杨酸通过诱导细胞质膜上的信号传递途径,传导低温逆境信号,使植物产生抗寒的能力.
植物对低温逆境的反应是一个非常复杂的生理过程.本研究结果表明,低温胁迫下,未喷施水杨酸组栝楼叶片的相对含水量下降,细胞膜透性、可溶性蛋白质含量、脯氨酸含量及各种保护酶活性升高,而喷施不同浓度的水杨酸后,各生理指标的变化不同.许多研究表明,渗透调节作用的变化是植物对逆境响应的重要生理机制[24].当植物受到逆境胁迫后,植物细胞通过增加细胞内的渗透调节物质来增加细胞内的溶质浓度,从而降低渗透势,使细胞保持稳定的结构,维持植株的正常生命活动,脯氨酸是有效的渗透调节物质.也有报道表明,可溶性蛋白质的含量与植物抵抗逆境的作用大小呈正相关[25].安庆栝楼水杨酸处理后可溶性蛋白质含量低于对照组和T0组.因此笔者认为,水杨酸通过诱导脯氨酸和可溶性蛋白质含量的变化趋势可能不同,但最终都是为了提高栝楼的抗寒性.
近年来,“自由基伤害学说”在植物抗逆境机理的研究中一直相当活跃.植物在正常生长情况下产生的羟自由基(·OH)、超氧自由基()和过氧化氢(H2O2)等活性氧物质能够很快地被植物体内的SOD和POD等保护酶清除.SOD将歧化为H2O2,而POD又可以清除·OH和H2O2等物质,使活性氧类物质的产生与清除处于动态平衡,不会对植物产生“毒害”作用[26-27].PPO广泛存在于植株的各个组织、器官中,存在于植物体内各种应激反应酶系,参与植株的抗逆性生理调节[28].本实验结果表明:在低温胁迫下,栝楼的SOD,POD,PPO,EST和CYT的活性均上升,说明低温胁迫对栝楼的生理产生一定的作用;而喷施水杨酸后,SOD,POD和PPO等酶的活性低于未喷施水杨酸组(T0组),可能是水杨酸诱发植株产生一系列的生理反应,减轻了栝楼受低温的伤害.
总之,笔者认为,低温胁迫使栝楼细胞膜脂化程度加剧,增强了栝楼酶类和非酶类物质的生理代谢;而喷施适宜浓度的水杨酸,增强了栝楼的自我保护能力,表现为植株伤害得到缓解.此外,本研究还表明,低温胁迫下2种栝楼的膜脂过氧化水平和体内保护系统对低温胁迫的反应存在一定的基因型差异,安庆栝楼总体上膜脂过氧化程度较高,体内活性氧清除系统总体能力低于三门峡栝楼,表明三门峡栝楼在抵抗低温胁迫方面具有优越性.通过隶属函数平均值可知,在本实验喷施0.5 mmol/L水杨酸可明显增强栝楼对低温胁迫的抵抗能力.
[1]黄璐琦,乐崇熙,杨滨,等.栝楼属的系统学研究[J].江西中医学院学报,1999,11(2):75-78.
[2]宁志怨,董玲,陈静娴,等.栝楼种质资源亲缘关系的RAPD分析[J].安徽农业大学学报,2007,34(4):560-563.
[3]杨丽娜,刘捷,陶建敏,等.栝楼的组织培养及快速繁殖[J].江苏农业科学,2008(2):89-94.
[4]周媛,章艺,吴玉环,等.酸铝胁迫对栝楼根系生长及铝积累的影响[J].农业环境科学学报,2012,30(12):2434-2439.
[5]高培培,章艺,吴玉环,等.外源水杨酸对铝胁迫下栝楼光合特性及耐铝性的影响[J].水土保持学报,2012,26(6):268-273.
[6]康国章,孙谷畴,王正询.水杨酸在植物抗环境胁迫中的作用[J].广西植物,2004,24(2):178-183.
[7]Yoshida S.Fundamentals of rice crop science[M].Manila:International Rice Research Institute,1981.
[8]张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[9]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[10]张宪政.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1989.
[11]张治安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.
[12]白宝璋,汤学军.植物生理学测试技术[M].北京:中国科学技术出版社,1993:73-157.
[13]中国科学院上海植物生理研究所,上海植物生理学会.现代植物生理学实验指南[M].北京:科学技术出版社,1999.
[14]高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[15]赵普庆.油菜素内酯对黄瓜种子抗逆萌发的影响及其机理[D].杭州:浙江大学农业与生物技术学院,2005.
[16]奥列霍维奇B H.现代生物化学方法[M].北京:人民出版社,1980.
[17]赵雅静,翁伯琦,王义祥,等.植物对干旱胁迫的生理生态响应及其研究进展[J].福建稻麦科技,2009,27(2):45-50.
[18]龚明.低温下稻苗叶片中蛋白质及有利氨基酸的变化[J].植物生理学通讯,1989(4):18-22.
[19]薛国希.低温下壳聚糖对黄瓜幼苗生理生化特性的影响[D].泰安:山东农业大学生命科学学院,2004.
[20]冯晓英,胡章平,乙引.Ca2+胁迫下伞花木和华山松脯氨酸及可溶性蛋白质含量的变化[J].贵州农业科学,2010,38(9):169-170.
[21]史青纯.外源水杨酸处理对采后皇冠梨果实呼吸途径的影响[D].保定:河北农业大学园艺学院,2009.
[22]卢少云,黎用朝,郭震飞,等.钙提高水稻幼苗抗旱性的研究[J].中国水稻科学,1999,13(3):161-164.
[23]Corbineau F,Gay-Mathieu C,Vinel D.Decrease in sunflower seed viability caused by high temperatures as related to energy metabolism,membrane damage and lipid composition[J].Physiol Plant,2002,116(4):489-496.
[24]Morgan J M.Osmoregulation and water stress in high plant[J].Ann Rev Plant Physio,1984,35:299-319.
[25]李美如,刘鸿先,王以柔.植物细胞中的抗寒物质及其与植物抗冷性的关系[J].植物生理学通讯,1995,31(5):324-328.
[26]石贵玉.铝对水稻幼苗生长和生理的影响[J].广西植物,2004,24(1):77-80.
[27]梁立峰,王泽槐,周碧燕,等.低温及多效唑对香蕉叶片过氧化物酶及其同工酶的影响[J].华南农业大学学报,1994,15(3):65-70.
[28]彭淼,钟晓红,张玲,等.钙对干旱胁迫下草莓SOD、CAT、PPO活性的影响[J].长江大学学报:自然科学版,2009,6(1):11-14.
(责任编辑 薛 荣)
Effect of salicylic acid on cold tolerance of Trichosanthes kirilowii Maxim seedling under low temperature stress
LIU Peng, CAO Lin, WANG Lihua, LIU Dan, XU Gendi, MA Li, LI Feng
(Institute of Ecology,Zhejiang Normal University,Jinhua Zhejiang 321004,China)
Two kinds of Trichosanthes kirilowii Maxim,one was sanmenxia Trichosanthes kirilowii with strong cold resistance and the other one was Anqing Trichosanthes kirilowii with weak cold resistance,were taken as the experiment materials,to analyze the effect of physical growth characteristics and autioxidant enzyme activities in spraying salicylic acid with different concentrations(0,0.25,0.5,1,2 mmol/L)for Trichosanthes kirilowii seedling leaves under the low temperature(4℃)stress.The experimental results showed that for Trichosanthes kirilowii seedling treatment under low temperature,the cell membrane permeability and free proline(Pro)and soluble protein contents of two kinds of Trichosanthes kirilowii increase(P<0.05),while the relative water content(RWC)appeared the opposite tendency,and the plant superoxide dismutase(SOD),peroxidase(POD),polyphenol oxidase(PPO),esterase(EST)and cytochrome oxidase(CYT)increased,showing the cold resistance difference between two kinds of Trichosanthes kirilowii,Spaying SA in appropriatelow concentration significantly reduced the relative conductivity,plasma membrane permeability and Pro and soluble protein contents,but spaying SA in high concentration did not affect reducing the contents of SOD,POD,PPO,EST and CYT of plants.The SA in appropriate concentration had the effect of alleviating the Trichosanthes kirilowii under the low temperature stress,but did not eliminate the inhibition of cold stress on Trichosanthes kirilowii growth.The optimal concentration of exogenous salicylic acid to alleviate Trichosanthes kirilowii was 0.5 mmol/L.
salicylic acid(SA);Trichosanthes kirilowii Maxim;low temperature stress;cold tolerance
S567.9;Q945.78
A
1001-5051(2015)01-0009-06
�:2014-11-03;
2014-11-13
浙江省公益技术研究农业项目(2011C22053)
刘 鹏(1965-),男,湖南冷水江人,教授,博士.研究方向:植物生理生态;植物逆境生理;环境污染与保护.
10.16218/j.issn.1001-5051.2015.01.002
