胰腺癌三维适形放射治疗与γ射线体部立体定向放射治疗加量疗效分析
2015-12-05侯艳丽马秀梅曹鸿斌白永瑞
胡 斌 侯艳丽 马秀梅 曹鸿斌 叶 明 白永瑞*
胰腺癌三维适形放射治疗与γ射线体部立体定向放射治疗加量疗效分析
胡 斌①侯艳丽①马秀梅①曹鸿斌①叶 明①白永瑞①*
目的:回顾性分析61例胰腺癌患者行常规三维适形放射治疗、随后缩野行放射治疗加量或γ射线体部立体定向放射治疗加量的疗效差异。方法:将61例胰腺癌患者按治疗方法分为三维适形放疗加量治疗组21例(三维-CRT组)和γ射线体部立体定向放疗加量治疗(SBRT加量组)40例。对61例胰腺癌患者先行常规三维适形放疗(胰腺病灶+腹膜后淋巴结引流区域,TD40 Gy/20 Fx)后重新扫描;其中三维-CRT组针对胰腺病灶及腹膜后肿大淋巴结放射治疗加量至TD46~50 Gy;SBRT加量组使用γ射线体部立体定向放射治疗加量治疗追加14~16 Gy,共7~8次。结果:两组总中位生存时间为11.3个月,1年总生存率为44.95%。单因素分析显示,卡氏评分(KPS)≥90分、接受过化疗及女性患者疗效更佳,其中位生存时间差异有统计学意义(x2=8.992,x2=4.056,x2=3.953;P<0.05)。三维-CRT组与SBRT加量组的中位生存时间分别为7.5个月和13.0个月,两组治疗相关急性和后期副反应无差异。结论:适形放射治疗加γ射线立体定向放射治疗加量对于局部晚期胰腺癌患者而言耐受性好,有提高患者生存期的趋势。放射治疗前KPS评分高、放射治疗联合化疗以及女性患者可能获得更好的疗效。
胰腺癌;三维适形放疗;γ射线体部立体定向放疗
[First-author’s address] Department of Radiation Oncology, Ren Ji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China.
胰腺癌是目前恶性程度最高的肿瘤之一。近年来统计表明,胰腺癌在我国恶性肿瘤发病率中排列为第7位,病死率在第6位,且逐年升高[1-2]。目前,约占85%的胰腺癌患者确诊时已处于晚期而无手术机会;根治性手术切除患者有15%~20%可获长期生存[3]。对于确诊时因局部进展、浸润而无法切除的局部进展期胰腺癌(locally advanced pancreatic cancer,LAPC)患者而言,主要治疗模式为全身化疗或联合放射治疗[4]。本研究回顾性分析LAPC患者接受三维适形放射治疗(three dimensional conformal radiation therapy,CRT)的基础上追加与不追加γ射线体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)的治疗效果。
1 资料与方法
1.1 一般资料
选取2005年9月至2012年5月在上海交通大学医学院附属仁济医院就诊的LAPC患者61例,其中男性35例,女性26例;年龄37~83岁,中位年龄为66岁。将全组患者按治疗方法分为三维-CRT组(21例)和SBRT加量组(40例)。三维-CRT组使用常规三维适形放疗加量至TD 46~50 Gy;SBRT加量组使用γ射线体部立体定向放疗加量治疗,PTV=GTV+5 mm,以50%等剂量曲线为PTV处方剂量,每次2 Gy,计划追加16 Gy,总剂量至56 Gy。
治疗前卡氏性能量表(Karnofsky performance scale,KPS)评分为60~90分,中位值90分。肿瘤位于胰头部38例,胰腺体尾部23例。按照美国抗癌协会(american joint committee on cancer,AJCC)胰腺癌肿瘤、淋巴结及远处转移(tumor node metastasis,TNM)分期标准,ⅡA期(T3N0)6例,ⅡB期(T1-3N1)4例,Ⅲ期(T4N0-1)51例。全组患者中1例行胰腺肿块穿刺明确病理(低分化腺癌);18例行手术探查无法切除行短路或开关术,其中4例术中活检,2例证实低分化腺癌。未行手术探查的患者经外科会诊,认为不能手术切除。全组患者中51例血清糖类抗原CA19-9升高(45.32~4968.8 U/ml),6例CA19-9正常,4例CA19-9资料缺失。全组患者中10例行PET/ CT检查辅助诊断。
两组患者性别、年龄、KPS评分、临床分期等统计学无显著差异,具有可比性。
1.2 入选标准
采用第6版AJCC肿瘤TNM分期标准:①病理证实的、手术无法切除的或拒绝手术治疗的胰腺癌(T1-4、N0-1);②CT/MRI或PET/CT证实胰腺肿块,结合临床表现及实验室指标CA19-9升高、临床诊断为局部进展期胰腺癌患者;③KPS评分≥60分。
1.3 治疗设备和治疗方法
应用瑞典医科达公司Precise直线加速器进行三维适形放疗,深圳奥沃公司体部γ刀进行γ射线立体定向放疗加量[5]。定位时均口服浓度为3%泛影葡胺约500~1000 ml,并静脉推注碘造影剂。常规三维适形放疗采用负压真空模型垫固定体位,γ射线体部立体定向放射治疗加量时采用专用定位刻度床,采用GE Hispeed双排螺旋CT扫描,层距和层厚5 mm。肿瘤靶区(gross tumor volume,GTV)为CT、MRI或PET/ CT所示肿瘤范围,包括胰腺病灶+后腹膜淋巴结转移病灶。临床靶区(clinical target volume,CTV)为胰腺周围上至肝门下到十二指肠水平部腹主动脉周围区域淋巴引流区。所有患者先接受常规三维适形放射治疗,照射范围PTV=CTV+10 mm,每次2 Gy,1次/d,每周5次,TD40 Gy/20 Fx。随后重新扫描定位,针对胰腺病灶及腹膜后肿大淋巴结放射治疗加量。61例患者中,有36例患者在放射治疗前后接受过全身或介入化疗,药物包括吉西他滨(GEM)和5-Fu类药物(5-Fu、FUDR、卡培他滨、替吉奥),其中1例为28个疗程,其余35例为1~11个疗程。中位疗程为3个疗程,两组患者接受化疗情况无统计学差异。
1.4 疗效和不良反应评定标准
疗效观察指标包括患者的临床症状、放射治疗反应及生存时间等。胰腺癌患者临床症状主要表现上腹部疼痛,疼痛量化评估按数字分级法(NRS),0为无痛,1~3为轻度疼痛,4~6为中度疼痛,7~10为重度疼痛。疼痛程度减轻为部分缓解,从有疼痛至无痛者为完全缓解。以美国国家癌症研究所(National cancer institute,NCI)的常见治疗不良反应评价标准(common terminology criteria for adverse events v3.0. CTCAE v3.0)和美国肿瘤放射治疗协作组织(radiation therapy oncology group,RTOG)标准[6]评定治疗不良反应分级。
1.5 随访和统计学方法
患者放疗后1、3、6、12、18及24个月门诊随访,对于未能门诊随访者,采用电话随访或信访方式。数据分析采用SPSS 19.0软件,Kaplan-Meier法计算患者生存,Logrank法检验各因素分组间生存差异性比较,以P<0.05为差异有统计学意义。COX回归分析进行单因素、多因素分析、卡方检验分析组间差异。生存时间为患者放射治疗开始至死亡或末次随访的时间。
2 结果
2.1 照射剂量
三维-CRT组照射剂量为18~50 Gy,中位照射剂量46 Gy;SBRT加量组适形放射治疗照射剂量为10~50 Gy,中位照射剂量40 Gy,γ射线立体定向放射治疗追加中位剂量为16 Gy(追加剂量10~30 Gy),总剂量为40~65 Gy,中位56 Gy。
2.2 治疗效果
两组61例患者中,有46例患者伴有轻-重度疼痛,经治疗后13例(占28.3%)患者完全缓解,31例(占67.4%)部分缓解,2例(占4.3%)无效。两组患者随访时间为1~85.3个月,中位随访时间为11.0个月。全组生存时间1~85.3个月,中位生存时间11.3个月;两组1年生存率为44.95%。生存曲线如图1所示。
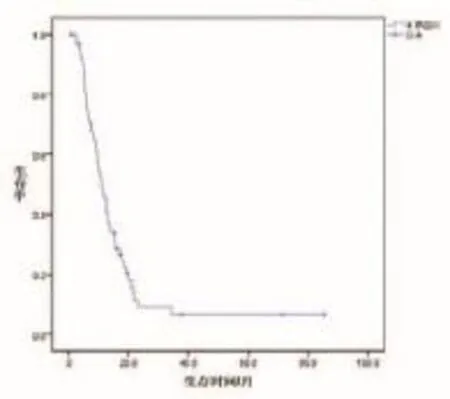
图1 全组患者总生存曲线图
三维-CRT组与SBRT加量组中位生存时间分别为7.5个月(3.5~71.4个月),13.0个月(2.7~85.3个月),1年生存率分别为21.4%,56.6%,两组相比无差异;两组生存曲线如图2所示。

图2 三维-CRT组与SBRT加量组生存曲线图
单因素分析显示生存时间可能与放射治疗前KPS评分、是否接受了化疗及性别有关,其差异有统计学意义(x2=8.992,x2=4.056,x2=3.953;P<0.05) (见表1)。
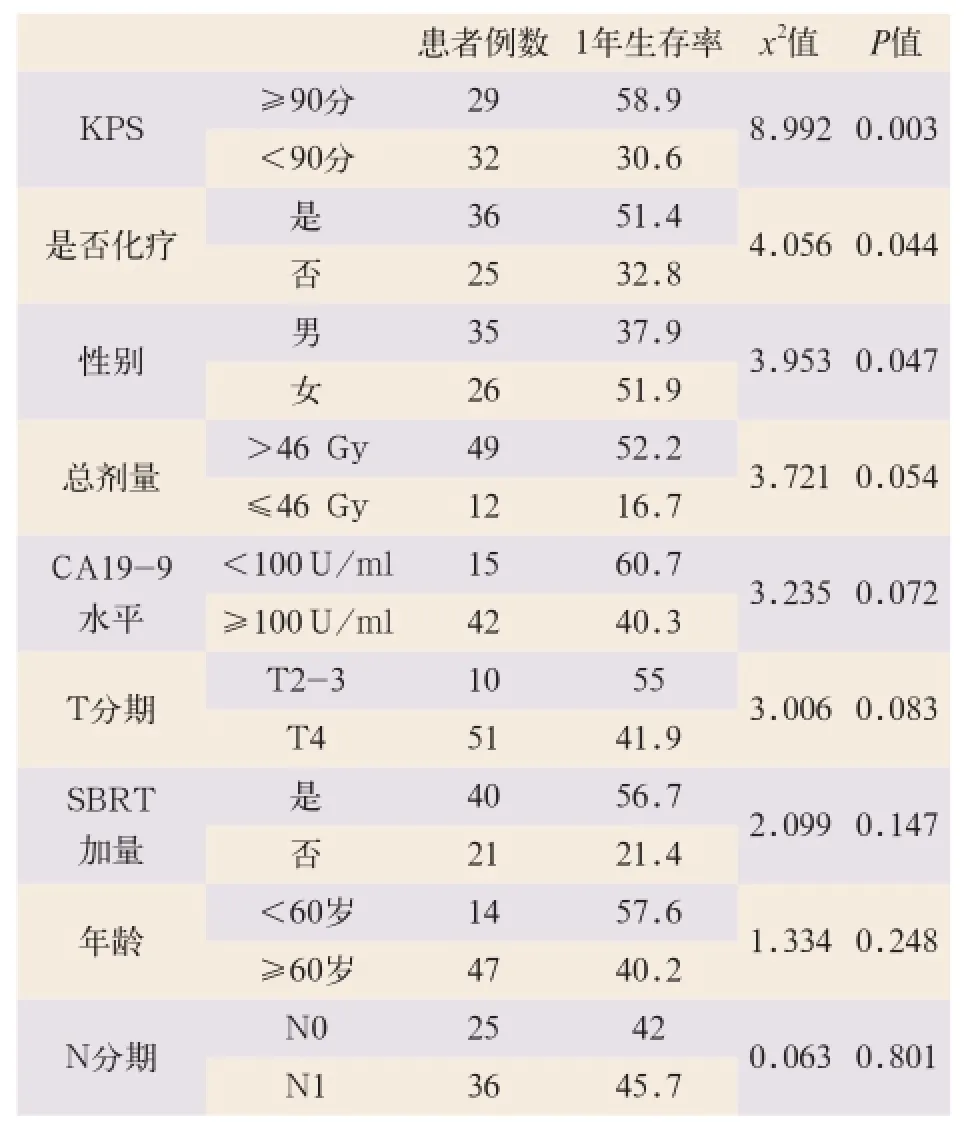
表1 生存时间单因素分析结果(%)
多因素分析显示放射治疗后生存时间与放射治疗前KPS有关。KPS≥90分患者预后较好(P=0.004)。生存曲线如图3、图4和图5所示。

图3 治疗前KPS评分对生存率的影响曲线图

图4 化疗对生存率的影响曲线图

图5 性别对生存率的影响曲线图
随访中,出现远处转移的患者中三维-CRT组7例,SBRT加量组23例,其中肝转移19例(同时合并肺转移2例,合并腹水1例),腹水及腹膜转移6例,肺转移3例,骨转移1例,盆腔转移1例。局部复发的患者中三维-CRT组3例,SBRT加量组4例。末次随访死亡患者中三维-CRT组19例,SBRT加量组33例。生存患者中三维-CRT组2例,SBRT加量组7例。死亡原因中局部复发三维-CRT组3例,SBRT加量组1例;远处转移、腹水9例;全身衰竭25例;上消化道出血6例,余8例不详。
2.3 不良反应
两组患者共3例(占4.9%)出现CTCAE标准Ⅲ级急性放射治疗反应,其中1例患者在放射治疗过程中恶心、呕吐症状明显,伴血淀粉酶升高,无法耐受而终止放射治疗(26 Gy);1例在放射治疗18 Gy/9 Fx时出现黄疽加重伴高热,中止放射治疗转外科行胆道支架置入术。1例伴梗阻性黄疸,放射治疗10 Gy/5 Fx后行ERCP胆管支架置入,随后改SBRT放射治疗加量总剂量(total dose,TD)30 Gy/10 Fx。其余放射治疗相关副反应Ⅰ~Ⅱ级,在积极处理后完成放射治疗计划。
3 讨论
胰腺癌预后差,对于无法手术切除的局部晚期胰腺癌患者,仅行姑息性胃或胆汁分流中位生存期仅3~6个月[7]。放射治疗和化疗可以使LAPC患者的中位生存时间增加到9~13个月[8]。
胰腺癌放射治疗不敏感,使用传统放射治疗技术,因周围正常组织耐受剂量限制,无法给予胰腺肿瘤高剂量的放射治疗,故疗效较差。近年来,放射治疗技术发展迅速,SBRT、射波刀(Cyber Knife)、三维适形放疗以及γ射线立体定向放射治疗均可在保护正常组织的同时给予靶区高剂量照射,胰腺癌治疗疗效有所提高,明显优于传统放疗。于金明等[10]报道,对不能手术的胰头癌患者13例采用X射线立体定向放射治疗,仅照射胰腺病灶区分割剂量为5~7 Gy,隔日1次,5~8次不等,70%~90%剂量曲线包绕靶区,TD 40~48 Gy,1年、2年生存率分别为92.3%和70.0%。夏廷毅等[11]报道,采用γ射线立体定向放疗治疗52例中、晚期II~IV期胰腺癌患者,仅照射胰腺病灶,胰头癌3~4 Gy/Fx,胰体尾癌4~5 Gy/Fx,5次/周,肿瘤边缘总剂量40~51 Gy,肿瘤中心区域80~102 Gy,1年、2年生存率分别为56.5%和23.1%。根据生物有效剂量(biologically effective dose,BED)推算(公式1):
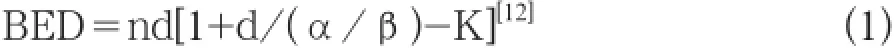
放射治疗等效剂量(公式2):

上述报道中靶区剂量相对传统放射治疗有明显提高,表明在周围正常组织耐受的情况下,胰腺癌局部放射治疗剂量的提高能带来良好的疗效。
对LAPC采用IMRT或三维-CRT放射治疗,是否行预防性淋巴结引流区照射尚无共识,Florence等[14]建议行胰腺肿块局部放射治疗,1.8 Gy或2 Gy/ Fx,建议TD为50~54 Gy;如行预防性淋巴结引流区照射则建议TD<50.4 Gy。预防性淋巴结引流区域照射将提高放射治疗的毒副作用,是否能提高疗效尚有待进一步前瞻性研究。Kim等[15]对LAPC进行前瞻性研究,对一组19例患者仅给予射波刀治疗,剂量为33~39 Gy/3 Fx;对另一组21例患者则在外照射之后(40 Gy/20 Fx)用射波刀进行局部加量13~19 Gy/单次。结果显示,两组中位生存期和1年总生存率分别为10个月和21.1%;13个月和57.9%。虽然差异无统计学意义,但后组拟具有更好的预后趋势。
本研究回顾性分析病例中,SBRT加量组在常规适形放射治疗剂量40 Gy的基础上,针对重新定位后的GTV追加剂量,以50%等剂量曲线为PTV处方剂量,2 Gy/Fx,追加16 Gy/8次,肿瘤边缘剂量TD 56 Gy,肿瘤中心区域EQD2=77.3 Gy。结果显示,中位生存期SBRT加量组明显高于三维-CRT组,分别为13.0个月和7.5个月;1年生存率分别为56.7%和21.4%,虽然有提高生存率的趋势,但由于病例数较少,统计学上未显示出差异。除3例患者在放射治疗的早期无法耐受治疗外,两组其余病例并未观察到严重的早期和后期治疗相关副反应。分析患者死因,有随访记录的53例患者,仅4例死于局部复发,其中SBRT加量组1例,三维CRT组3例,表明局部剂量的提高能带来更好的局部控制率。
放射治疗联合化疗对提高患者生存是否获益,文献中存在不同结果。FFCD/SFRO研究[16]中三维适形放射治疗TD 60 Gy同步化疗(DDP+5-Fu),随后再用GEM化疗,中位生存期8.6月,1年生存率32%。而单用GEM患者为13个月,1年生存率53%。进一步分析发现60 Gy的剂量导致放射并发症较多,增加了死亡,降低了生存期。ECOG 4201试验中单用GEM与GEM+放射治疗比较,放射治疗TD 50.4 Gy,结果显示放、化疗的中位生存期长于单用化疗,分别为11.1个月和9.2个月;1年生存率提高,分别为50%和32%[17]。Huguet回顾性研究中,181例患者先行4周期化疗,化疗后53例疾病进展,随后未进展的128例分成放、化疗同步(72例)和化疗(56例)2组。最终结果放、化疗同步和化疗组的无进展生存期(progressionfree survivall,PFS)分别是10.8个月和7.4个月;总生存期(overall survival,OS)分别为15.0个月和11.7个月,放、化疗同步的PFS及OS均明显提高[18]。研究提示,放射治疗加入化疗对部分患者能明显改善其生存。王黎等[19]对国内外18个随机对照试验进行总生存率的Meta分析,认为相对于单用放射治疗或化疗治疗不能切除的胰腺癌,联合放、化疗可以明显的提高总生存率,且安全性较好。本研究回顾性分析病例中有36例患者接受了全身化疗,单因素分析结果显示是否行化疗的1年生存率分别为51.4%和32.8%,具有统计学意义。
目前,胰腺癌独立预后相关因素报道较多的是KPS评分[20-21]。KPS评分高者能耐受较高强度治疗,预后较好。本研究患者中KPS≥90分患者生存期明显延长,与其报道一致。性别差异对胰腺癌预后的影响目前鲜有报道,本研究中男女性患者在KPS评分、年龄、是否接受化疗、肿瘤部位及分期等无显著性差异,何种原因导致生存差异则有待进一步研究。对于局部晚期胰腺癌患者适形放射治疗加γ射线SBRT加量耐受性好,具有提高生存期的趋势,有待进一步扩大样本进行研究。放射治疗前KPS评分高、放射治疗联合化疗及女性患者有可能获得更好的疗效。
[1]陈万青,王庆生,张思维,等.2003-2007年中国胰腺癌发病与死亡分析[J].中国肿瘤,2012,21(4):248-253.
[2]马臣,姜永晓,刘曙正,等.中国胰腺癌发病趋势分析和预测[J].中华流行病杂志,2013,34(2):160-163.
[3]Loos M,Kleeff J,Friess H,et al.Surgical treatment of pancreatic cancer[J].Ann N Y Acad Sci,2008,1138(1):169-180.
[4]张俊,陆嘉德,彭承宏,等.胰腺癌辅助治疗的争议与共讯[J].中国癌症杂志,2009,19(8):580-584.
[5]夏廷毅.头、体γ刀的临床应用[M]//申文江,王绿化,夏廷毅.放射治疗学新技术进展.北京:北京科学技术出版社,2003:70-73.
[6]Cox JD,Stets J,Pajak TF.Toxicity criteria of the Radiation Therapy Oncology Group(RTOG) and the European Organization for Research and Treatment of Cancer(EORTC)[J].Int J Radiat Oncol Biol Phys,1995,31(5):1341-1346.
[7]Gunderson LL,Haddock MG,Bruch P,et al.Future role of radiotherapy as a component of treatment in biliopancreatic cancer[J].Ann oncol,1999,10(4):291-295.
[8]Edward CH.放射肿瘤学原理和实践[M].5版.朱广迎,译.天津:天津科技翻译出版公司,2012:1472-1485.
[9]刘朝兴,高献书.中国胰腺癌的放射治疗现况[J].医学综述,2010,16(4):537-539.
[10]于金明,于甬华,尹勇,等.X射线立体定向放射治疗胰头癌13例分析[J].中华放射肿瘤学杂志,200l,10(2):125.
[11]夏廷毅,孙庆选,于湧,等.体部γ-刀治疗52例胰腺癌的疗效分析[J].中华肝胆外科杂志,2006,12(2):86-88.
[12]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:275-280.
[13]周志孝,王中和.等效剂量EQD2的计算和临床应用[J].中华综合临床医学杂志,2007,9(5):86-88.
[14]Florence H,Karyn AG,David A,et al. Radiotherapy technical considerations in the management of locally advanced pancreatic cancer:American-French consensus Recommendations[J].Int J Radiat Oncol Bio Phys,2012,83(5):1355-1364.
[15]Kim M,Yoo S,Cho C,et al.Comparison of the efficacy of conventional radiotherapy followed by CyberKnife boost with CyberKnife alone in patients with locally advanced pancreatic cancer[J].Int J Radiat Oncol Bio Phys,2006,66(3):300.
[16]Barhoumi M,Mornex F,Bonnetain F,et al.Locally advanced unresectable pancreatic cancer:induction chemoradiotherapy followed by maintenance gemcitabine versus gemcitabine a-lone,definitive results of the 2000-2001 FFCD/SFRO phase Ⅲ trial[J].Cancer Radiother,2011,15(3):182-191.
[17]Loehrer S,Feng Y,Cardenes H,et al. Gemcitabine along versus Gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer:An Eastern Cooperative Oncology Group Trial[J].J Clin Oncol,2011,29(31):4105-4112.
[18]Huguet F,André T,Hammel P,et al.Impact of chemoradio therapy after disease control with chemotherapy in locally advanced pancreatic adenocarcinoma in GERCOR phase Ⅱ and Ⅲstudies[J].J Clin Oncol,2007,25(3):326-331.
[19]王黎,李丹明.放化疗治疗中晚期胰腺癌疗效的Meta分析[J].南京医科大学学报(自然科学版),2012,32(1):129-135.
[20]Ikeda M,Okada S,Tokuuye K,et al.Prognostic factors in patients with locally advanced pancreatic carcinoma receiving chemoradiotherapy[J].Cancer,2001,91(4):490-495.
[21]Morganti AG,Forni F,Macchia G,et al. Chemoradiation of unresectable pancreatic carcinoma:impact of pretreatment hemoglobin level on patterns of failure[J].Strahlenther Onkol,2003,179(2):87-92.
Effect of three-dimensional conformal radiotherapy versus dose boosted with gamma ray stereotactic body radiotherapy on locally advanced pancreatic cancer
HU bin, HOU Yan-li, MA Xiu-mei, et al// China Medical Equipment,2015,12(1):87-91.
Objective: To analyze retrospectively the different efficacy between linear accelerator X-ray with three-dimensional conformal radiotherapy(3D-CRT) and dose boosted with gamma ray stereotactic body radiotherapy(SBRT) for locally advanced pancreatic cancer patients. Methods: A total of 61 patients with locally advanced pancreatic cancer were enrolled. All the patients were first performed by 3D-CRT, the volumes of irradiation included the pancreatic tumor (GTV) and the draining lymph node region, total scheduled dose was 40Gy in 20 fractions. Then boosted the dose to GTV, 21 cases with 3D-CRT(3D-CRT group), total dose of 46Gy;40 cases with SBRT(SBRT group), total dose of 56Gy. Results: The median survival time was 11.3 months for all cases. Patients with pretreatment KPS ≥90, combined with chemotherapy and femal had better prognosis. The corresponding MSTs were 14.1 months vs 9.2 months(x2=8.992, P=0.003),13.0 months vs 9.6 months(x2=4.056, P=0.044) and 12.5 months vs 10.7 months(x2=3.953, P=0.047) respectively. The median survival time of 3D-CRT group and SBRT group were 7.5 months and 13 months, P<0.05. There were no statistic differences between 2 groups in terms of side effects induced by treatments. Conclusion: The gamma ray stereotactic body radiotherapy is effective and safe and has the trend to improve the survival rate for patients with locally advanced pancreatic cancer. Patients with better performance status before treatment, combined with chemotherapy and female may have better prognosis.
Pancreatic cancer; 3D-conformal radiotherapy; Gamma ray stereotactic body radiotherapy
胡斌,男,(1981- ),硕士,住院医师。上海交通大学医学院附属仁济医院放射诊疗科,从事肝、胆、胰腺肿瘤放射治疗及相关研究工作。
1672-8270(2015)01-0087-05
R815
A
10.3969/J.ISSN.1672-8270.2015.01.028
2014-01-23
①上海交通大学医学院附属仁济医院放射诊疗科 上海 200127
*通讯作者:baiyongrui@renji.com
