PIAS3过表达对肺腺癌细胞A549增殖的影响及意义*
2015-12-05俞庆华李峰生黄乃祥
俞庆华 李峰生 黄乃祥 高 玲
PIAS3过表达对肺腺癌细胞A549增殖的影响及意义*
俞庆华①李峰生②*黄乃祥①高 玲③*
目的:探索活化型信号转导子和转录激活子3蛋白抑制剂(PIAS3)对肺腺癌A549细胞增殖的影响及相关意义,为进一步研究利用辐射应答基因启动子驱动的PIAS3腺相关病毒载体联合放射治疗肺腺癌提供基础。方法:利用MTT比色试验和克隆形成率实验检测转染pCMV-Sport6-PIAS3后对肺腺癌细胞A549存活和增殖的影响;利用免疫荧光染色实验检测共转染pCMVSport6-PIAS3、PRC-CMV、PRC-STAT3及PRC-STAT3-CT后对p-STAT3入核的影响。结果:PIAS3过表达导致A549细胞生长显著抑制,克隆形成能力显著降低;免疫荧光染色实验结果表明,转染pCMV-Sport6-PIAS3后,STAT3入核被显著抑制,通过共转染表达STAT3和STAT3-CT后,STAT3入核仍显著受到抑制。结论:PIAS3过表达可抑制STAT3的入核,继而阻断其功能,从而降低肺腺癌细胞A549的生长和增殖能力。
活化型STAT3抑制蛋白;肺腺癌;细胞存活;细胞增殖;磷酸化信号转导子和转录激活子3
[First-author’s address] Department of Thoracic Surgery, 307 Hospital of PLA, Beijing 100071, China.
目前,临床肺癌患者确诊时约85%已到中、晚期,约75%的患者无法进行手术治疗,常规放射治疗和化疗的临床效果不能达到预期效果。分子靶向药物治疗是近年兴起的一种有效的治疗手段,因其能高度选择性地杀死肿瘤细胞而不杀伤正常细胞,且毒性反应相对较小而得到患者的广泛认可。肺腺癌靶向治疗使用最多的是针对表皮生长因子(epidermal growth factor receptor,EGFR)基因突变患者治疗的易瑞沙(吉非替尼)、特罗凯(厄洛替尼)和凯美纳3种药物,与西方百分之十几的突变率相比我国为50%的肺腺癌患者存在EGFR突变[1-4]。约50%EGFR突变阴性的患者不能接受靶向治疗,成为靶向治疗局限性的因素。因此,探索EGFR之外的其他肿瘤信号通路(如NFkB/ STAT3等)中的靶分子,对EGFR未突变以及对其产生了耐药性的肺腺癌患者具有重要意义。
活化的信号转导子和转录激活子3(signal transducer and activator of transcription,STAT3)蛋白抑制剂(protein inhibitor of activated STAT3,PIAS3)是STAT3的特异蛋白抑制剂,有PIAS3α和PIAS3β两个亚型。由于STAT3基因在包括肺腺癌在内的多种肿瘤中持续激活,导致肿瘤细胞异常增殖,侵袭和迁移增加。因此,本研究探索PIAS3过表达对肺腺癌A549细胞的影响,探索PIAS3作为肺腺癌治疗靶点的可行性。
1 材料与方法
1.1 试剂
特级胎牛血清和DMEM培养基购自美国Gibco公司;四甲基偶氮唑(methyl thiazolyl tetrazolium,MTT)比色试剂购自美国Sigma公司;苔酚蓝染液购自北京鼎国昌盛生物技术有限责任公司;脂质体Lipofectamine 2000和转染液opti-MEM均购自美国Invitrogen公司;p-STAT3单克隆抗体购自美国CST公司,FITC二抗购自中杉金桥公司;D-Hank's缓冲液、姬姆萨染色液及磷酸缓冲盐溶液(phosphate buffer saline,PBS)均为本实验室配制。
1.2 细胞培养及质粒
人肺腺癌A549细胞购自北京协和医学院细胞库。细胞株用含有双抗的10%DMEM培养液培养。pCMV-Sport6-PIAS3、PRC-CMV、PRC-STAT3和PRC-STAT3-CT质粒均购自美国Addgene公司。
1.3 细胞转染
将A549细胞铺于12孔板,第2日待细胞密度达到90%以上时转染。将1.6 μg DNA溶于100 μl的Opti-mem无血清培养基中,将4 μl Lipofectamine 2000溶于100 μl Opti-mem无血清培养基中混匀室温放置5 min;将两管混合放置20 min。将培养基换成无双抗10%DMEM培养基每孔1000 μl后将mix加入12孔板对应孔中。
1.4 MTT比色法实验
细胞浓度调整为5×104个/ml;取24孔培养板,各孔加0.2 ml培养液,设5个复孔,在37 ℃、5%CO2和95%湿度环境下培养至24、48和72 h,分别在相应的孔里加入20 μl MTT染液,继续在培养箱中培养4 h;在每孔中加入100 μl DMSO,震荡混匀10 min后用酶联免疫检测仪检测波长492 nm处的光密度(optical density,OD)值。
1.5 克隆形成率实验
转染24 h后常规消化指数生长期的细胞,每个60 mm培养皿加入3 ml含有双抗的10% DMEM培养液,计数细胞后每皿接种500个细胞,每组设5个复孔培养皿置37 ℃、5%CO2和95%湿度的CO2培养箱培养7 d。用预温得D-Hank's洗涤细胞2遍后,甲醇固定20 min,去甲醇后姬姆萨染色液染色15 min,冲洗晾干后解剖显微镜下计数克隆数,按下式计算克隆形成率(CFE)和存活分数(SF):CFE(%)=(克隆数÷接种细胞数)×100%;SF(%)=(处理细胞克隆形成率÷对照细胞克隆形成率)×100%。
1.6 间接免疫荧光染色
细胞扒片生长后,转染质粒24 h后用预冷的磷酸盐缓冲液(phosphate buffer solution,PBS)洗细胞2遍,4%多聚甲醛(4%甲醛)室温约为20 ℃,1 ml固定10 min;PBS洗3遍,每次5 min;加入1 ml穿透液(含0.2%TritonX-100的PBS)室温破膜10 min;PBS洗2遍,每次5 min;加入含10%胎牛血清(fetal bovine serum,FBS)的PBS封闭液封闭1 h;于Parafilm膜上加入1∶100稀释的一抗37 ℃孵育1 h;除去一抗,用Wash buffer(含0.05%Tween-20,1%BSA的PBS)洗3次,每次5 min;加入1∶100稀液二抗,避光孵育1 h;除去二抗,用Wash buffer洗3次,每次5 min;DAPI染核后用Wash buffer洗3次,最后用PBS和蒸馏水各洗一次,用90%甘油封片。
1.7 统计学方法
应用SPSS 16.0统计软件进行数据分析,两组之间的比较采用t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MTT实验检测PIAS3过表达对A549细胞存活的影响
活细胞线粒体中琥珀酸脱氢酶能够代谢还原MTT,在细胞色素C的作用下生成蓝紫色的可用酶标仪进行测定的甲臜(Formazan)。死细胞中不含琥珀酸脱氢酶,加入MTT不会有反应,因此甲臜生成量与活细胞数成正比,可根据OD值推测出活细胞的数目。为了探索转染pCMV-Sport6-PIAS3后对A549细胞存活的影响,利用MTT实验检测了A549细胞24、48和72 h的存活情况。结果转染pCMV-Sport6-PIAS3后A549细胞的存活率与未处理组和空载对照组比较均出现了显著性降低,其中24 h后存活细胞为空载对照组的77.24%(t=22.31,P<0.01),48 h为空载对照组的70.66%(t=8.37,P<0.01),72 h为空载对照组的47.40%(t=11.32,P<0.01),(见表1和如图1所示)。
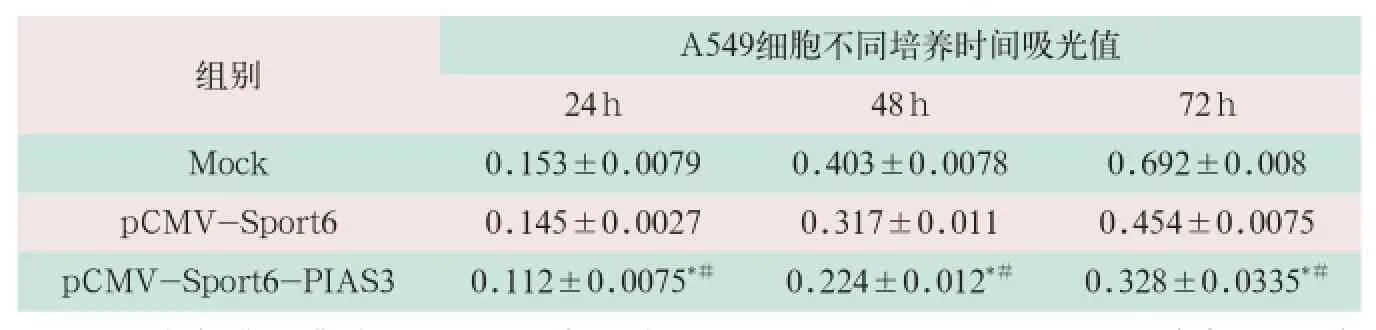
表1 MTT实验检测转染pCMV-Sport6-PIAS3不同时间后对A549细胞存活的影响
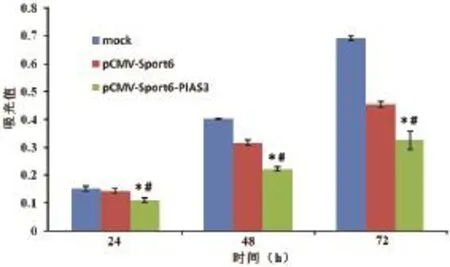
图1 转染pCMV-Sport6-PIAS3不同时间后对A549细胞存活的影响
2.2 克隆形成率检测PIAS3对A549细胞增殖的影响
MTT实验反映的活细胞的数量,但存活的细胞并非都具有增殖和形成克隆的能力,因此克隆形成率反映了细胞群体依赖性和增殖能力两个重要性状。A549细胞转染pCMV-Sport6-PIAS3后的克隆形成能力,结果存活分数仅为9.78%,其差异有统计学意义(t=55.67,P<0.01)(见表2)。
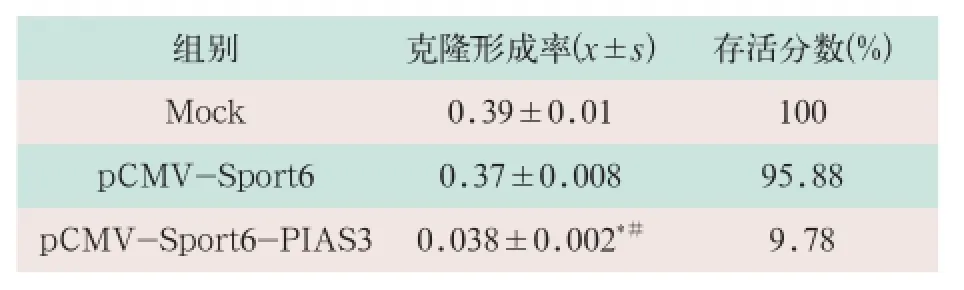
表2 pCMV-Sport6-PIAS3对A549细胞克隆形成率的影响
2.3 A549细胞中STAT3活性(即p-STAT3入核)依赖于PIAS3表达
本研究为探究在A549细胞中PIAS3对活化的STAT3抑制是否具有特异性,利用STAT3的过表达和持续性激活载体与PIAS3共转染后,观察PIAS3对STAT3入核的影响。免疫荧光染色实验表明,单独转染PIAS3组STAT3入核减少,与STAT3或STAT3-CT共转染,STAT3的入核率较之对照组仍然减少(如图2所示)。
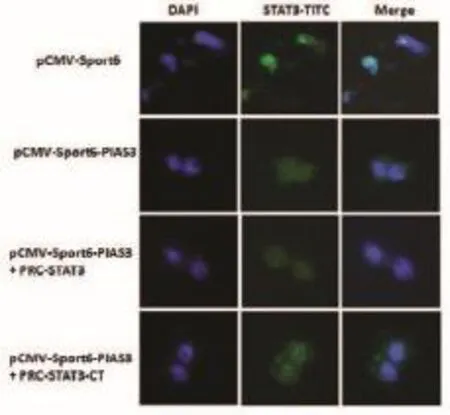
图2 pCMV-Sport6-PIAS3对STAT3入核的影响
3 讨论
多年来,本研究针对控制细胞增殖、分化和凋亡的JAK/STAT信号通路的关键因子STAT3进行的持续研究,结果发现,抑制脑胶质瘤和肺腺癌细胞STAT3表达后细胞体外增殖和体内形成肿瘤的能力均降低,同时发现STAT3的活化与肺腺癌细胞的侵袭和迁移相关[6-9]。基于STAT3在肺腺癌增殖中发挥的重要作用,本研究探索PIAS3作为STAT3的特异性蛋白抑制剂对肺腺癌细胞增殖的影响。实验发现,肺腺癌A549细胞过表达PIAS3后细胞的存活和增殖能力均显著降低。PIAS3表达上调后对细胞增殖的影响可能是由于降低STAT3活化水平的结果。Mautsa等研究也表明PIAS3通过抑制STAT3的转录活性,发挥其抑制细胞增殖的作用[10]。实验结果无论是单独转染PIAS3还是与STAT3或STAT3-CT共转染,STAT3的入核率较之对照组都减少,表明在A549细胞中PIAS3可能特异性的抑制STAT3的活化,即STAT3的活性完全依赖于PIAS3,这与Borghouts等[11]在研究中发现PIAS3作用于STAT3发生在激活后阶段的结果相一致。更为有趣的是,Dabir等[12]研究发现PIAS3的下游靶基因除了STAT3,还有ETS、EGR、NR1I2和GATA1,其中PIAS3调节的EGR1表达变化与Wnt/β-catenin及非小细胞性肺癌(NSCLC)死亡和增殖信号通路均相关,提示PIAS3在肺腺癌细胞中所发挥的作用比STAT3更加重要。这一结果为进一步研究利用辐射应答基因启动子驱动的PIAS3相关病毒载体联合放射治疗肺腺癌奠定了基础。
[1]Makinoshima H,Takita M,Matsumoto S,et al.Epidermal Growth Factor Receptor(EGFR) Signaling Regulates Global Metabolic Pathways in EGFR-mutated Lung Adenocarcinoma[J].J Biol Chem,2014,289(30):20813-20823.
[2]Zhang L,Li QX,Wu HL,et al.SNPs in the transforming growth factor-β pathway as predictors of outcome in advanced lung adenocarcinoma with EGFR mutations treated with gefitinib[J].Ann Oncol,2014,25(8):1584-1590.
[3]Serizawa M,Kusuhara M,Zangiacomi V,et al.Identification of metabolic signatures associated with erlotinib resistance of nonsmall cell lung cancer cells[J].Anticancer Res,2014,34(6):2779-2787.
[4]Tseng JS,Yang TY,Chen KC,et al.Prior EGFR tyrosine-kinase inhibitor therapy did not influence the efficacy of subsequent pemetrexed plus platinum in advanced chemonaïve patients with EGFR-mutant lung adenocarcinoma[J]. Onco Targets Ther,2014,7:799-805.
[5]Han JY,Kim SH,Lee YS,et al.Comparisonof targeted next-generation sequencing with conventional sequencing for predicting the responsiveness to epidermal growth factor receptortyrosine kinase inhibitor(EGFR-TKI)therapy in never-smokers with lung adenocarcinoma[J].Lung Cancer,2014,85(2):161-167.
[6]Ling Gao,Fengsheng Li,Bo Dong,et al.Inhibition of STAT3 and ErbB2 suppresses tumor growth,enhances radiosensitivity and induces mitochondria-dependent apoptosis in glioma cell[J]. International Journal of Radiation Oncology-Biology-Physics,2010,77(4):1223-1231.
[7]Fengsheng Li,Ling Gao,Zhi dong Wang,et al.Radiation enhances the invasion of pulmonary adenocarcinoma cells via STAT3[J].Molecular Medicine Reports,2013,7(6):1883-1888.
[8]Ling Gao,Feng-Sheng Li,Xiao-Hua Chen,et al.Radiation Induces Phosphorylation of STAT3 in a Dose-and Time-dependent Manner[J].Asian Pac J Cancer Prev,2014,15(15):6161-6164.
[9]李峰生,高玲,宋秀军,等.电离辐射对人肺腺癌A549细胞中STAT3靶基因表达的影响[J].中华放射医学与防护杂志,2013,33(5):461-464.
[10]Mautsa N1,Prinsloo E,Bishop ÖT,et al.The PINIT domain of PIAS3:structure-function analysis of its interaction with STAT3[J].J Mol Recognit,2011,24(5):795-803.
[11]Borghouts C1,Tittmann H,Delis N,et al.The intracellular delivery of a recombinant peptide derived from the acidic domain of PIAS3 inhibits STAT3 transactivation and induces tumor cell death[J].Mol Cancer Res,2010,8(4):539-553.
[12]Dabir S1,Kluge A,Aziz MA,et al.Identification of STAT3-independent regulatory effects for protein inhibitor of activated STAT3 by binding to novel transcription factors[J].Cancer Biol Ther,2011,12(2):139-151.
Effect of PIAS3 over expression on proliferation in adenocarcinoma A549 cells and the significance
YU Qing-hua, LI Feng-sheng, HUANG Nai-xiang, et al// China Medical Equipment,2015,12(1):10-13.
Objective: To explore the effect of PIAS3 on proliferation of lung adenocarcinoma A549 cells, in order to provide a foundation for the further study in which a adeno-associated virus (AAV) containing PIAS3 gene driven by a radiation response promoter plus radiotherapy will be used to treatment lung adenocarcinoma. Methods: The growth and proliferation of A549 cells transfected with pCMV-Sport6-PIAS3 plasmid were detected by MTT assay and cloning forming efficiency assay. The nucleus translocation of p-STAT3 was detected by immunofluorescence staining after CMV-Sport6-PIAS3 was co-transfected with PRC-CMV, PRC-STAT3 or PRCSTAT3-CT. Results: The growth and cloning form of A549 cells were significantly inhibited by PIAS3 overexpression. The result of immunofluorescence staining indicated that the nucleus translocation of p-STAT3 as significantly blocked by transfection with pCMV-Sport6-PIAS3, even after co-transfection with STAT3 or STAT3-CT. Conclusion: The overexpression of PIAS3 could inhibit the nucleus translocation of STAT3, which subsequently blocked the function of STAT3 and decreased the ability of growth and proliferation of A549 cells.
Protein inhibitor of activated STAT3; Adenocarcinoma; Cell viability; Cell proliferation; p-STAT3
1672-8270(2015)01-0010-04
R734.2
A
俞庆华,男,(1988- ),硕士研究生。解放军第307医院胸外科,研究方向:肺癌微创治疗。
10.3969/J.ISSN.1672-8270.2015.01.003
2014-10-29
国家自然科学基金(31340051)“腺病毒Ad-pig3RRP-PIAS3对辐射诱导肺腺癌细胞转移的抑制作用及其机制研究”;国家自然科学基金(81202151)“低剂量辐射对树突状细胞迁移能力的影响及其分子机制研究”;国家自然科学基金(81001216)“NOK激酶促进肿瘤细胞周期进程及提高肿瘤细胞辐射敏感性分子机制研究”;全军医学科技“十二五”科研项目(CWS12J082)“快速PCC-FISH方法作为辐射生物剂量计的研究”
①解放军第307医院胸外科 北京 100071
②第二炮兵总医院全军核辐射损伤医学监测与防治研究中心 北京 100088
③中国疾病预防控制中心辐射防护与核医学安全所 辐射防护与核应急中国疾病预防控制中心重点实验室 北京 100088
*通讯作者:gaoling@nirp.cn;lifs0624@163.com
