IgA肾病肾组织血管病变分析
2015-12-04周素晗权松霞邢国兰
周素晗,赵 苘,张 颖,权松霞,邢国兰#
1)郑州大学第一附属医院肾脏内科 郑州450052 2)河南省高等学校临床医学重点学科开放实验室 郑州450052
IgA 肾病(IgA nephropathy,IgAN)是目前世界范围内最常见的原发性肾小球肾炎,占我国原发性肾小球肾炎的45.2%~58.2%[1-3]。超过30%的患者20 a 内可进展为终末期肾功能衰竭(ESRD)[3-4]。许多临床指标如24 h 尿蛋白定量>1.0 g、高血压、初诊时肾功能损伤等是IgA 肾病进展的危险因素[4-8]。肾组织血管病变常被用于评估肾脏病预后[9-11]。一项1 005例的研究[12]发现,IgA 肾病患者普遍存在肾组织血管病变,病变严重程度与不良预后相关。然而,牛津分型研究[13]发现,IgA 肾病患者肾组织血管病变发生率低,且肾组织血管病变严重程度与肾脏功能损伤严重程度及肾脏病进展无关。该研究对1 699例IgA 肾病患者血管病变与临床病理表现及预后的关系进行了分析,进一步探究肾组织血管病变在IgA 肾病中的作用。
1 对象与方法
1.1 研究对象 选择郑州大学第一附属医院2011年1月到2013年12月肾穿刺活检诊断为IgA 肾病的患者1 699例,年龄3~83 (33.3 ±14.0)岁;男1 012例(59.6%),女687例(40.4%)。除外临床或病理提示有系统性疾病,如系统性红斑狼疮、ANCA 相关性血管炎、慢性肝病、坏死性血管炎、过敏性紫癜、糖尿病或糖耐量异常的患者。
1.2 病理学检查 肾脏病理组织标本要求不少于10个小球和6 条血管。肾活检标本经PAS 染色,由两位病理医生盲法评分,判断是否存在肾组织血管病变。肾组织血管病变定义为存在血管管壁增厚、小动脉玻璃样变、小动脉内皮细胞肿胀及血管壁周围淋巴细胞浸润中的任何一种改变。依据牛津分型MEST 分型体系对患者肾组织其他病理改变进行评分[14]。系膜细胞增生(M):>50%肾小球存在系膜细胞增生为M1,≤50%肾小球存在系膜细胞增生为M0;内皮细胞增生(E):无该病变为E0,任何肾小球有该病变为E1;节段性硬化或粘连(S):无该病变为S0,任何肾小球有该病变为S1;肾小管萎缩或间质纤维化(T):皮质受累面积百分比达0%~25%为T0,26%~50%为T1,>50%为T2。球性硬化、新月体比例以肾组织活检标本病变小球占所有小球的百分比表示。
1.3 观察指标的采集及随访 临床指标包括肾活检时患者的年龄、性别、血压,实验室指标包括血红蛋白、血清白蛋白、尿酸、24 h 尿蛋白定量、估计的肾小球滤过率(eGFR,单位为mL·min-1·1.73 m-2)等[15],计算eGFR 下降速度[eGFR 下降速度=(随访时eGFR -活检时eGFR)/随访时间]。采取门诊随访和电话随访两种方式,平均随访时间29个月,随访内容包括患者临床指标(如血清白蛋白、24 h 尿蛋白定量、血清肌酐)和治疗药物(如激素、免疫抑制剂及ARB 类药物)应用情况。终点事件定义为患者eGFR 下降50%(排除急性肾功能损伤)或患者进入透析。
1.4 统计学处理 应用SPSS 17.0 完成数据分析。有无血管病变组间指标的比较采用两独立样本t 检验或秩和检验或χ2检验;采用Kaplan-Meier 法绘制生存曲线,比较有无血管病变组的生存状况;采用Cox 回归模型分析肾组织血管病变对肾脏预后的影响。检验水准α=0.05。
2 结果
2.1 基本情况 1 699例IgA 肾病患者中,存在肾组织血管病变1 010例(59.4%),无血管病变689例(40.6%)。肾组织血管病变的病理表现见图1。
2.2 有、无肾组织血管病变组患者临床表现的比较见表1。肾活检时,有血管病变组患者年龄、高血压患者比例、贫血患者比例及血尿酸水平高于无肾血管病变组,eGFR 明显低于无肾血管病变组;两组患者24 h 尿蛋白定量及血尿患者比例差异无统计学意义。
2.3 有、无肾组织血管病变患者病理表现的比较见表2。有肾组织血管病变组系膜细胞增生患者比例、球性硬化及新月体比例高于无血管病变组,小管萎缩程度重于无血管病变组。两组内皮细胞增生患者比例差异无统计学意义。
2.4 有、无肾组织血管病变组预后的比较 因未留联系方式及电话变更等原因失访136例,随访患者共1 563例,其中有肾组织血管病变患者927例,无肾组织血管病变患者636例。有、无肾组织血管病变组应用ACEI/ARB 比例差异无统计学意义(36.2% vs 37.6%,χ2=0.288,P =0.591),随访24 h 尿蛋白定量差异有统计学[0.75(0.38,2.33)g vs 0.20(0.05,0.83)g,Z =4.212,P<0.001]。有肾组织血管病变组eGFR 下降速度快于无肾组织血管病变组[0.0(0.0,8.7)vs 0.0(0.0,2.0),Z =2.763,P =0.006)。随访期间终点事件发生249例,均为有肾组织血管病变组患者,两组Kaplan-Meier 生存曲线差异有统计学意义(χ2=13.196,P<0.001)。

图1 IgA 肾病患者肾组织血管病理表现(PAS,×400)
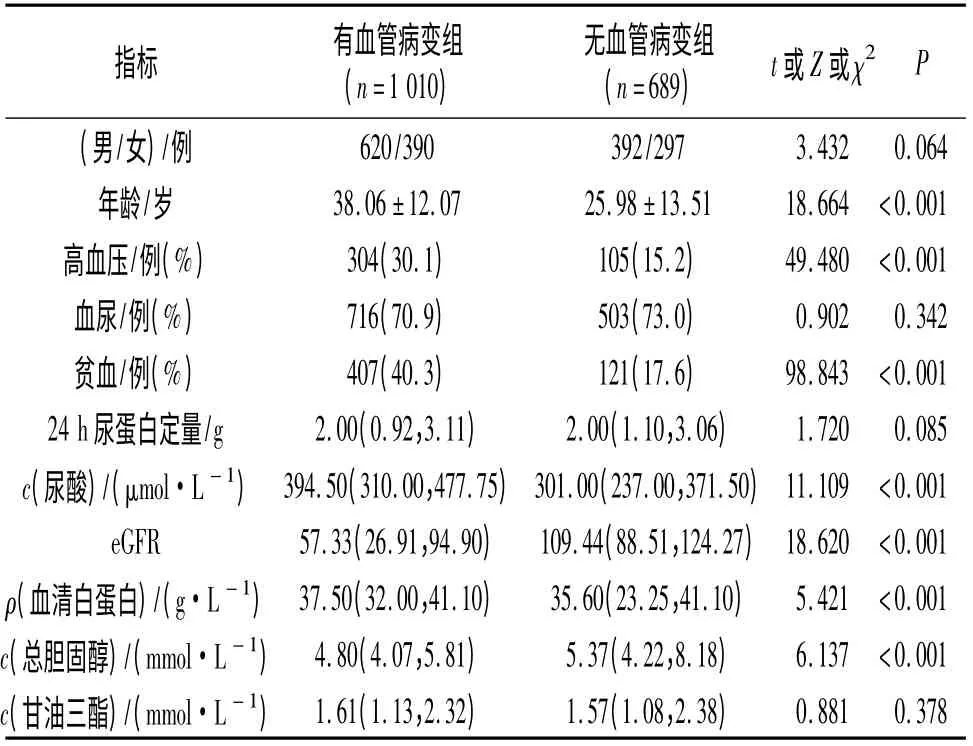
表1 两组患者临床表现的比较
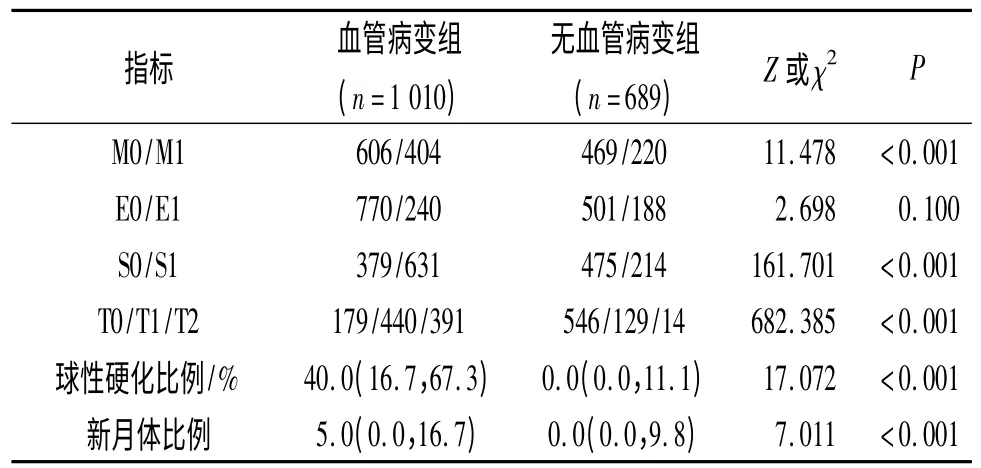
表2 两组患者病理表现的比较
2.5 COX 回归分析 结合临床及既往文献报道,以终点事件和时间为因变量,以患者性别、年龄为调整因素,以活检时(初始)eGFR、高血压、24 h 尿蛋白定量、牛津分型MEST、肾组织血管病变为自变量,进行Cox 回归,结果显示,血管病变不是IgA 肾病进入终点事件的独立危险因素(表3)。

表3 COX 回归分析结果
3 讨论
血管病变普遍存在于IgA 肾病患者中,该研究中其发生率达59.5%,明显高于牛津分型研究的报道[13],可能是因为该研究和牛津分型研究样本来自不同总体,该研究对象来自中国,而牛津分型研究对象多源于欧洲人群,两总体异质性较大(如种族、社会环境、生活方式、经济条件等多种因素不同)[16]。此外,牛津分型研究中将eGFR<30 mL/min 患者排除在外,而这类人群在此次研究中表现出较高的血管病变发生率。
该项研究通过随访证实,有血管病变组IgA 肾病患者eGFR 下降速度快于无肾组织血管病变组,因此也更易发生肾脏终点事件。Cox 回归分析结果显示,血管病变并非是肾脏终点事件的独立预测因素,高血压、初始eGFR、小管萎缩均与血管病变关系密切,血管病变通过与之相关的临床病理指标共同影响肾脏病进展。
该研究结果显示,在病理表现方面,有肾组织血管病变组患者球性硬化、节段硬化比例高,小管萎缩程度重,与既往研究一致[12],而这些病理改变预示着肾脏预后差[13,17]。临床改变方面,两组患者血尿比例及24 h 尿蛋白定量差异无统计学意义,与中国之前相关报道不同[12],而与牛津分型研究结果相同[13];有血管病变组高血压患者比例高于无肾血管病变组,且活检时肾功能损伤程度比无血管病变组更重。既往研究发现高血压和肾小球滤过率低是肾脏病预后差的危险因素[8,13,16]。此次研究结果还显示,有肾血管病变组患者易出现持续性蛋白尿,而持续性蛋白尿是肾脏病预后差的有力预测因素[18]。因此,有血管病变组患者临床病理改变均提示其进入终点事件的可能性大。
目前为止,IgA 肾病的肾组织血管病变机制尚不清楚。IgA 肾病是自身免疫性疾病[19-20],因此免疫损伤会起到一定作用。该研究结果提示,高龄、高尿酸血症、高血压是肾组织血管病变发生的危险因素,与文献报道一致[12]。因此限制高嘌呤食物的摄入、控制血压有助于避免IgA 肾病血管病变引起的肾脏损伤。综上所述,肾组织血管病变在IgA 肾病患者中普遍存在,与患者的临床、病理改变关系密切。有肾组织血管病变的IgA 肾病患者肾脏病预后差,尽管肾组织血管病变不是肾脏终点事件发生的独立预测因素,但它在IgA 肾病进展中起重要作用。
[1]Donadio JV,grande JP.IgA nephropathy[J].N Engl J Med,2002,347(10):738
[2]Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unit in China:analysis based on 13,519 renal biopsies[J].Kidney Int,2004,66(3):920
[3]Zhou FD,Zhao MH,Zou WZ,et al.The changing spectrum of primary glomerular diseases within 15 years:a survey of 3331 patients in a single Chinese centre[J].Nephrol Dial Transplant,2009,24(3):870
[4]Yamamoto R,Imai E.A novel classification for IgA nephropathy[J].Kidney Int,2009,76(5):477
[5]Le W,Liang S,Hu Y,et al.Long-term renal survival and related risk factors in patients with IgA nephropathy:results from a cohort of 1155 cases in a Chinese adult population[J].Nephrol Dial Transplant,2012,27(4):1479
[6]D'Amico G.Natural history of idiopathic IgA nephropathy and factors predictive of disease outcome[J].Semin Nephrol,2004,24(3):179
[7]Donadio JV,Bergstralh EJ,Grande JP,et al.Proteinuria patterns and their association with subsequent end-stage renal disease in IgA nephropathy[J].Nephrol Dial Transplant,2002,17(7):1197
[8]Wyatt RJ,Julian BA.IgA nephropathy[J].N Engl J Med,2013,368(25):2402
[9]Radford MG Jr,Donadio JV Jr,Bergstralh EJ,et al.Predicting renal outcome in IgA nephropathy[J].J Am Soc Nephrol,1997,8(2):199
[10]Goto M,Wakai K,Kawamura T,et al.A scoring system to predict renal outcome in IgA nephropathy:a nationwide 10-year prospective cohort study[J].Nephrol Dial Transplant,2009,24(10):3068
[11]Berthoux F,Mohey H,Laurent B,et al.Predicting the risk for dialysis or death in IgA nephropathy[J].J Am Soc Nephrol,2011,22(4):752
[12]Wu J,Chen X,Xie Y,et al.Characteristics and risk factors of intrarenal arterial lesions in patients with IgA nephropathy[J].Nephrol Dial Transplant,2005,20:719
[13]Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Cattran DC,Coppo R,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification[J].Kidney Int,2009,76(5):534
[14]Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Roberts IS,Cook HT,et al.The Oxford classification of IgA nephropathy:pathology definitions,correlations,and reproducibility[J].Kidney Int,2009,76(5):546
[15]Matsushita K,Mahmoodi BK,Woodward M,et al.Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate[J].JAMA,2012,307(18):1941
[16]Shi SF,Wang SX,Jiang L,et al.Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy:validation of the Oxford classification[J].Clin J Am Soc Nephrol,2011,6(9):2175
[17]Coppo R,Troyanov S,Bellur S,et al.Validation of the Oxford classification of IgA nephropathy in cohorts with different presentations and treatments[J].Kidney Int,2014,86(4):828
[18]Reich HN,Troyanov S,Scholey JW,et al.Remission of proteinuria improves prognosis in IgA nephropathy[J].J Am Soc Nephrol,2007,18(12):3177
[19]Suzuki H,Fan R,Zhang Z,et al.Aberrantly glycosylated IgA1 in IgA nephropathy patients is recognized by IgG antibodies with restricted heterogeneity[J].J Clin Invest,2009,119(6):1668
[20]段喜梅,张颖,刘璐,等.C3a、C5a 及其受体在IgA 肾病发病中的作用[J].郑州大学学报:医学版,2013,48(3):313
