不同正畸力对大鼠牙周组织张力侧BMP-2蛋白表达的影响*
2015-12-04王明洁王月张小平崔淑霞
常 悦,王明洁,王月,张小平,崔淑霞
1)郑州大学口腔医学院 郑州450052 2)河南省口腔医院正畸科 郑州450052
生理状态下牙周组织处于成骨和破骨的动态平衡之中,在正畸力作用下牙周组织发生适应性改建,压力侧破骨细胞增生活跃,以骨吸收为主,张力侧成骨细胞增生活跃,以骨生成为主。正畸过程中安全有效地加速牙齿移动一直是广大学者关注的课题。骨形成蛋白是转化生长因子-β 超家族成员[1],研究[2]表明,其主要参与机体的成骨活动。骨形成蛋白2(bone morphogenetic protein-2,BMP-2)是该家族中研究最广泛、诱导活性最强且惟一能单独诱导成骨的因子。该实验通过建立大鼠正畸牙齿移动模型,观察不同正畸力作用下牙周组织张力侧BMP-2蛋白表达的变化,深入了解成骨细胞活化的时机和机制,为探讨不同力值与牙周组织改建的关系奠定生物学基础。
1 材料与方法
1.1 实验动物及分组 10 周龄的Wistar 大鼠60只(山东鲁抗医药股份有限公司实验动物室提供,许可证号:SCXK 鲁20130001),雄性,体重210~227 g,要求牙体、牙列完整,无龋齿及牙周病变。普通饲料分笼饲养,适应性喂养1 周后,将大鼠按不同力值分成4组:A组(0 g)、B组(30 g)、C组(50 g)、D组(80 g),各15只。
1.2 材料及仪器 游标卡尺(桂林广陆数字测控股份有限公司),弹簧测力计(杭州西湖生物材料有限公司),镍钛螺旋拉簧(北京圣马特科技有限公司),正畸用0.020 mm 结扎钢丝(杭州森风齿科材料厂),BMP-2 抗体、SP 试剂盒、DAB 显色试剂盒(北京中杉金桥生物技术有限公司)。
1.3 大鼠正畸牙齿移动模型的建立 选择大鼠左侧第一磨牙为实验牙,切牙为支抗牙,用100 mg/L水合氯醛腹腔注射麻醉并固定大鼠。采用0.020 mm 正畸结扎钢丝从左上第一磨牙和第二磨牙的邻间隙穿过,并连接于预备好的镍钛螺旋拉簧一端备用。用牙科高速涡轮机尖头金刚砂车针在上颌中切牙和第一磨牙的牙颈部颊侧面和近中轴面制备一浅凹,用正畸测力计分别调整正畸力为0、30、50、80 g,用游标卡尺分别测量各力值拉伸的距离,另取一段结扎钢丝连接于镍钛螺旋拉簧另一端并拉伸至实验所用的力值长度,固定于中切牙的固位沟内。以上颌2个中切牙为支抗向前移动第一磨牙。最后用树脂粘结剂覆盖结扎钢丝与固位沟处以加强固位。每日检查动物口腔并测量力值以保证力值恒定,发现镍钛螺旋拉簧脱落则重新加载。为补偿螺旋拉簧应力疲劳及牙移动引起的力值衰减,每周加力1次。
1.4 牙齿移动距离的测量 各组分别于安装牙齿移动装置后第1、3、7、14、21天各处死3只大鼠,分离左侧上颌骨,用游标卡尺测量每只大鼠上颌左侧第一磨牙远中舌沟点与第二磨牙近中舌沟点间的距离(整个测量的过程中忽略支抗的丧失),由同一人进行测量,结果精确到0.01 mm,测量3次,取平均值。
1.5 牙周组织HE 染色观察 处死大鼠,取上颌第一、二磨牙及周围牙槽骨组织,多聚甲醛固定48 h。采用100 g/L EDTA(pH 7.4)于4℃条件下脱钙4~6周,至用大头针扎标本的牙组织感觉无阻力为止。常规乙醇梯度脱水各24 h,体积分数95%乙醇与正丁醇混合液、正丁醇各处理12 h。二甲苯透明,梯度浸蜡,60~62℃石蜡包埋,制备牙齿上颌骨近远中方向纵切片,片厚5 μm,HE 染色,观察牙周组织的变化情况。
1.6 牙周组织张力侧BMP-2 蛋白表达的检测 牙周组织切片脱蜡至脱水化后,体积分数3% H2O2封闭10 min,1 g/L 胰蛋白酶室温孵育10 min 灭活内源性酶,PBS 冲洗3次,每次2 min;滴加50 μL BMP-2 抗体(按1∶50 稀释)。4℃过夜,PBS(pH 7.2~7.6)洗涤3次,每次10 min,37℃复温1 h,滴加50 μL DAKO 二抗复合物,37℃孵育30 min,PBS 洗3次,每次3 min,DAB 显色,显微镜下观察显色5~10 min。蒸馏水冲洗,苏木素轻度复染,蒸馏水冲洗。常规脱水,透明,封片,显微镜下观察。利用Biosens Digital Imaging System(上海山富科学仪器有限公司)高清晰度彩色病理图文分析系统对BMP-2 进行定量分析。在组织切片上确定测量部位:第一磨牙根中1/3 处张力侧(远中)牙周膜的近牙骨质侧。每个部位选择3个视野,测定积分光密度值,结果取平均值。
1.7 统计学处理 采用SPSS 17.0 进行统计分析,4组间大鼠牙齿移动距离及牙周组织张力侧BMP-2蛋白表达情况的比较采用析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 各组大鼠牙齿移动距离的比较 结果见表1。
2.2 各组大鼠牙周组织HE 染色结果 A组各时间段牙周膜近远中间隙等宽,胶原纤维排列规则,破骨细胞少见。B组压力侧牙周膜变窄,牙槽骨边缘可见少量的骨吸收陷窝和破骨细胞。C组牙周组织反应活跃,牙周胶原纤维排列不规则,可见大量的骨吸收陷窝和破骨细胞;张力侧牙周膜间隙增宽,血管扩张,新生的成骨细胞沿牙槽骨侧排列。D组压力侧牙周膜纤维排列混乱,有明显的牙槽骨和牙骨质的吸收,破骨细胞少见;张力侧牙周纤维断裂,新生的成骨细胞和成牙骨质细胞少见。见图1。
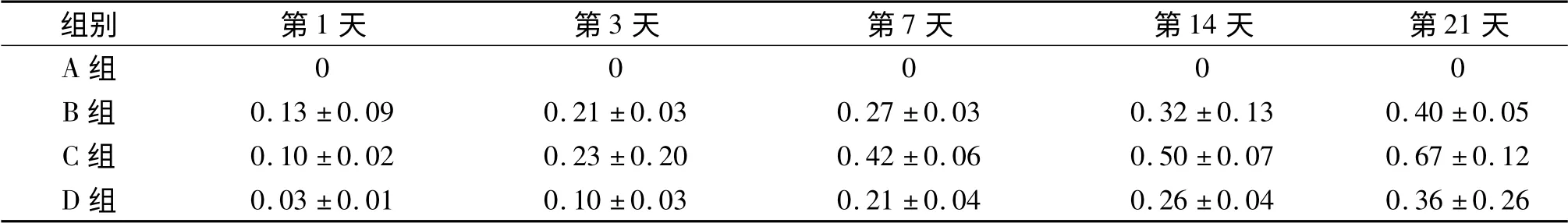
表1 各组大鼠牙齿移动距离的比较(n=3) mm
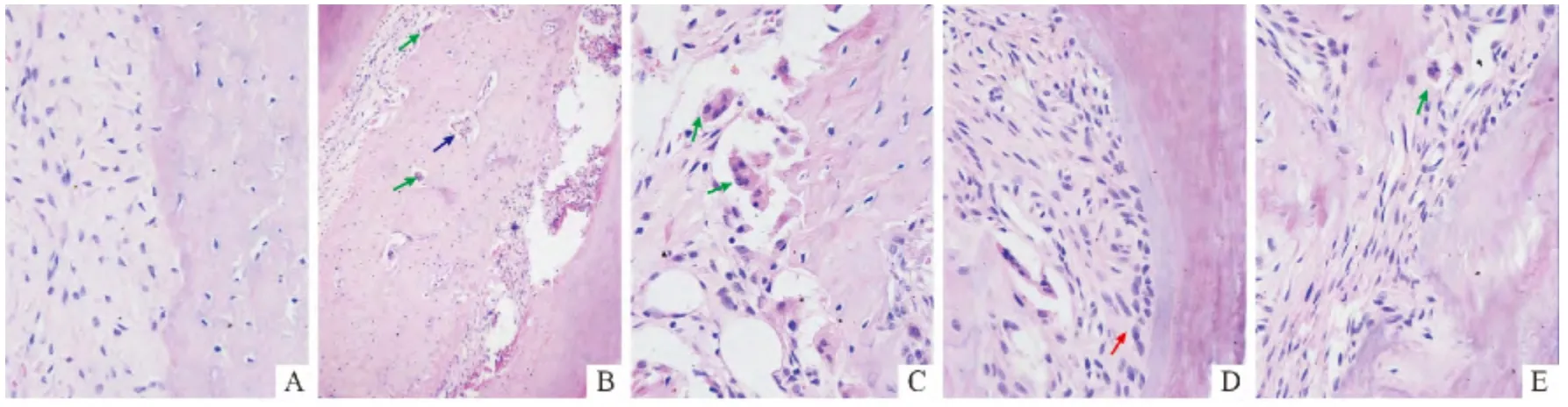
图1 正畸力施加第7天各组大鼠牙周组织形态学观察(HE,×200)
2.3 各组大鼠牙周组织张力侧BMP-2 蛋白表达的检测 结果见图2、表2。

图2 正畸力施加第7天各组大鼠牙周组织张力侧BMP-2 蛋白的表达(SP,×400)

表2 各组大鼠牙周组织张力侧BMP-2 蛋白相对表达量的比较(n=3)
3 讨论
正畸力是正畸牙齿移动的关键因素。King等[3]观察发现40~60 g 是正畸牙齿移动的适当力值范围,可以观察到特征性的牙齿移动及相关骨改建的过程。燕滨漪等[4]观察发现,大鼠磨牙施加80~100 g 力时,压力侧出现广泛的透明样变,发生潜行性骨吸收。因此该实验选用小力值30 g、中力值50 g、大力值80 g 来研究大鼠牙周组织的变化情况。
在正畸过程中,牙齿移动伴随着牙槽骨的改建,因此动物实验常以牙移动速度来动态反映骨改建的情况。该实验结果显示,第1~7天时B组和C组牙齿移动快,可能是因为牙齿移动前期牵拉牙周膜使其出现张力侧增宽,牙周膜存在弹性较大张力侧纤维增殖、增粗,促使牙周组织改建活跃,牙齿移动距离增大。第7~14天,各加力组牙齿移动速度较慢;组织学观察显示:压力侧血管压缩、血流受阻,牙周膜内出现玻璃样变结构,牙槽骨改建停滞。第14~21天B组和C组牙齿移动距离增大,说明进入了进行性牙齿移动阶段,C组移动距离最大,可能牙周组织改建活跃,说明其力值是牙槽骨改建的最适力值。而D组牙齿移动基本停滞,可见牙周组织压力侧破骨细胞较少,压力侧根中部可见牙骨质的吸收,牙槽骨表面出现不规则的破骨陷窝,以潜掘性吸收为主。可能是由于力值过大,牙槽骨改建受到抑制的缘故。以上说明50 g 是利于大鼠牙齿移动的最适力值,合适的正畸力促进牙周组织改建,提高矫治效能。
BMP-2 是诱导活性最强的成骨细胞因子,参与BMP-Smad 信号传导通路[5-6],在体内通过自分泌和旁分泌的方式促进骨、软骨等相关结缔组织的形成[7-8]。研究[9-10]显示BMP-2 在张力侧牙周组织牙周韧带(PDL)中,尤其在PDL 新生牙骨质和牙槽骨附近染色较强,证实其与牙槽骨的改建有关。该实验结果显示,A组张力侧牙周组织BMP-2 染色较浅,可能是在未加力的状态下,牙周组织以自分泌形式维持其稳态;B组BMP-2 表达相对较低,说明其激活张力侧牙周膜及牙槽骨中成骨细胞和成纤维细胞的能力低,牙槽骨改建不活跃;C组BMP-2 表达增高,说明C组牙周组织改建活跃,促进张力侧成骨细胞和成纤维细胞增殖和分化;D组与C组相比,差异无统计学意义,可能D组牙周组织破坏严重,牙槽骨改建延迟。
综上所述,该实验研究结果与机械阈值理论相一致。30 g 力时应变量很小,骨代谢处于负平衡状态,以骨吸收为主,成骨活动不活跃,牙槽骨改建缓慢。50 g 力时,应变量增加,骨代谢进入正的平衡状态,成骨活动活跃,以骨沉积为主,牙槽骨改建较快。80 g 力时超过牙周膜改建的最适力值,牙周组织破坏严重,骨代谢又进入负平衡状态,成骨和破骨活动均不活跃,牙槽骨改建停滞。了解合适的力值在正畸治疗中的重要性,既利于牙槽骨改建又可以提高牙齿移动的效能。
[1]司晓辉,刘正.TGFβ 和rhBMP2 对人牙周膜成纤维细胞的作用[J].上海口腔医学,2002,11(1):53
[2]Ducy P,Karsenty G.The family of bone morphogenetic proteins[J].Kidney Int,2000,57(6):2207
[3]King GJ,Keeling SD,McCoy EA,et al.Measuring dental drift and orthodontic tooth movement in response to various initial forces in adult rats[J].Am J Orthod Dentofacial Orthop,1991,99(5):456
[4]燕滨漪,冯云霞,张亮.不同力值对正畸治疗影响的实验研究[J].山西医科大学学报,2009,40(7):607
[5]陈远萍,孙新华,吴学礼,等.正畸牙齿移动时骨形成蛋白表达变化的实验研究[J].现代口腔医学杂志,2001,15(4):268
[6]Wikesjö UM,Qahash M,Huang YH,et al.Bone morphogenetic proteins for periodontal and alveolar indications;biological observations - clinical implications[J].Orthod Craniofac Res,2009,12(3):263
[7]Matsuda H,Nakano K,Muraoka R,et al.BMPs and related factors appearing in the mouse periodontal tissues due to orthodontic mechanical stress[J].J Hard Tissue Biol,2010,19(3):153
[8]Feng J,Yang G,Yuan G,et al.Abnormalities in the enamel in BMP2-deficient mice[J].Cells Tissues Organs,2011,194(2/4):216
[9]刘宏伟,史俊南,吴织芬,等.骨形成蛋白在狗牙周组织中的分布及其意义[J].牙体牙髓牙周病学杂志,1992,2(1):26
[10]李宝勇,丁寅,潘峰,等.牙周炎大鼠正畸牙齿移动中牙周组织内iNOS 的表达变化[J].实用口腔医学杂志,2007,23(4):543
