miRNA-29b在特发性肺间质纤维化中的抗纤维化作用*
2015-12-04赵国强张国俊
路 尧,李 萍,赵国强,张国俊#
1)郑州大学第一附属医院呼吸内科 郑州450052 2)郑州大学基础医学院微生物学与免疫学教研室 郑州450001
miRNA 是一类长度在19~25 nt 的非编码小分子RNA,通过与靶基因序列3'-UTR 区域特异性结合调控基因表达,从而参与多种生理和病理过程,包括细胞增生、分化、凋亡及癌变等[1]。近年来miRNA 与脏器纤维化的基因表达调控成为研究热点,为临床靶向治疗脏器纤维化提供了可能。特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是弥漫性间质性肺病中的一种特殊类型,是一种原因不明、出现在成人、局限于肺、进行性致纤维化的间质性肺炎[2]。miRNA-29b(简称miR-29b)在多种器官纤维化的调控中发挥着重要的作用,包括心、肝、肺纤维化等[3]。现有研究[4]证实miR-29b 在IPF 患者肺组织中表达显著下调。因此,作者设计将miR-29b 的类似物(mimic)转染至体外培养的人胚肺细胞IMR-90 细胞中,探讨上调miR-29b 表达对上皮间充质转化(epithelialmesenchymal transition,EMT)的影响。
1 材料与方法
1.1 实验材料 IMR-90 细胞株(ATCC 公司),人重组TGF-β1 (rhTGF-β1,PeproTech 公 司),miR-29b mimic(上海吉玛生物有限公司),高糖DMEM 培养基、优质胎牛血清(HyClone 公司),脂质体转染试剂盒Lipofectamine 2000(Invitrogen 公司),兔抗人β-actin、p-Smad3、Smad3、上皮标志物E-钙黏蛋白(Ecad)、间质标志物平滑肌肌动蛋白(α-SMA)和下游靶基因Ⅰ型胶原蛋白(COL1A1)、GAPDH 多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(Bioss 公司),总RNA 提取试剂盒(Omega 公司),逆转录试剂盒(Thermo 公司),实时荧光定量PCR 试剂盒(Thermo 公司),BCA 蛋白定量试剂盒(Boster 公司),PVDF 膜(Biosharp 公司),ELC 发光剂(Beyotime 公司)。
1.2 细胞培养、转染后形态学观察 用含体积分数10%优质胎牛血清的高糖DMEM 培养基于37℃、体积分数5%CO2人工培养箱中常规培养IMR-90细胞,细胞呈贴壁生长后,用0.5 g/L 胰蛋白酶消化、传代。当细胞生长至70%~80%融合时,用无血清培养基静止细胞24 h 使同步化,把细胞随机分为4组:空白对照组、2 μg/L TGF-β1 诱导组、miR-29b 转染组(2 μg/L TGF-β1 诱导48 h[5]+miR-29b mimic 瞬时转染)及miR-29b 阴性对照组(2 μg/L TGF-β1 诱导48 h +无意义对照序列瞬时转染,NC组),于6 孔板中培养。当细胞生长至70%~80%融合时参照Invitrogen 公司的Lipofectamine 2000 试剂说明书进行转染,然后正常培养于37℃、体积分数5%CO2人工培养箱中48 h。使用倒置相差显微镜观察各组细胞形态改变。
1.3 各组细胞中miR-29b 表达水平和上皮及间质细胞标志物mRNA 表达的实时荧光定量PCR 检测各组细胞按对应实验要求处理后离心收集,严格按照试剂盒说明书操作,提取细胞总RNA,检测RNA 纯度及浓度并逆转录成cDNA 于-20℃保存。采用实时荧光定量PCR 检测miR-29b 表达水平(以U6 为内参)及细胞中E-cad、α-SMA 和COL1A1 mRNA 表达水平(以GAPDH 为内参)。引物序列见表1。引物由上海生工生物工程技术服务有限公司合成,严格按照试剂盒说明书操作。实时荧光定量PCR 反应条件:95℃10 min 1个循环;95℃15 s,60℃60 s,40个循环。检测结果用2-ΔΔCt相对定量分析方法进行计算。每组细胞培养时均设5个复孔。
1.4 各组细胞中上皮及间质细胞标志物蛋白表达的Western blot 检测 各组细胞按对应实验要求处理后离心收集,提取细胞总蛋白,严格按照试剂盒说明书操作,采用BCA 法,以一定浓度梯度的蛋白标准液,绘制标准浓度曲线,计算各组细胞提取的蛋白浓度。以50 μg 蛋白上样量进行SDS-PAGE 电泳,然后电转移至PVDF 膜上,50 g/L 脱脂奶封闭液室温封闭1 h,分别加入Smad3、p-Smad3、E-cad、α-SMA 和COL1A1 的一抗(按1∶500 稀释),GAPDH为内参(按1∶1 000 稀释),4℃孵育过夜,二抗室温孵育1 h,加入ECL 发光剂,在美国ProteinSimple公司的PC-E 型化学发光成像系统中曝光,扫描图像。通过Image J 图像分析软件对蛋白条带进行灰度分析,以目的条带与内参条带灰度值的比值为相对表达量。每组细胞培养时均设5个复孔。

表1 引物序列
1.5 统计学处理 采用SPSS 17.0 进行数据分析,应用单因素方差分析和LSD-t 检验比较各组细胞中miR-29b 表达水平、上皮及间质细胞标志物mRNA和蛋白表达的差异。检验水准α=0.05。
2 结果
2.1 细胞形态学观察 与空白对照组比较,TGFβ1 诱导组细胞由正常的鹅卵石形或多角形转变为梭形、纺锤形,细胞间连接变松散,呈现间充质细胞形态;与TGF-β1 诱导组相比miR-29b 转染组细胞形态有明显改变,呈现类似鹅卵石形或多角形上皮形态;而NC组细胞形态仍呈间充质细胞形态,与TGF-β1 诱导组相比无明显变化,见图1。
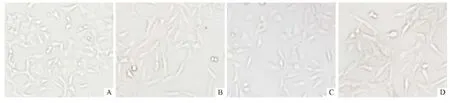
图1 各组细胞形态学变化(×20)
2.2 各组细胞中miR-29b 及上皮和间质细胞标志物mRNA 的表达 见表2。
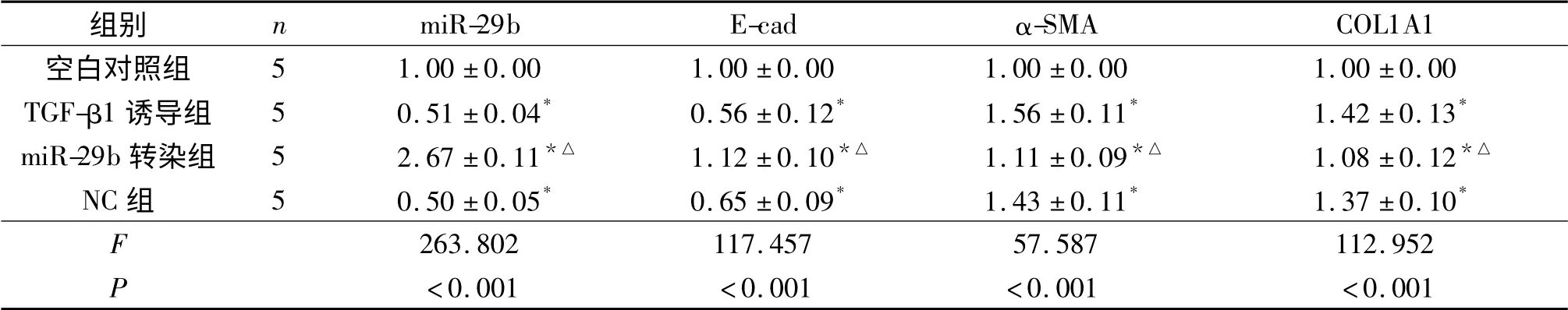
表2 各组细胞中miR-29b 和E-cad、α-SMA 和COL1A1 mRNA 相对表达量比较
2.3 各组细胞中上皮及间质细胞标志物蛋白表达的变化 见表3、图2。
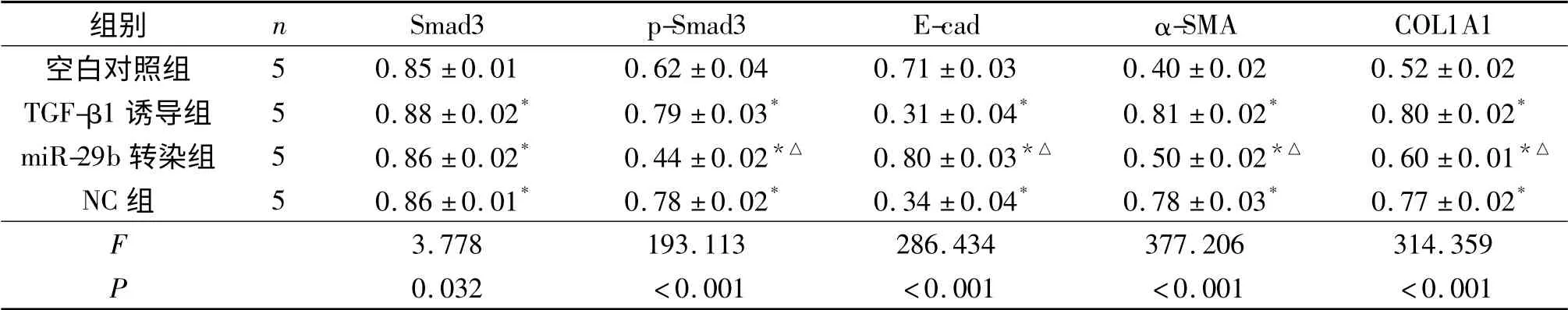
表3 各组细胞中Smad3、p-Smad3、E-cad、α-SMA 和COL1A1 蛋白相对表达量比较

图2 各组细胞中上皮及间质细胞标志物蛋白的表达
3 讨论
IPF 的病理表现为肺泡上皮细胞的损伤,肺泡EMT 发生,纤维母细胞以及成纤维母细胞灶形成,使细胞外基质蛋白(ECM)产生增多,导致ECM 过度沉积和肺泡结构破坏,最终导致肺纤维化及肺功能受损[6]。EMT 主要表现为上皮细胞失去极性,与周围细胞和基质的接触减少,细胞黏附力下降,迁移和运动能力增加,同时细胞表型发生改变[7]。EMT受多种细胞因子和生长因子的调节[8]。其中,TGFβ/Smad 是最主要的致纤维化信号通路,TGF-β1 可将胞浆中的Smad3 磷酸化后移位于细胞核中调控下游基因的转录表达,从而介导EMT 的发生[9]。该过程中,上皮细胞的标志物E-cad、桥粒斑蛋白等表达下调;而间质表型标志物(如α-SMA、N-钙黏蛋白、波形蛋白等[10])表达上调,故作者选取E-cad、α-SMA 和COL1A1 来评定外源性TGF-β1 诱导EMT的发生机制。
miR-29b 是一个与纤维化疾病紧密相关的miRNA,参与多条信号通路的调控。Cushing 等[11]发现TGF-β1 可下调miR-29 表达,减轻其对TGF-β/Smad信号通路的抑制作用,导致ECM 的主要成分胶原蛋白(COL1A1、COL3A1 等)表达增多,最终导致纤维化的发生。这提示通过上调miR-29 的表达有可能会抑制TGF-β/Smad 信号通路介导的EMT 发生,进而延缓EMT 的发展。
该研究中,通过倒置相差显微镜观察发现体外培养的IMR-90 细胞形态转变为梭形,呈现间充质细胞形态,细胞内p-Smad3 蛋白表达量显著增加,Ecad 表达显著下降,α-SMA 和COL1A1 表达显著上升,说明经外源性TGF-β1 诱导后IMR-90 细胞已发生EMT。在此基础上,将miR-29b mimic 转染入细胞内,上调miR-29b 在细胞内的表达,检测结果表明,与TGF-β1 诱导组相比,转染miR-29b mimic 后细胞内E-cad 的表达升高,而p-Smad3 蛋白表达量减少,且α-SMA 和COL1A1 的表达下降;通过倒置相差显微镜观察,miR-29b 转染组细胞形态由间充质细胞形态转变为类似鹅卵石形或多角形正常上皮形态,细胞间连接恢复。结果提示,上调miR-29b 表达可对发生EMT 的IMR-90 细胞中TGF-β/Smad 信号通路产生一定程度的抑制作用,显示miR-29b 具有抗纤维化潜能。
目前对miR-29b 抑制TGF-β/Smad 信号通路的具体作用机制尚不清楚,该研究中上调miR-29b 的表达后,发现COL1A1 的表达量降低,验证了miR-29b 对ECM 中胶原蛋白表达的抑制作用;同时发现p-Smad3 表达量减少,而Smad3 蛋白作为TGF-β/Smad 信号通路的主要信号转导分子,其大量被磷酸化可将TGF-β1 与其受体结合后产生的EMT 发生信号从胞质传导至胞核中,促进EMT 的发生。因此,推测上调miR-29b 表达可能抑制TGF-β1,减少EMT 发生信号的传导,进而减缓EMT 的进程。不过,介导EMT 发生的信号通路还包括Wnt/β-catenin、NF-κB 和PI3K-AKT 等,其中多条信号通路可联合相互作用,针对miR-29b 参与这些信号通路的具体作用有待进一步研究。
目前研究[12]证实miRNA 能够游离于细胞之外,稳定存在于血浆或血清中,在多种肿瘤和非肿瘤疾病的诊断和预后中显示了独特的价值,提示miR-29b 很有可能成为一种新型的反映纤维化程度的指标,为及时发现和早期诊断IPF 提供线索;同时具有抗纤维化潜力的miR-29b 有可能成为新的分子治疗靶点,为治疗IPF 提供新的思路和方向。
[1]Li Y,Kowdley KV.MicroRNAs in common human diseases[J].Genomics Proteomics Bioinformatics,2012,10(5):246
[2]Raghu G,Collard HR,Egan JJ,et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J].Am J Respir Crit Care Med,2011,183(6):788
[3]He Y,Huang C,Lin X,et al.MicroRNA-29 family,a crucial therapeutic target for fibrosis diseases[J].Biochimie,2013,95(7):1355
[4]Pandit KV,Milosevic J,Kaminski N.MicroRNAs in idiopathic pulmonary fibrosis[J].Transl Res,2011,157(4):191
[5]冯涛,王懿春,郭曲练.TGFβ1 对人胚肺成纤维细胞中miR-29 表达的影响[J].医学临床研究,2014,31(4):631
[6]King TE Jr,Pardo A,Selman M.Idiopathic pulmonary fibrosis[J].Lancet,2011,378(9807):1949
[7]Lim J,Thiery JP.Epithelial-mesenchymal transitions:insights from development[J].Development,2012,139(19):3471
[8]王司仪,原铭贞,刘笑玎,等.细胞因子与肺纤维化相关性的研究进展[J].吉林大学学报:医学版,2014,40(6):1325
[9]Derynck R,Muthusamy BP,Saeteurn KY.Signaling pathway cooperation in TGF-beta-induced epithelial-mesenchymal transition[J].Curr Opin Cell Biol,2014,31:56
[10]梁艳,王皓,杨再兴,等.上皮间质转化在纤维化疾病中的研究进展[J].中国实验诊断学,2013,17(8):1530
[11]Cushing L,Kuang PP,Qian J,et al.miR-29 is a major regulator of genes associated with pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2011,45(2):287
[12]Zen K,Zhang CY.Circulating microRNAs:a novel class of biomarkers to diagnose and monitor human cancers[J].Med Res Rev,2012,32(2):326
