巨龙竹木质素化学结构研究
2015-12-03成聃睿史正军杨海艳缪正调刘蔚漪郑志锋辉朝茂
成聃睿 史正军 杨海艳 缪正调 刘蔚漪 郑志锋 辉朝茂 邓 佳
(1 西南林业大学 云南省高校生物质化学炼制与合成重点实验室 昆明 650224 2 教育部省部共建西南山地森林资源保育与利用重点实验室 昆明 650224)
巨龙竹木质素化学结构研究
成聃睿1史正军1杨海艳1缪正调1刘蔚漪2郑志锋1辉朝茂2邓 佳2
(1 西南林业大学 云南省高校生物质化学炼制与合成重点实验室 昆明 650224 2 教育部省部共建西南山地森林资源保育与利用重点实验室 昆明 650224)
为解析巨龙竹木质素化学结构特征,采用高效阴离子交换色谱、凝胶色谱、傅里叶变换红外光谱、核磁共振等现代仪器分析技术,对巨龙竹木质素样品进行检测。结果表明:弱酸性环境有利于打断巨龙竹木质素与半纤维素之间的化学联接而使木质素更易于分离,且对木质素中的主要联接键破坏较小;巨龙竹木质素含有紫丁香基(S)、愈创木基(G)以及对羟基苯基(H)3种基本结构单元,属于禾草类木质素;巨龙竹木质素基本单元间化学联接键以β-O-4′结构为主,并存在一定量的β-β′、β-5′、β-1′化学联接。
巨龙竹;木质素;化学结构;结构表征;核磁共振
中国是世界竹类资源最丰富的国家,竹子种类和竹林面积居世界首位,具有发展竹产业的优越资源条件[1]。巨龙竹(Dendrocalamus sinicus)属禾本科(Gramineae)竹亚科(Bambusoideae)牡竹属(Dendrocalamus)竹种,原产于云南南部西双版纳、德宏、普洱、保山等地区,1982年首次在云南西双版纳被发现并命名[2]。巨龙竹秆高可达30 m以上,径粗可达34 cm,是世界上迄今为止所发现秆型最高大的竹种[3]。据研究,巨龙竹单位面积产材量比毛竹高5~8倍,堪称“竹中极品、世界之最”,被视为极具研究和开发利用价值的特大型经济用材竹种之一[4]。由于巨龙竹被发现的时间较晚,且分布区科技文化相对落后,目前对其基本化学性质的研究还远远不够,其高值化转化利用缺乏可靠的科学理论指导。因此,本研究选用有机溶剂从巨龙竹秆材提取得到木质素组分,并采用现代仪器分析手段解析其化学结构,意在通过本研究为巨龙竹资源的化学转化利用提供必要的理论基础。
1 实验材料及方法
1.1实验材料制备
实验所用巨龙竹采自云南省临沧市沧源佤族自治县。选取正常生长、无病虫害的3年生巨龙竹,经风干、粉碎后,筛选245~350 μm的竹粉,保存于广口瓶中,备实验用。巨龙竹原料化学组分按美国国家可再生能源国家实验室标准方法测定[5],其中纤维素含量为44.5%,半纤维素含量为17.6%,木质素含量为28.6%。
1.2实验步骤
将制备好的40~60目巨龙竹竹粉用体积比2:1的苯醇溶液抽提6 h,抽提后的脱蜡竹粉行星球磨8 h,再用96%二氧六环溶液抽提48 h,然后过滤。将所得滤液pH调至5.5,用旋转蒸发器浓缩到30 mL,然后用3倍体积的95%乙醇进行沉淀。通过离心分离,去除半纤维素沉淀。将离心所得液体继续浓缩至15 mL,调节pH值为2.0,最后离心得到磨木木质素(MWL)。用含有0.05 M盐酸的85%二氧六环溶液,在85 ℃下抽提第一步所得滤渣5 h,过滤。将滤液按照上述方法进行分离纯化得到酸解木质素(MAL)。将MWL和MAL冷冻干燥后保存,备分析测试用。
1.3分析测试方法
1.3.1木质素得率及纯度
木质素的得率按照产物占原料干重的百分比进行计算。木质素纯度采用高效离子交换色谱法(HPAEC)测定,先在2 mL水解瓶中放入5 mg样品和1.475 mL的10% H2SO4溶液,在105 ℃条件下水解2.5 h,将水解液过滤后稀释一定倍数(约50倍),再用戴安高效阴离子色谱进行单糖分析。
1.3.2木质素分子量
木质素分子量采用安捷伦1200工作站(凝胶色谱)进行测定。称取4 mg样品,溶解于2 mL四氢呋喃中,将溶液过滤进色谱柱进行分析,采用分子量为435 500、66 000、9 200和1 320 g/mol 4种聚苯乙烯标样作为测定标准。
1.3.3木质素红外光谱分析
采用KBr压片法测定木质素红外光谱特征。按1%比例将待测木质素样品均匀分散于KBr中,波长范围4 000~400 cm-1,用Tensor 27型红外吸收光谱仪在透射模式下测定木质素红外光谱。
1.3.4木质素核磁共振分析
采用布鲁克400 M超导核磁共振仪测定木质素的核磁共振碳谱。溶剂采用氘代DMSO,在FT模式100.6 MHz下进行信号采集,选取DMSO的化学位移(39.5×10-6)进行校标。
2 实验结果与分析
2.1木质素得率及纯度
木质素的得率及纯度测定结果见表1。从表1可知,样品MWL和MAL的得率分别为6.8%和8.7%,其中木质素含量分别为82.3%和88.4%,聚糖组分含量分别为16.6%和8.5%。通过比较,弱酸性环境下分离出的木质素样品(MAL)得率更高,且该样品中糖含量只有MAL的一半左右,说明弱酸性环境有利于破坏木质素与半纤维素之间的相互作用,将木质素更好的分离出来。此外,样品中的残留糖均以木聚糖为主,说明木质素与木聚糖可能存在交联[6]。

表1 巨龙竹木质素组分的得率及糖含量
2.2分子量及其分布
MWL和MAL的重均分子量(Mw)及数均分子量(Mn)通过凝胶渗透色谱测定。由于在测定时以聚苯乙烯标样作为标准,测定出的木质素分子量并非绝对值,而是相对值,测定结果见表2。木质素的分子量大小能够反映不同的分离方法对木质素大分子降解的程度。分子量越大,说明分离过程对木质素大分子结构的破坏越小,所分离出的木质素在结构上更接近原本细胞中的木质素。本实验MWL和MAL的木质素分子量分别是4 750 g/mol和3 790 g/mol,相比之下MAL的木质素分子量略小,其原因是MAL样品中含糖量比MWL少,导致MAL测得的分子量低。木质素分子量的多分散性是衡量木质素利用价值的重要因素,木质素分子量分布越均一,其利用价值越高,所用分离方法越有效。MWL和MAL的多分散系数分别为1.6和1.8,分离出的木质素分子量分布范围较窄,木质素分子结构比较均一。
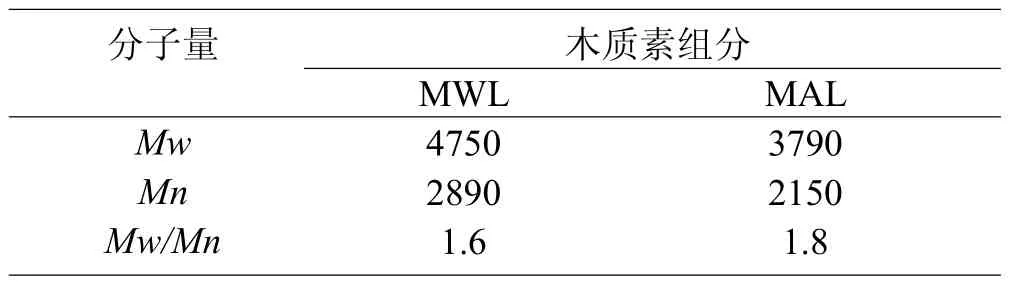
表2 巨龙竹木质素的重均分子量(Mw)、数均分子量(Mn)及多分散性(Mw/Mn)
2.3红外光谱分析
木质素样品MWL和MAL的红外光谱如图1所示。不难看出,MWL和MAL的红外光谱特征极为相似,只在吸收强度上略有不同。红外光谱图中各个吸收峰参照相关文献进行归属[7-9]。3 398 cm-1处强吸收峰来自O-H的伸缩振动,2 939 cm-1和2 843 cm-1处的吸收峰代表CH3和CH2的C-H伸缩振动峰。在1 705 cm-1处的吸收峰是非共轭酮基、羰基和酯键的C=O振动;而MAL的红外光谱中该吸收峰较弱,可以判断出酸性溶液提取的木质素中阿魏酸酯键或乙酰基受到了破坏。在1 601 cm-1、1 512 cm-1、1 423 cm-1处的吸收峰是木质素苯环骨架振动的特征吸收峰,说明分离过程中木质素的基本结构没有被破坏。1 458 cm-1处的吸收峰代表苯环C-H及甲氧基C-H的变形振动峰。1 122 cm-1、833 cm-1、1 162 cm-13处吸收峰说明2个样品都属于禾草类木质素(GSH型),其大分子由对羟基苯丙烷、愈创木基丙烷和紫丁香基丙烷3种基本结构单元组成。
2.4核磁共振分析
为进一步研究木质素的化学结构特征,对MAL和MWL进行了核磁共振分析,其13C-NMR图谱见图2。木质素核磁共振碳谱图中相关信号峰对照文献进行归属[10-13],归属结果参见表3。
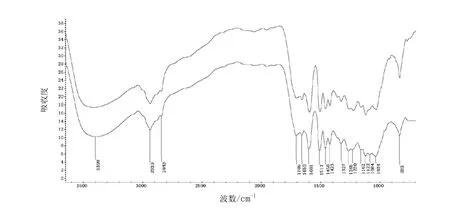
图1 巨龙竹MAL(上)和MWL(下)的红外光谱图

图2 MAL(上)和MWL(下)核磁共振碳谱
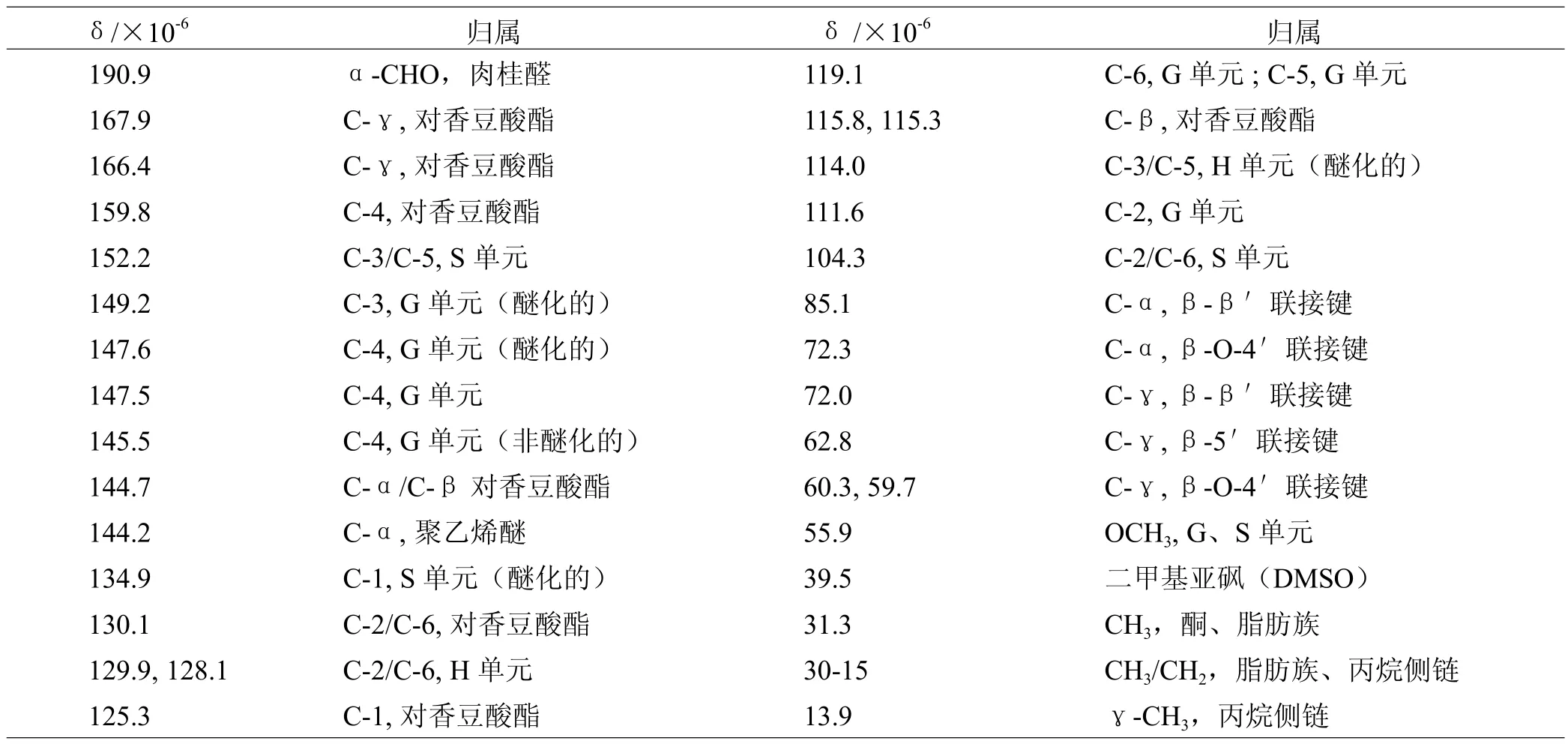
表3 巨龙竹木质素组分的13C-NMR信号归属
对于木质素样品MAL,信号166.3×10-6、159.8×10-6、130.2×10-6、125.0×10-6、115.8×10-6、115.3×10-6分别代表对香豆酸酯(ρCA)的C-γ、C-4、C-2/C-6、C-1、C-β、C-β,这些信号峰的出现是由于竹材木质素苯丙烷单元侧链的γ位置上有酯化的对香豆酸。木质素13C-NMR图谱中均出现显著的紫丁香基单元(S)、愈创木基单元(G)以及对羟基苯基单元(H)信号峰。其中,S型结构单元信号峰有:152.2×10-6(C-3/C-5,醚化)、147.2×10-6(C-3/C-5,非醚化)、134.8×10-6(C-1,醚化)、104.2×10-6(C-2/C-6,醚化);G型结构单元信号峰有:147.2×10-6(C-4,醚化)、111.6×10-6(C-2,醚化的和非醚化的);H型结构单元信号峰有:130.2×10-6。这些信号峰的出现再次证实了巨龙竹木质素属于禾草类木质素。此外,13C-NMR图谱中还出现一些木质素各单元间联接键的信号峰,β-O-4′信号出现在72.3×10-6、60.2×10-6,β-β′位于71.9×10-6,β-5′在62.8×10-6。愈创木基或紫丁香基的-OCH3的信号出现在55.9×10-6。在65.7×10-6~102.0×10-6发现少量微弱糖类信号,说明木质素样品中存在少量糖组分,此结果与红外光谱检测结果相符。
在木质素样品MWL的核磁共振碳谱图中,信号167.9×10-6、166.4×10-6、159.8×10-6、130.1×10-6、125.3×10-6、125.0×10-6、115.8×10-6、115.3×10-6分别代表对香豆酸酯(ρCA)的C-γ、C-γ、C-4、C-2/ C-6、C-1、C-1、C-β、C-β。通过对比可知,MWL 碳谱中对香豆酸酯的信号峰多于MAL,说明中性有机溶剂抽提可以更好地保留木质素中C-γ位的对香豆酸酯。在MWL样品中,S型结构单元信号峰有:152.2×10-6(C-3/C-5,醚化)、134.9×10-6(C-1,醚化)、104.3 ×10-6(C-2/C-6,醚化),G型结构单元信号峰有: 149.2×10-6(C-3,醚化)、147.6×10-6(C-4,醚化)、145.5×10-6(C-4,非醚化)、119.1×10-6(C-6或C-5)、111.6×10-6(C-2,醚化的和非醚化的),H型结构单元信号峰有:130.1×10-6、114.0×10-6(C-3/C-5,醚化)。同样,MWL中也有明显的β-O-4′、β-β′、β-5′以及愈创木基或紫丁香基中-OCH3的相关信号峰。13.9×10-6~31.3×10-6范围内的信号峰代表木质素丙烷侧链的γ-甲基、α和β-亚甲基,而63.3×10-6~101.8×10-6的信号峰说明样品中含有糖类杂质,此结果与样品纯度检测及红外光谱分析结果一致。
3 结论
通过得率、化学纯度、分子量、红外光谱、核磁共振等分析,对巨龙竹木质素进行结构表征研究。结果表明,木质素MAL纯度更高,其糖含量约为MWL糖含量的一半,说明弱酸性的二氧六环溶液能够有效地断开木质素与半纤维素之间的化学链接,促进木质素的溶出;巨龙竹木质素属于禾草类木质素,木质素大分子含有紫丁香基、愈创木基和对羟基苯基3种基本结构单元;巨龙竹木质素基本单元间联接键以β-O-4′结构为主,同时存在一定量的β-β′、β-5′、β-1′联接;此外,巨龙竹木质素大分子C-γ位存在对香豆酸酯结构,这种结构在中性有机溶剂条件下更容易完整保留。
[1]张齐生.竹类资源加工及其利用前景无限[J].中国林业产业, 2007(3): 22-24.
[2]贾良智,孙吉良.我国发现巨型竹[J].竹类研究, 1982, 1(1): 10-11.
[3]辉朝茂,杨宇明,杜凡.珍惜竹种巨龙竹[M].昆明:云南科技出版社, 2006.
[4]辉朝茂,张国学,李在留,等.珍惜竹种巨龙竹种群特性及其保护研究[J].竹子研究汇刊, 2004, 23 (4): 4-9.
[5]Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass[R]// Laboratory Analytical Procedure(LAP):NREL/TP-510-42618. USA: National Renewable Energy Laboratory, 2008: 12-42.
[6]文甲龙.生物质木质素结构解析及其预处理解离机制研究[D].北京:北京林业大学, 2014.
[7]Marques A V, Pereira H, Rodrigues J, et al. Isolation and comparative characterization of Björkman lignin from the saponified cork of Douglas-fir bark[J]. Journal of Analytical and Applied Pyrolysis, 2006, 77(2): 169-176.
[8]Xu F, Sun R C, Sun J X, et al. Determination of cell wall ferulic and ρ-coumaric acids in surgarcane bagasse [J]. Analytia Chimica Acta, 2005, 552 (2): 207-217.
[9]孙勇,张金平,杨刚,等.二氧化氯氧化云杉木质素的光谱研究[J].光谱学与光谱分析, 2007, 8(27): 1551-1554.
[10]Xu F, Geng Z C, Liu C F, et al. Structural characterization of residual lignins isolated with cyanamide-activated hydrogen peroxide from various organosolvs pretreated wheat straw [J]. Journal of Applied Polymer Science, 2008, 109(1): 555-564.
[11]Capanema E A , Balakshin M Y, Kadla J F. Quantitative characterization of a hardwood milled wood lignin by nuclear magnetic resonance spectroscopy [J]. Journal of Agricultural and Food Chemistry, 2005, 53(25): 9639-9649.
[12]Sun X F, Xu F, Sun R C, et al. Characteristics of degraded lignins obtained from steam exploded wheat straw [J]. Polymer Degradation and Stability, 2004, 86(2): 245-256.
[13]史正军.甜龙竹及巨龙竹半纤维素、木质素结构诠释及相互间化学键合机制解析[D].北京:北京林业大学,2013.
Chemical Structure of Lignin Isolated from Dendrocalamus sinicus
Cheng Danrui1Shi Zhengjun1Yang Haiyan1Miao Zhengdiao1Liu Weiyi2Zheng Zhifeng1Hui Chaomao2Deng jia2
(1 University Key Laboratory of Biomass Chemical Refinery & Synthesis, Southwest Forestry University, Kunming 650224, Yunnan, China 2 Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China, Southwest Forestry University, Kunming650224,China)
The high performance anion exchange chromatography (HPAEC), gel permeation chromatography (GPC), Fourier transform infrared spectroscopy (FTIR), and nuclear magnetic resonance spectra (13C-NMR) were adopted to test the samples of lignin fractions isolated from Dendrocalamus sinicus in order to characterize its chemical structural features. The results indicated that the weak acid treatment could help break the chemical inter-linkages between lignin and hemicelluloses, and make lignin component easier to be isolated while impose lesser damages on its main linkage. The bamboo lignin belongs to grass lignin, containing 3 basic units including syringl (S), guaiacyl (G), and p-hydroxylphengl (H). In addition, the dominant linkages among S, G, and H units were β-O-4′ linkages, followed by a certain amount of β-β′, β-5′, and β-1′ linkages.
Dendrocalamus sinicus, lignin, structural characterization, nuclear magnetic resonance (NMR)
10.13640/j.cnki.wbr.2015.02.001
国家自然科学基金项目(31260165、31160154);林业科技成果国家级推广项目([2012]66);国家农业科技成果转化资金项目(2012GB2F300417);云南省竹藤科学创新团队建设项目;云南省教育厅基金项目(2011Z040)。
成聃睿(1990-),男,四川成都人,在读研究生,从事林产化工方面的研究工作。E-mail: chengdr@qq.com。
邓佳,讲师,博士,研究方向为森林培育与利用。E-mail: dengjia1983@163.com。
