碳纳米管-辣根过氧化氢酶-聚氨基苯硼酸复合物制备过氧化氢生物传感器
2015-12-03
(怀化学院 化学与化学工程系,湖南 怀化 418008)
由于其可逆的相互作用,硼酸基化合物被广泛地用于化学/生物传感的识别单元,比如对含邻位双羟基的单糖[1-2]、多巴胺[3]、乳酸[4]、糖基化血红蛋白[5]和糖蛋白识别[6].而许多糖蛋白包括酶都是含糖基蛋白,如葡萄糖氧化酶的羰基化程度达到16%~25%.因此,基于硼酸-二醇相互作用用于生物界面的识别势必受到极大的关注[7-9].通过其单体的电化学[1,10]或化学聚合[11],硼酸-二醇相互作用已经被有效地用于聚合自掺杂聚氨基苯硼酸.电化学聚合一般需在酸性条件下采用恒电位或循环伏安法来进行,但很难制备大量的聚合物.而化学聚合需采用相对较强的化学氧化剂,其氧化产物不能溶解于相应的溶剂中[12].因此,酶作为生物催化剂用于聚合物聚合引起了广泛的关注[13-18].比如一些氧化还原酶,如HRP[19]、漆酶[20]、葡萄糖氧化酶(GOD)[21]、血红蛋白[22]等均用于苯胺的水相聚合.
碳纳米管(CNTS)由于其高的机械性能、弹性和独特的电子特性而被赋予了广泛的运用,比如基于碳纳米管为模板对聚合物的合成.这些杂化材料表现出来的性质往往是不同于任何单一组分所表现出来的性质.因此,CNTS/聚合物复合材料在能源器件、微电化学系统、超级电容器、太阳能生物传感器等方面得到改善其性能的作用[23-25].而导电聚合物往往成为了制备碳纳米管/聚合物复合材料的首选,如聚吡咯、聚噻吩和聚苯胺[26-28].聚苯胺不仅能在空气和许多溶剂中稳定存在,还能在质子掺杂的条件下表现出独特的电子结构和物理性能.
基于PABA 优良的生物相容性和特异性识别及CNTS 优良的导电性,以典型糖蛋白酶(HRP)为生物催化试剂,通过一步酶催化作用制备了MWCNTs-HRP-PABA 复合物材料,并用于过氧化氢的生物传感的构建.过氧化氢的直接电化学及对H2O2电化学催化性能实验表明,通过酶催化一步制备方法来固定糖蛋白酶能为酶提供了一个生物相容的微环境.
1 实验部分
1.1 试剂与仪器
MWCNTs 购自nanoports 有限公司 (中国深圳),直径为20~40 nm,长度5~15 nm.使用前,将用3∶1的浓硝酸和浓硫酸混合配置的溶液处理,80℃反应24 h 引入羧酸基团,然后分散在水溶液中,用水冲洗到中性pH值,60℃下干燥.
HRP (250 U·mg-1,国药化学试剂有限公司),氨基苯硼酸一水合物(ABA,邵圆化工科技有限公司,上海),30%的过氧化氢溶液(上海桃浦化工厂),过氧化氢溶液的制备要现配现用.0.1 M 磷酸盐缓冲液(PBS)作为支持电解质.其它试剂均为分析纯.所有试剂采用双蒸馏水制备.实验均在室温20℃左右进行.
电化学实验在CHI660C 电化学工作站进行(CHI仪器有限公司,上海辰华)由CHI660C 软件控制.电化学实验采用玻碳电极为工作电极,饱和甘汞电极(SCE)为参比电极,碳棒为对电极的三电极系统.紫外-可见吸收光谱用UV2450 分光光度计(岛津有限公司,日本).PHS-3C pH 计(上海雷磁SCI 仪器公司).扫描电化学显微镜SEM (S4800,日本日立).
1.2 MWCNTs-HRP-PABA 复合材料的制备
MWCNTs-HRP-PABA 复合材料合成如下:1 mg纯化的MWCNTs 超声分散于10 mL 0.1 M PBS 溶液,然后加入10mg ABA 充分溶解.加入2 mg HRP,不断搅拌1 h.为了避免由于过量的过氧化物酶的抑制,用0.3%的H2O2溶液逐滴加入,混合物反应搅拌1 h 后,直到一种黑色的MWCNTs-HRP-PABA 复合物从溶液中沉淀出来.未反应的单体经透析分离12 h 从溶液中除去.
1.3 MWCNTs-HRP-PABA 修饰电极的制备
将玻璃碳电极(GCE,直径3 mm)清洗干净.将5 μL 1 mg/mL MWCNTs-HRP-PABA 溶液滴于GCE表面.放入冰箱中自然干燥得到所需电极.
2 结果与讨论
2.1 聚氨基苯硼酸的酶促聚合
用HRP作为生物催化剂,当H2O2作为温和的氧化剂加入到单体溶液,溶液的颜色没有改变,表明ABA的氧化和聚合发生的很缓慢.而在HRP 添加后颜色很快变成墨绿色,随着时间的推移颜色完全变黑,离心得到复合物材料.
ABA 氧化聚合的紫外可见光谱如图1所示.吸光度与酶促聚合在450 nm 附近极化子吸收带随H2O2的加入显著增加,这可能是由于低聚物的合成伴随醌和苯环之间转换诱导.在292 nm 处有一个明显的吸收峰,且曲线1~11的紫外吸收峰值迅速增大,这是由于ABA 单体发生了快速的氧化还原反应,ABA 聚合生成PABA,紫外光谱的峰值明显增大.
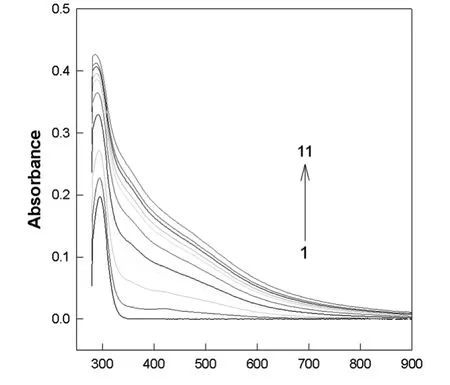
图1 ABA,PABA-HRP 复合物的紫外-可见吸收光谱图
曲线1为ABA,曲线2~11为不同反应时间的PABA/HRP 复合物
2.2 扫描电子显微镜(SEM)
利用SEM技术表征了MWCNTs 及MWCNTs-PABA 修饰电极的表面形貌.图 (2A)为单一MWCNTs,其形状为弯曲带状并相互交错盘结.聚合物修饰后,带状直径明显增大,表明PABA 完全覆盖到了MWCNTs 上,如图(2B)所示.

图2 MWCNTs 及MWCNTs-PABA的SEM 图
2.3 MWCNTs-PABA的电化学表征
图3是MWCNTs和MWCNTs-PABA 修饰电极在0.2 M H2SO4溶液中的循环伏安曲线.MWCNTs-PABA修饰的电极 (曲线b)含有两对氧化还原峰,而MWCNTs 修饰电极没有明显的氧化还原峰(曲线a),这是典型的聚苯胺的氧化还原峰,这表明ABA 已被成功固定在MWCNTs 上.

图3 MWCNTs (a)和MWCNTs-PABA (b)修饰电极在0.2 M H2SO4 中的循环伏安曲线图
2.4 修饰电极的电化学特性

图4 MWCNTs (a)与MWCNTs-HRP-PABA (b)修饰电极在0.1 M PBS (N2 氛)中的循环伏安图
修饰电极在0.1 M PBS 溶液中-0.6~0 V的电位范围内扫描得到的CVs (图4).与MWCNTs 修饰电极相比,MWCNTs-HRP-PABA 修饰电极在-0.35 V 处出现了一对氧化还原峰(b),这是HRP和底层电极之间发生直接电子转移的结果.结果表明,HRP 已被成功地固定在纳米复合材料上且电化学活性保存良好.
修饰电极电流响应随扫描速率的增大而迅速增大,但峰电位基本保持不变(图5).峰电流Ipa和Ipc与扫速速率的平方根成线性关系,其回归方程是:Ipc(μA)=3.0440+0.3773 v (mV·s-1) (R2=0.9983)和Ipc(μA) =-11.043-0.4252 v (mV·s-1) (R2=0.9985),这表明电极表面发生的电化学反应是受扩散控制的可逆电化学过程.
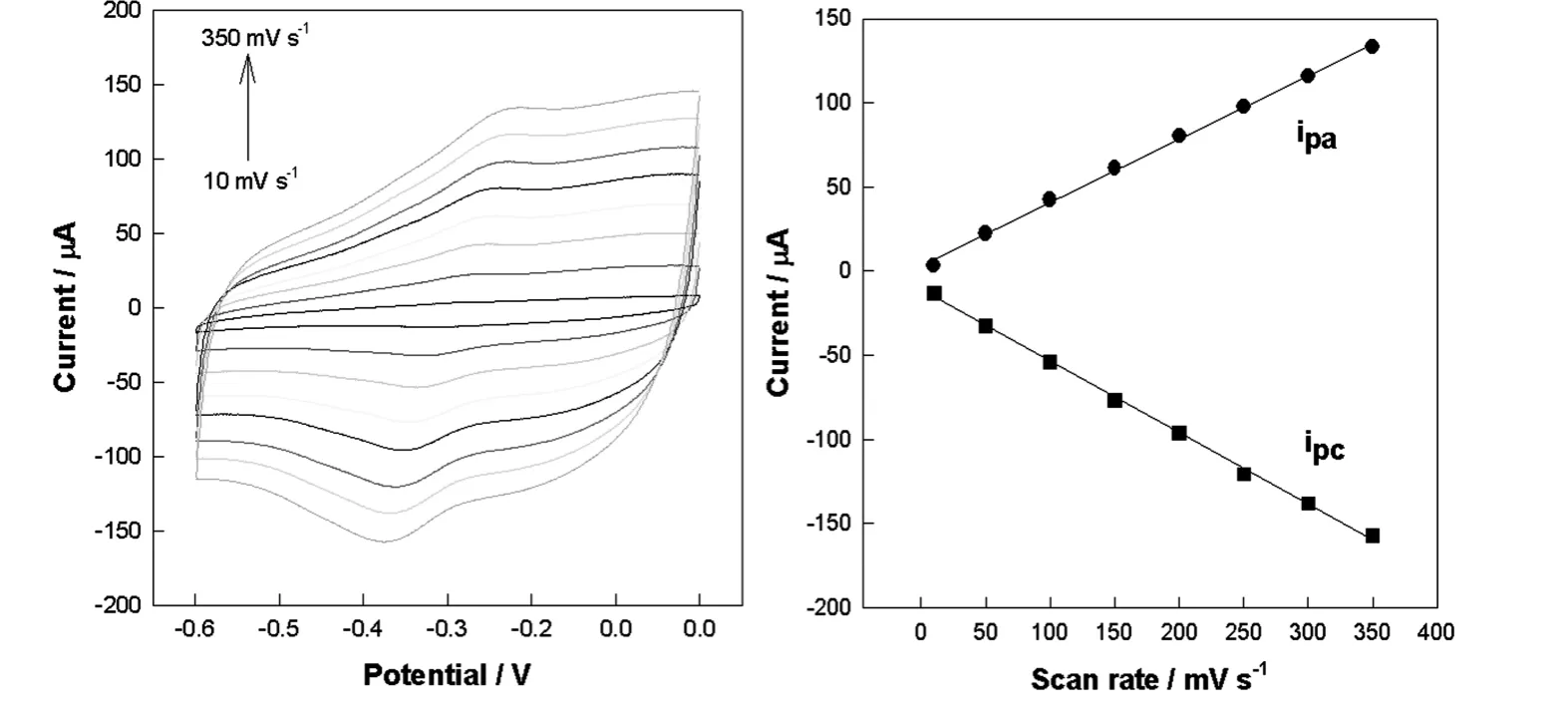
图5 MWCNTs-HRP-PABA 修饰电极在PBS 中在不同扫描速率时的循环伏安图

图6 MWCNTs-HRP-PABA 修饰电极在加入0 mM H2O2(曲线a)和0.5 mM H2O2 (曲线b)的循环伏安图
过氧化氢生物传感器在空白和含过氧化氢的PBS(pH 7.0)溶液中的循环伏安曲线如图6.在空白的PBS 溶液中,在-0.25 V/-0.35 V 出现一对氧化还原峰,这归属于聚苯胺的氧化还原峰.加入过氧化氢后,这对氧化还原峰发生了明显的变化,氧化峰明显减小,而还原峰明显增大,这是典型的催化行为.
2.5 实验参数优化
pH条件优化表明在pH 7条件下传感器的响应最大(如图7A),因此我们实验的条件选择在pH 7的条件下进行.另外我们也考察了电位对传感器的响应的影响,结果表明在-0.25 V 时可以得到最高的灵敏度(如图7B).

图7 pH值对H2O2 传感器的影响(A)及响应电流与外加电压的关系(B)
2.6 过氧化氢生物传感器的电流响应
如图8所示,在施加电压为-0.25 V时,MWCNTs-HRP-PABA 修饰玻碳电极在加入不同浓度的过氧化氢时发生典型的安培电流响应.结果表明:过氧化氢在20 μM~1.21 mM之间生物传感器的电流响应与过氧化氢的浓度成线性关系,线性方程为:ΔI(μA) =-5.390 ×10-3+5.405 c(R2=0.9973),检测限为5 μM (S/N=3).随着过氧化氢浓度的增加,通过电流逐渐增大,结果表明修饰电极上固定的酶保持了良好的生物活性.
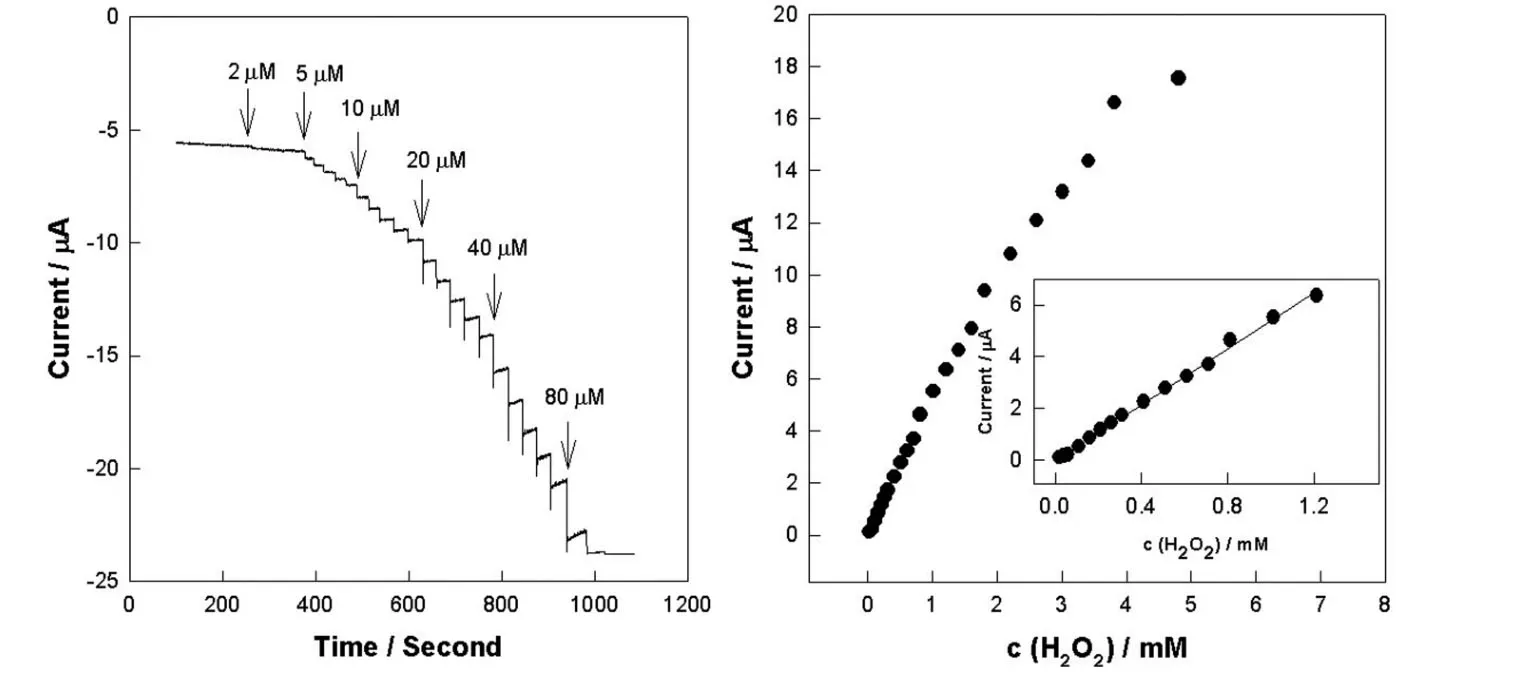
图8 MWCNTs-HRP-PABA 修饰电极对H2O2 响应的I - t 曲线图
2.7 重复性,稳定性的干扰测定
为了考查传感器的稳定性,使用同批次购置的9支酶电极响应相同量的H2O2,其响应电流几乎不变,展现了良好的制备和检测重复性,相对标准偏差(RSD)为1.8%.生物传感器的长期稳定性是评价性能的重要参数,该修饰电极对H2O2的催化氧化稳定性进行了研究,被保存在4℃环境2 周后,电流信号下降小于5.1%,表明该修饰电极具有良好的稳定性.
3 结论
基于酶催化和硼酸特异性识别成功地制备了MWCNTs-HRP-PABA 复合材料,并建立了一种新颖的过氧化氢生物传感器.相比已报道的过氧化氢生物传感器而言,该传感器表现出响应快,灵敏度高,其检测下限为5 M.笔者认为主要有两个原因所引起:第一,该复合物提高了酶的活性中心到电极表面更加便利的传导路径和提供了保持酶活性理想的微环境,特别是硼酸能可逆地与1,2-或1,3 邻二醇化合物成键更是有利于保持酶的活性;第二,这种酶催化苯胺聚合的方法更有利于对H2O2催化,提高灵敏度.总之,这种酶催化合成的生物膜为发展一种高灵敏的电化学生物传感器提供了一种可能.
[1]Shoji E,Freund M S.Potentiometric Sensors Based on the Inductive Effect on the pKa of Poly (aniline):A Nonenzymatic Glucose Sensor[J].J.Am.Chem.Soc.,2001,123 (14):3383-3384.
[2]Wang W,Gao X M,and Wang B H.Boronic Acid-Based Sensors[J].Current Organic Chemistry,2002,6(14):1285-1317.
[3]Ali S R,Ma Y F,Parajuli R R,et al.A Nonoxidative Sensor Based on a Self-Doped Polyaniline/Carbon Nanotube Composite for Sensitive and Selective Detection of the Neurotransmitter Dopamine[J].Anal.Chem.,2007,79 (6):2583-2587.
[4]Takahashi S,Kurosawa S,Anzai J I.Electrochemical Determination of l-Lactate Using Phenylboronic Acid Monolayer-Modified Electrodes[J].Electroanalysis,2008,20 (7):816-818.
[5]Park J Y,Chang B Y,Park N H,et al.Selective Electrochemical Sensing of GlycatedHemoglobin (HbA1c)on Thiophene-3-Boronic Acid Self-Assembled Monolayer Covered Gold Electrodes[J].Anal.Chem.,2008,80 (21):8035-8044.
[6]Rick J,Chou T C.Amperometric protein sensor-fabricated as a polypyrrole,poly-aminophenylboronic acid bilayer[J].Biosensors and Bioelectronics,2006,22 (3):329-335.
[7]Abad J M,Velez M,Santamarla C,et al.Immobilization of Peroxidase Glycoprotein on Gold Electrodes Modified with Mixed Epoxy-Boronic Acid Monolayers[J].J.Am.Chem.Soc.,2002,124 (43):12845-12853.
[8]Zayats M,Katz E,Willner I.Electrical Contacting of Flavoenzymes and NAD (P)+-Dependent Enzymes by Reconstitution and Affinity Interactions on Phenylboronic Acid Monolayers Associated with Au-Electrodes[J].J.Am.Chem.Soc.,2002,124 (49):14724-14735.
[9]Zayats M,Katz E,Willner I.Electrical Contacting of Glucose Oxidase by Surface-Reconstitution of the Apo-Protein on a Relay-Boronic Acid-FAD Cofactor Monolayer[J].J.Am.Chem.Soc.,2002,124(10):2120-2121.
[10]Shoji E,Freund M S.Potentiometric Saccharide Detection Based on the pKa Changes of Poly (aniline boronic acid)[J].J.Am.Chem.Soc.,2002,124 (42):12486-12493.
[11]Deore B A,Yu I,Woodmass J,et al.Conducting Poly(anilineboronic acid) Nanostructures:Controlled Synthesis and Characterization[J].Macromolecular Chemistry and Physics,2008 (209):1094-1105.
[12]Conklin J A,Huang S C,Huang S M,et al.Thermal Properties of Polyaniline and Poly (aniline-co-o-ethylaniline)[J].Macromolecules,1995,28 (19):6522-6527.
[13]Liu W,Kumar J,Tripathy S,et al.Enzymatically Synthesized Conducting Polyaniline[J].J.Am.Chem.Soc.,1999,121 (1):71-78.
[14]Dordick J S.Enzymatic catalysis in monophasic organic solvents[J].Enzyme and Microbial Technology,1989,11 (4):194-211.
[15]Kobayashi S,Uyama H,Kimura S.Enzymatic Polymerization[J].Chem.Rev.,2001,101 (12):3793-3818.
[16]Kobayashi S,Makino A.Enzymatic Polymer Synthesis:An Opportunity for Green Polymer Chemistry[J].Chem.Rev.,2009,109:5288-5353.
[17]Kim S C,Huh P,Kumar J,et al.Synthesis of polyaniline derivatives via biocatalysis[J].Green Chemistry,2007 (9):44-48.
[18]Cholli A L,Thiyagarajan M,Kumar J,et al.Biocatalytic approaches for synthesis of conducting polyaniline nanoparticles[J].Pure and Applied Chemistry,2005,77 (1):339-344.
[19]Trakhtenberg S,Hangun-Balkir Y,Warner J C.et al.Photo-cross-linked Immobilization of Polyelectrolytes for Enzymatic Construction of Conductive Nanocomposites[J].J.Am.Chem.Soc.,2005,127 (25):9100-9104.
[20]Aizawa M,Wang L,Shinohara H,et al.Enzymatic synthesis of polyaniline film using a copper-containing oxidoreductase:bilirubin oxidase[J].Journal of Biotechnology,1990,14 (3-4):301-310.
[21]Kausaite A,Ramanaviciene A,Ramanavicius A.Polyaniline synthesis catalysed by glucose oxidase[J].Polymer,2009,50 (8):1846-1851.
[22]Hu X,Shu X S,Li X W,et al.Hemoglobin-biocatalyzed synthesis of conducting polyaniline in micellar solutions[J].Enzyme and Microbial Technology,2006,38 (5):675-682.
[23]Zhou Y K,He B L,Zhou W J,et al.Electrochemical capacitance of well-coated single-walled carbon nanotube with polyaniline composites[J].Electrochimica Acta,2004,49 (2):257-262.
[24]Bekyarova E,Davis M,Burch T,et al.Chemically Functionalized Single-Walled Carbon Nanotubes as Ammonia Sensors[J].J.Phys.Chem.B,2004,108 (51):19717-19720.
[25]Qiao Y,Li C M,Bao S J,et al.Carbon nanotube/polyaniline composite as anode material for microbial fuel cells[J].Journal of Power Sources,2007,170 (1):79-84.
[26]Tu X M,Xie Q J,Yao S Z.Electrochemical quartz crystal impedance study on the overoxidation of polypyrrole-carbon nanotubes composite film for amperometric detection of dopamine[J].Biosensors and Bioelectronics,2007,22 (12):2819-2826.
[27]Zengin H.Zhou W,Jin J,et al.Carbon Nanotube Doped Polyaniline[J].Advanced Materials,2002,14(20):1480-1483.
[28]Dai L and Mau A W H.Controlled Synthesis and Modification of Carbon Nanotubes and C60:Carbon Nanostructures for Advanced Polymeric Composite Materials[J].Advanced Materials,2001,13 (12-13):899-913.
