鸭儿芹体外抗氧化作用研究
2015-12-03皮建辉
文 婷,阮 洁,皮建辉,3,谭 娟,3
(1.怀化学院 生命科学系,湖南 怀化 418008;2.贵州师范大学 生命科学学院,贵州 贵阳 550001;3.怀化学院 民族药用植物资源研究与利用湖南省重点实验室,湖南 怀化 418008)
活性氧(ROS)自由基是机体正常代谢过程中产生的中间产物,在生物体衰老与疾病以及正常的免疫、代谢与细胞信号传导等过程中都有着重要的生理作用[1].当机体内自由基过多时会造成DNA、蛋白质和脂质膜的破坏[2],从而导致癌症、动脉硬化、衰老和多种疾病[3,4]的发生,因此寻找能够清除自由基的抗氧化剂,研究其抗氧化活性与机理显得十分重要.鸭儿芹(Cryptotaenia japonica Hassk)别名三叶芹、鸭脚板,属伞形科鸭儿芹属多年生的药食两用草本植物,富含多种维生素、矿物质及生物活性成分,通常生于海拔200~2 400 m的山地、山沟及林下较阴湿的地区,研究发现鸭儿芹具有抗氧化、抗癌症、保肝护肝、降血脂等作用[5],本项目通过筋骨草体外抗氧化作用研究,进一步探讨筋骨草的保健功能.
1 材料与方法
1.1 材料与仪器
采集新鲜的鸭儿芹清洗干净并放在阴凉处使其风干.将干燥的鸭儿芹植株粉碎过100目筛,取粉末40 g 用80℃蒸馏水800 mL 浸提3小时,重复三次.将浸提液过滤后旋转蒸发浓缩,将浓缩液真空干燥得鸭儿芹水提取物粉末,密封于-20℃冰箱备用.
试验动物为三月龄KM 小鼠,购自中南大学实验动物中心,许可证号:SCXK (湘)2010-0001.小鼠禁食过夜后脱颈椎处死,迅速取出肝脏,置于预冷生理盐水中冲洗后,冰上研磨制成5%组织匀浆.
DPPH (北京中生瑞泰);邻二氮菲(天津恒兴);自由基测试盒(南京建成);三氯乙酸、硫代巴比妥酸(上海宏瑞);其他试剂均为湖南化工研究所产品.
主要仪器:DU800 紫外P可见分光光度计(美国Beckman公司)、OSB-2000、DTC-21旋转蒸发仪(美国)、FD-1C 冷冻真空干燥机 (北京德天佑公司)、FW177 材料粉碎机(天津市泰斯特仪器有限公司)、恒温水浴锅(武汉琴台医疗器械厂).
1.2 方法
1.2.1 鸭儿芹对DPPH 自由基的清除
分别配制浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mg/mL的鸭儿芹提取物样品溶液1 mL,加入0.05 mg/mL DPPH 无水乙醇溶液2 mL,混合后避光静置30 min,然后于517 nm 处测量吸光值(At),同时测定等体积无水乙醇和对应梯度浓度样品的混合液吸光值(Aj)、等体积无水乙醇和DPPH 溶液混合液的吸光值(Ai)和等体积无水乙醇的吸光值(A0),计算DPPH·自由基清除率(%) =[1-(At-Aj)/(Ai-A0)]×100.
分别配制鸭儿芹提取物样品梯度浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0 mg/mL,采用南京建成生物工程研究所的抗超氧阴离子自由基及产生超氧阴离子自由基测试盒检测.试验按照说明进行,采用蒸馏水作空白,计算O-2·自由基清除率 (%)=[(A0-At)/A0]×100.其中A0为对照管的吸光度,At为样品管的吸光值.
1.2.3 鸭儿芹对·OH 自由基的清除
分别配制浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0 mg/mL的鸭儿芹提取物样品溶液1 mL,加入0.15 mol/L 磷酸盐缓冲液2.0 mL、0.75 mmol/L邻二氮菲溶液1.0 mL、0.75 mmol/L 硫酸亚铁溶液1.0 mL,最后加入2%过氧化氢1 mL,混匀后放置30 min.空白是以蒸馏水代替样品溶液,对照组是以蒸馏水代样品和硫酸亚铁,于波长520 nm 处测吸光度值,计算·OH 自由基的清除率(%) =[(A0-At)/A0]×100.其中A0为对照管的吸光度,At为样品管的吸光值.
1.2.4 鸭儿芹对小鼠肝脏自发性脂质过氧化的抑制
分别配制浓度为0.5、1.5、2.5、3.5、4.5、5.5、6.5、7.5、8.5 mg/mL的鸭儿芹提取物样品溶液0.5 mL (对照管用生理盐水代替),加入现制的5%肝脏组织匀浆1.5 mL,混匀后37℃水浴中震荡温育120 min后,再加入1.5 mL 20%三氯乙酸终止反应,3 500 rpm离心10 min,取上清液2.0 mL.各上清液加入1.5 mL 0.67%硫代巴比妥酸,95℃水浴15 min 显色后取出冷却至室温,测定其在532 nm 处的吸光值,计算MDA生成抑制率(%) =[(A0-At)/A0]×100.其中A0为对照管的吸光度,At为样品管的吸光值.
1.2.5 鸭儿芹对Fe2+-VitC 诱导肝脏线粒体氧化损伤的抑制
制备肝脏线粒体悬浮液[6].分别取浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mg/mL的鸭儿芹提取物样品溶液0.4 mL (空白管、对照管用生理盐水代替),向各样品溶液中加入1.0 mL 线粒体悬浮液.其中样品管、对照管同时再加入0.4 mL 硫酸亚铁溶液(0.5 mmol/L)和0.4 mL VitC 溶液(0.5 mmol/L),空白管加入0.8 mL 生理盐水.振荡混匀后于37℃温育30 min,测其在520 nm 处吸光值,并计算线粒体肿胀度(%) =[(A0-At)/A0]×100%.其中A0、At分别是空白管和样品管或对照管的吸光值.
2 结果
2.1 鸭儿芹对DPPH·自由基的清除作用
DPPH·是一种稳定的自由基,其乙醇溶液呈深紫色并在517 nm 处有最大吸收峰.自由基清除剂可使其颜色变浅,所以可通过吸光值的降低来反映自由基清除剂样品对DPPH·的清除能力.图1显示,鸭儿芹提取物对DPPH·自由基的清除作用具有明显的量效关系,其IC50为5.48 mg/mL,且当提取物浓度达到9 mg/mL 时,其对DPPH·自由基的清除率达到最大85.4%.

图1 鸭儿芹对DPPH·自由基的清除作用
2.2 鸭儿芹对·自由基的清除作用
2.3 鸭儿芹对·OH 自由基的清除作用
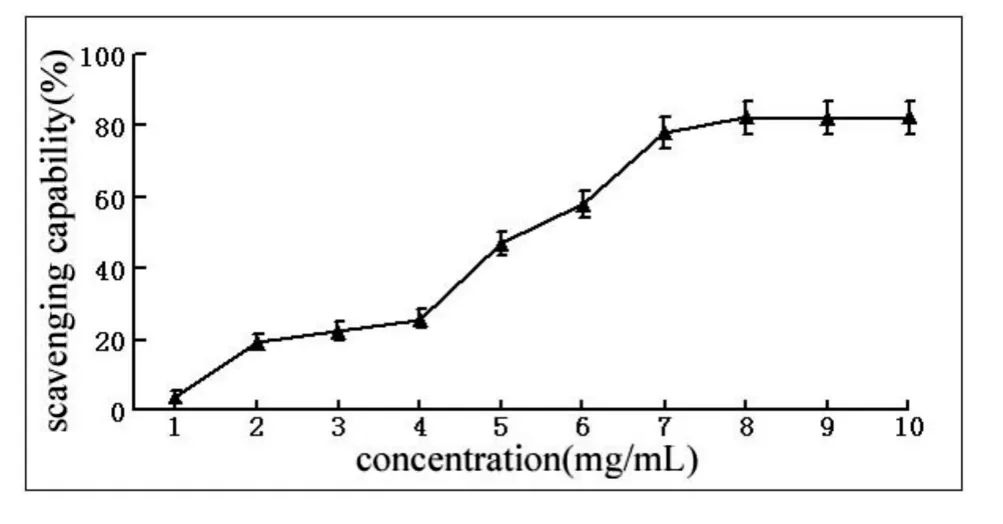
图2 鸭儿芹对O -2·自由基的清除作用
·OH 自由基的氧化性质十分活跃,对机体的生物膜等具有极强的破坏性,具有作用最强、毒性最大等特点.图3显示,鸭儿芹提取物对·OH 自由基的清除作用较强,一定浓度范围内呈现明显的量效关系,其IC50为2.78 mg/mL,特别是在鸭儿芹提取物质量浓度2.0~5.0 mg/mL之间,清除率增加极明显,当鸭儿芹提取物质量浓度为6 mg/mL,其对·OH 自由基的清除率达到最大94.2%.
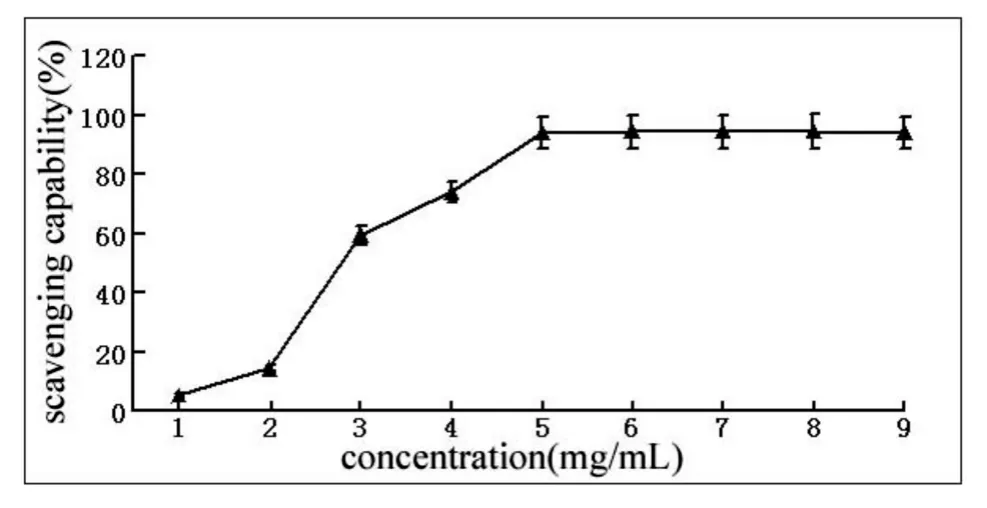
图3 鸭儿芹对·OH 自由基的清除作用
2.4 鸭儿芹对肝细胞膜自发脂质过氧化的抑制作用
鸭儿芹提取物对小鼠肝脏自发脂质过氧化反应的抑制作用如图4,显示一定浓度范围内,鸭儿芹提取物对小鼠肝脏自发脂质过氧化的抑制作用呈现出明显的量效关系,其IC50为2.86 mg/mL.当鸭儿芹提取物质量浓度达到4.5 mg/mL 时,抑制率已接近最大抑制率86.8%.
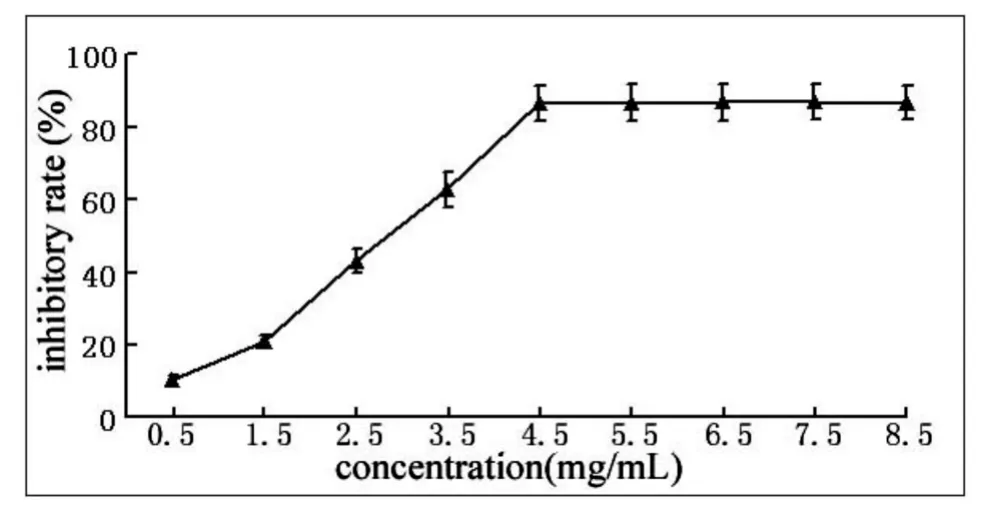
图4 鸭儿芹对肝细胞膜自发脂质过氧化的抑制作用
2.5 鸭儿芹对Fe2+-VitC 诱导的肝脏线粒体氧化损伤的抑制作用
表1和图5显示,鸭儿芹提取物能抑制Fe2+-VitC 诱导肝线粒体氧化损伤.随着鸭儿芹提取物质量浓度的增加,反应体系的吸光值OD520nm递增,线粒体氧化损伤所致肿胀度明显下降,并呈现显著的量效关系.当鸭儿芹提取物质量浓度达到5.0 mg/mL 时,鸭儿芹提取物抗小鼠肝脏线粒体氧化损伤接近最佳效果
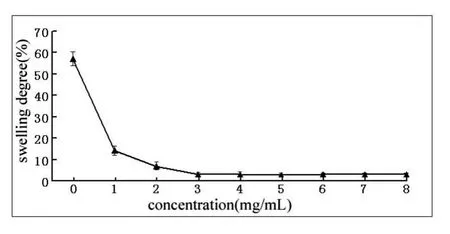
图5 鸭儿芹对Fe2+-VitC 诱导的肝脏线粒体氧化损伤的抑制作用
3 讨论
自由基是游离存在的具有非偶电子的基团或原子,在体内有很强的氧化反应能力,易对蛋白质、脂质和核酸等产生伤害,从而引起机体损伤[7].人类食物中有多种抗氧化物质,它们能够清除自由基,并能以消除过氧化氢、清除超氧阴离子和单态氧的方式抑制自由基的形成[8].鸭儿芹含有丰富的挥发性成分与其他生物活性物质[9],本研究结果表明鸭儿芹提取物对DPPH·、·、·OH 这3种自由基均表现出显著的清除效果,其最大清除率分别达到85.4%、82.4%和94.2%,其IC50分别为5.48、4.23和2.78 mg/mL,表明鸭儿芹提取物具有较强的清除自由基的活性功能,特别是对·OH的清除能力尤为突出.
生物膜的完整性是细胞维持正常生理功能的必要条件,然而生物膜脂质过氧化作用能氧化分解膜中多元不饱和脂肪酸而产生MDA,从而使膜的通透性增大,影响膜的正常生理功能[10-11].本研究结果表明,鸭儿芹提取物能明显抑制体外生物膜脂质过氧化作用,在一定范围内呈现明显的量效关系.鸭儿芹提取物的对生物膜脂质过氧化反应的抑制作用不但表现在生物膜的自发性脂质过氧化,而且还表现在由Fe2+-VitC诱导的肝脏线粒体膜的脂质过氧化,表明鸭儿芹提取物对生物膜的脂质过氧化具有广泛的抑制作用.
通过鸭儿芹提取物的体外抗氧化作用研究,表明鸭儿芹是一种良好的天然抗氧化剂的优势资源,也为进一步研究其体内生理活性提供了理论基础.
[1]ìlhami Gücιn,Münιr Oktay,Ekrem kirecci,et al.Screening of antioxidant and antimicrobial activities of anise(Pimpinella anisum L.) seed extracts[J].Food Chem.,2003 (83):371-382.
[2]Devasagayam TPA.Free Radicals and Antioxidants inHuman Health Foreword[J].Indian J Biochem Bio,2009 (46):5.
[3]Dong FL,Xia GY,Xiong ZK.Antioxidative activity of Ganoderma lucidum polysaccharide[J].J Tradit Med Information,2010,2 (2):24-24.
[4]张志军,李淑芳,魏雪生,等.灵芝多糖体外抗氧化活性的研究[J].化学与生物工程,2011,28 (3):63-66.
[5]焦维丽,赵兵,高昂,等.鸭儿芹药学研究概况[J].安徽农业科学,2011,39 (34):20996-20997.
[6]李静娟,刘雨生,童先宏.酶检测法在线粒体功能及混杂程度评价中的应用[J].临床输血与检验,2004,6(3):167-168.
[7]李勇,孔令青,高洪,等.自由基与疾病研究进展[J].动物医学进展,2008,29 (4):85-88.
[8]Guptam,Mazumder UK,Gomathi P.In vitro antioxidant and free radical scavenging activities of Galega purpurea root[J].Pharmacognosy Magazine,2007,3 (12):219-223.
[9]李胜华,牛友芽.鸭儿芹的化学成分研究[J].中草药,2012,43 (12):2365-2368.
[10]冯芹,夏文凯,王现珍,等.连翘苷元对四氯化碳大鼠急性肝损伤的保护作用[J].中国药理学通报,2015,31 (3):426-430.
[11]罗慧英,黄亚红,朱丽娟,等.藏药蕨麻对实验性酒精肝损伤小鼠的保护作用研究[J].中国临床药品理学与治疗学,2014,19 (10):1107-1110.
