水抽提物对稀酸预处理玉米秸秆酶水解的影响
2015-12-03荣亚运仲如霞朱均均余世袁
荣亚运,仲如霞,朱均均,2*,姚 瑶,徐 勇,2,勇 强,余世袁,2
水抽提物对稀酸预处理玉米秸秆酶水解的影响
荣亚运1,仲如霞1,朱均均1,2*,姚 瑶1,徐 勇1,2,勇 强1,余世袁1,2
(1. 南京林业大学 化学工程学院,江苏 南京 210037;2. 江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
采用水抽提方法得到玉米秸秆中的水抽提液,研究水抽提液、水抽提液的稀酸水解液对水抽提玉米秸秆和稀酸预处理的水抽提玉米秸秆酶水解性能的影响。研究结果表明,与未处理玉米秸秆相比,水抽提玉米秸秆的酶水解性能有所提高,从48 h的9.88%提高到23.56%;与稀酸预处理玉米秸秆相比,稀酸预处理的水抽提玉米秸秆酶水解性能略有提高,从48 h的67.07%提高到73.44%;通过向水抽提玉米秸秆和稀酸预处理的水抽提玉米秸秆中添加水抽提液的酶水解结果表明,与未添加的空白样相比,添加水抽提液对酶水解得率的影响极小(2%以内),但水抽提液经过稀酸水解后再添加到水抽提玉米秸秆和稀酸预处理的水抽提玉米秸秆中,可以发现与未添加的空白样相比,酶水解得率大幅度降低,酶解48 h时分别下降了15.03%和13.96%,这说明水抽提液在稀酸预处理过程中产生了对酶水解有抑制作用的物质。因此,通过水抽提去除部分水抽提物可减少稀酸预处理过程中抑制物的产生,从而提高酶水解得率的能力。
水抽提物;玉米秸秆;稀酸预处理;抑制物;酶水解
随着全球能源和粮食短缺危机以及环境污染日益严重,利用丰富的、可再生的木质纤维原料生物转化制取生物质液体燃料(燃料乙醇、生物丁醇、生物柴油、碳氢燃料等)是当今世界各国研究开发的热点之一。通过转酯化和发酵生产的生物柴油和燃料乙醇主导目前的生物燃料市场[1-2]。而以木质纤维原料生产碳氢燃料是未来的发展方向,可以通过微生物发酵直接获得[3-4]或者利用微生物发酵生产油脂后再通过加氢脱氧―裂化异构两段加氢获得[5-6]。然而,不管以木质纤维原料生产燃料乙醇或者生产油脂进而转化为生物柴油或者碳氢燃料,均要涉及到木质纤维原料的预处理、酶水解和糖液发酵等关键技术[7],尤其在第一步预处理过程中,不可避免地产生抑制物,主要包括两大类:一是碳水化合物降解产物,如甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛、糠醛;二是木质素降解产物,如4-羟基苯甲醛、香草醛、紫丁香醛、4-羟基苯甲酸、香草酸、紫丁香酸、3,4-二羟基苯甲酸、对香豆酸、阿魏酸等。这些抑制物严重影响了微生物细胞的生长和发酵性能。因此,对这些抑制物的脱毒以及筛选能够耐受这些抑制物的微生物是降低木质纤维制取生物质液体燃料成本的基本手段[8-10]。由于玉米秸秆中含有叶子,因此其提取物含量高,本研究通过水抽提的方法提取水抽提物,借助经典的稀硫酸预处理技术对水抽提物进行稀酸水解以及玉米秸秆和水抽提玉米秸秆进行稀酸预处理,研究水抽提液、水抽提液的稀酸水解液对水抽提玉米秸秆和稀酸预处理的水抽提玉米秸秆酶水解性能的影响。因此通过本文的研究,可以揭示水抽提物对酶水解的影响,为减少抑制物的产生、提高酶水解得率提供参考依据。
1 实验
1.1 玉米秸秆
玉米秸秆来源于内蒙古呼和浩特市,经粉碎至0.2~0.4 mm后储存备用。
1.2 玉米秸秆水抽提液的制备
称取相当于50 g绝干的玉米秸秆于1 L三角瓶中,加入固液比(g/mL,下同)1∶10的蒸馏水,搅拌均匀浸泡一定时间后,在121℃的高压灭菌锅中反应60 min,取出,于冷水中冷却至室温,抽滤后得到的滤液即为水抽提液,收集备用;而抽滤后得到的固体渣用水洗至中性后,称为水抽提玉米秸秆,收集备用[11]。
1.3 玉米秸秆/水抽提玉米秸秆稀酸预处理
称取相当于3.5 g绝干玉米秸秆/水抽提玉米秸秆于自制的不锈钢反应器(容积为35 mL)中,按固液比为1∶10、最终浓度为0.75%的稀硫酸溶液浸泡12 h后,置于150℃的油浴锅中保温30 min。反应结束后,立即取出反应器,置于冷水中骤冷,采用G1玻砂抽滤后的固体渣,按固液比为1∶5(以起始原料为基准)、60℃左右的水充分洗涤、抽滤3次后合并滤液,即为玉米秸秆/水抽提玉米秸秆的稀酸预水解液,备用[12];洗涤后得到的固体渣,收集备用。
1.4 玉米秸秆水抽提液稀硫酸水解
称取一定质量的水抽提液于自制的35 mL不锈钢反应器中,加入一定质量的浓硫酸,使其最终浓度为0.75%,混匀后置于150℃的油浴锅中保温30 min,反应结束后,立即取出反应器,置于冷水中骤冷,采用G1玻砂抽滤后得到的滤液,即为玉米秸秆水抽提液的稀酸水解液,收集备用[13]。
1.5 酶制剂
纤维素酶(C2730):来自Trichoderma reesei ATCC 26921,丹麦诺维信(Novozyme)生产,Sigma公司提供。β-葡萄糖苷酶(C6105):来自Aspergillus niger,丹麦诺维信(Novozyme)生产,Sigma公司提供。
1.6 纤维素酶水解
在50 mL的三角瓶中,加入相当于2.0 g绝干的物料,再加入2 mL的l moL/L的柠檬酸缓冲溶液(稀释20倍后pH值为4.8),按30 FPU/g(以纤维素计,下同)的用量加入纤维素酶,10 IU/g的用量加入β-葡萄糖苷酶,40 mL酶解体系,充分搅拌均匀后封住瓶口,在50℃、150 r/min摇床中酶解48、72 h。酶解结束后样品于10 000 r/min下离心5 min,取上清液测定纤维二糖和葡萄糖的浓度。
纤维素酶水解得率的计算公式如式(1)所示。

1.7 分析方法
1.7.1 原料分析
原料中纤维素、半纤维素和木质素含量的分析按美国能源部可再生能源实验室(NREL)的方法测定[13]。
1.7.2 水分测定
原料中水分含量的测定采用红外水分测定仪进行测定。
1.7.3 糖、抑制物含量的测定
糖(纤维二糖、葡萄糖、木糖和阿拉伯糖)、抑制物(甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛和糠醛)含量的测定采用高效液相色谱仪(美国Agilent 1260型)进行测定,外标法定量[14]。分析条件如下:色谱柱为Bio-Rad HPX-87H柱(7.8 mm × 300 mm),柱温为55℃,流动相为5 mmol/L的硫酸,流速为0.6 mL/min,上样量为10 μL,检测器为示差折光检测器。
2 结果与讨论
2.1 原料成分分析
玉米秸秆、水抽提后得到的玉米秸秆以及分别经过稀酸预处理(固液比1∶10,硫酸浓度0.75%,温度150℃,时间30 min)后得到的固体渣,采用NREL法对其组成成分进行分析,其结果如表1所示。

表1 玉米秸秆处理前后主要成分
从表1可以看出,与未处理的玉米秸秆相比,玉米秸秆经固液比1∶10、121℃、60 min水抽提后,纤维素的含量略有上升,这说明在水抽提过程中,有部分可溶性物质(无机盐、木质素和少量可溶性糖类)溶出,而对半纤维和木质素含量的变化影响不大。玉米秸秆和水抽提玉米秸秆分别经过稀酸预处理后,半纤维素含量下降幅度很大,分别下降到6.90%和5.92%,这说明在稀酸预处理过程中,绝大部分半纤维素被降解为可溶性糖类溶解出来,从而提高纤维素酶对纤维素的可及度[15];纤维素的相对含量均大幅度提高,分别提高到53.01%和58.59%,这是由于半纤维素脱除的效果;而木质素的含量相对有所增加。此外通过比较稀酸预处理玉米秸秆和稀酸预处理的水抽提玉米秸秆成分可以看出,经过水抽提后的玉米秸秆,其纤维素含量相对较高,半纤维素和木质素含量相对低一些,这都说明玉米秸秆经过水抽提去除部分可溶物质后有利于稀酸预处理,从而提高其纤维素的含量。
2.2 水抽提液、玉米秸秆和水抽提玉米秸秆稀酸预处理后滤液成分分析
水抽提液、玉米秸秆和水抽提玉米秸秆经过稀酸预处理(固液比1∶10,硫酸浓度0.75%,温度150℃,时间30 min)前后得到的滤液,采用HPLC测定其中的糖及抑制物浓度,结果如表2所示。

表2 水抽提液、玉米秸秆和水抽提玉米秸秆稀酸预处理后滤液成分分析
续表2
从表2中可以看出, 玉米秸秆经过水抽提后得到的水抽提液中含有四种糖类,木糖含量最高,为0.92 g/L,阿拉伯糖浓度最低,仅为0.06 g/L;主要含有的抑制物为甲酸、乙酸和5-羟甲基糠醛,这说明在热水抽提过程中也促使了抑制物的产生。通过对水抽提液进行稀酸水解后,可以发现糖类中的纤维二糖浓度降为0,这说明稀酸促进纤维二糖水解为葡萄糖。通过计算,理论上0.33 g/L的纤维二糖仅能产生0.37 g/L葡萄糖,而水抽提液的稀酸水解液与水抽提液中葡萄糖浓度差为0.46 g/L,可能还有部分葡萄糖会降解为5-羟甲基糠醛、甲酸和乙酰丙酸[16],因此在玉米秸秆水抽提液可能还有部分可溶性纤维低聚糖。此外,在水抽提液稀酸水解液中,五种抑制物的浓度均有不同程度的增加,这说明在稀酸预处理过程中,促使了葡萄糖、木糖的降解以及进一步降解[17]。通过对玉米秸秆和水抽提玉米秸秆稀酸预处理后的预水解液中的糖成分进行比较后发现,木糖含量最高,这是因为稀酸能够水解半纤维素;而抑制物浓度中,乙酸浓度相当,玉米秸秆稀酸预水解液中5-羟甲基糠醛浓度大于水抽提玉米秸秆的稀酸预水解液中的5-羟甲基糠醛,糠醛浓度关系则相反。
2.3 玉米秸秆稀酸预处理前后酶水解性能
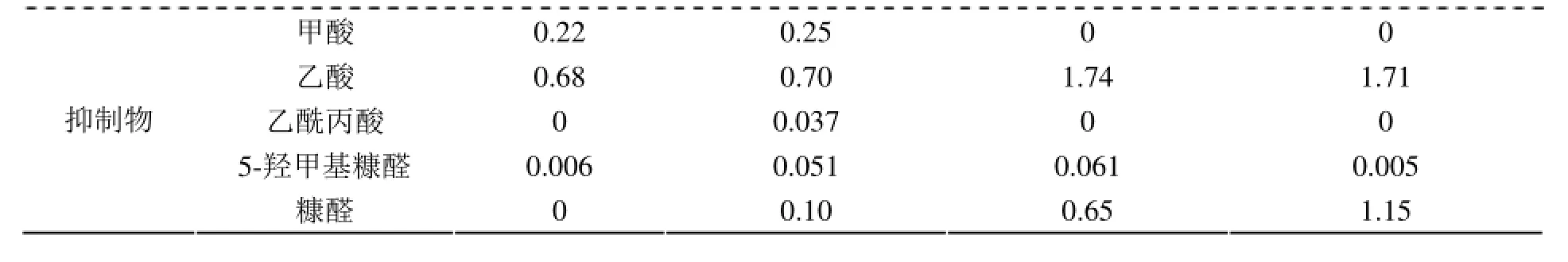
在50 mL三角瓶中,分别加入一定质量的玉米秸秆、稀酸预处理玉米秸秆,在底物浓度为5%(w/V)、pH4.8、温度50℃、摇床转速150 r/min、纤维素酶用量30 FPU/g、β-葡萄糖苷酶用量10 IU/g的条件下酶水解48、72 h,分别取样,灭活、离心后的上清液采用HPLC分析其中糖的浓度,并计算其酶水解得率,结果如图1所示。从图1可以看出,未经处理的玉米秸秆的酶水解得率很低,酶解48 h时仅为9.88%,延长时间至72 h时酶水解得率也仅提高到13.94%,这说明由于木质纤维原料结构比较紧密,不经过预处理打开木质纤维原料的三维空间结构不利于纤维素酶的水解作用[18]。通过研究稀酸预处理玉米秸秆的酶水解性能发现,在酶解48 h时酶水解得率就达到67.07%,酶解72 h时酶水解得率略有提高,达到68.10%,这说明木质纤维原料经过适当预处理后,可以达到提高纤维素酶水解得率的目的[15]。
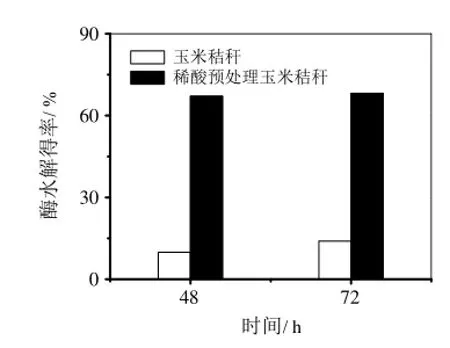
图1 玉米秸秆及稀酸预处理玉米秸秆酶水解性能

图2 水抽提玉米秸秆及稀酸预处理的水抽提玉米秸秆酶水解性能
2.4 水抽提玉米秸秆稀酸预处理前后酶水解性能
在50 mL三角瓶中,分别加入一定质量的水抽提玉米秸秆、稀酸预处理的水抽提玉米秸秆,在与“2.3”相同条件下酶水解48、72 h,分别取样,灭活、离心后的上清液采用HPLC分析其中糖的浓度,并计算其酶水解得率,结果如图2所示。
从图2可以看出,玉米秸秆经过水抽提后,酶解48 h的酶水解得率达到23.56%,延长酶解时间至72 h对酶水解得率的提高影响不大。与未经处理的玉米秸秆酶水解得率相比,酶解48 h的酶水解得率提高了138.46%,这说明通过水抽提也能提高酶水解得率。对比稀酸预处理玉米秸秆也可以发现,稀酸预处理的水抽提玉米秸秆的酶水解得率也有所提高(48 h时73.44%)。因此,水抽提后的玉米秸秆进一步采用稀酸预处理,有利于提高纤维素酶水解得率。
2.5 水抽提液及其稀酸水解液对水抽提玉米秸秆酶水解性能的影响
在50 mL三角瓶中,分别加入一定质量的水抽提玉米秸秆、一定体积的水抽提液或水抽提液稀酸水解液,在与“2.3”相同条件下酶水解48、72 h,分别取样,灭活、离心后的上清液采用HPLC分析其中糖的浓度,并计算其酶水解得率,结果如图3所示。
从图3可以看出,向水抽提玉米秸秆中加入水抽提液后,其酶水解得率与未添加的相比较略有降低,但下降幅度不大,这说明水抽提液中不含或者含有很少对酶水解有抑制作用的物质。当水抽提玉米秸秆中加入水抽提液稀酸水解液后,可以发现酶水解得率大幅度降低,分别下降到48 h的8.53%和72 h的9.07%,分别下降了15.03%和15.14%。这说明水抽提液中的物质经过稀酸预处理后产生了对酶水解有抑制作用的物质,从表2中抑制物浓度的增加也可以看出。因此,通过水抽提去除部分物质将会减少后续抑制物的产生对酶水解的影响。
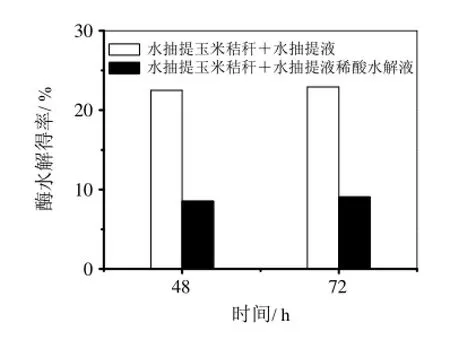
图3 水抽提玉米秸秆中添加水抽提液及其稀酸水解液后酶水解性能

图4 稀酸预处理水抽提玉米秸秆中添加水抽提液及其稀酸水解液后酶水解性能
2.6 水抽提液及其稀酸水解液对稀酸预处理水抽提玉米秸秆酶水解性能的影响
在50 mL三角瓶中,分别加入一定质量的稀酸预处理水抽提玉米秸秆、一定体积的水抽提液或水抽提液稀酸水解液,在与“2.3”相同条件下酶水解48、72 h,分别取样,灭活、离心后的上清液采用HPLC分析其中糖的浓度,并计算其酶水解得率,结果如图4所示。
从图4可以看出,向稀酸预处理水抽提玉米秸秆添加水抽提液后,其酶水解得率与未添加的相比较略有降低或变化不大,而当水抽提玉米秸秆中加入水抽提液稀酸水解液后,可以发现酶水解得率大幅度降低,分别下降到48 h的59.48%和72 h的62.83%,分别下降了13.96%和11.21%。这说明水抽提液中的物质经过稀酸预处理后产生了对酶水解有抑制作用的物质,因此,通过水抽提去除部分水抽提物可减少稀酸预处理过程中抑制物的产生,从而提高酶水解得率的能力。
3 结论
本文主要研究了玉米秸秆水抽提液对稀酸预处理玉米秸秆酶水解的影响,研究结果表明,玉米秸秆经过水抽提后,可部分抽提出可溶性低聚糖和抑制物。添加水抽提液对水抽提玉米秸秆和稀酸预处理的水抽提玉米秸秆的酶水解性能影响不大,但添加水抽提液的稀酸水解液对水抽提玉米秸秆和稀酸预处理水抽提玉米秸秆的酶水解性能产生较大影响,酶水解得率下降了11%~15%之间,这说明在稀酸预处理过程中,抽提出的水抽提物可产生对酶水解有抑制作用的物质,降低了纤维素酶水解得率。
[1] Serrano-Ruiz J C, Ramos-Fernández E V, Sepúlveda-Escribano A. From biodiesel and bioethanol to liquid hydrocarbon fuels: New hydrotreating and advanced microbial technologies[J]. Energy & Environmental Science, 2012, 5(2): 5638-5652.
[2] Gnansounou E, Dauriat A. Techno-economic analysis of lignocellulosic ethanol: A review[J]. Bioresource Technology, 2010, 101(13): 4980-4991.
[3] Davis R, Biddy M, Tan E, et al. Biological conversion of sugars to hydrocarbons technology pathway[R]. Prepared for the U.S. Department of Energy Bioenergy Technologies Office, 2013.
[4] Sinha M, Sørensen A, Ahamed A, et al. Production of hydrocarbons by Aspergillus carbonarius ITEM 5010[J]. Fungal Biology, 2015, 119(4): 274-282.
[5] Collett J R, Meyer A, Jones S. Preliminary economics for hydrocarbon fuel production from cellulosic sugars[R]. PNNL-23374, Pacific Northwest National Laboratory, Richland, WA, 2014.
[6] 李宇萍, 章青, 王铁军, 等. 第二代生物航空燃油的关键技术分析和进展动态[J]. 林产化学与工业, 2014, 34(5): 162-168.
[7] Talebnia F, Karakashev D, Angelidaki I. Production of bioethanol from wheat straw: an overview on pretreatment, hydrolysis and fermentation[J]. Bioresource Technology, 2010, 101(13): 4744-4753.
[8] Palmqvist E, Hahn-hägerdal B. Fermentation of lignocellulosic hydrolysates. Ⅱ: Inhibitors and mechanisms of inhibition[J]. Bioresource Technology, 2000, 74(1): 25-33.
[9] Klinke H B, Thomsen A B, Ahring B K. Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass[J]. Applied Microbiology and Biotechnology, 2004, 66(1): 10-26.
[10] Almeida J R M, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae[J]. Journal of Chemical Technology and Biotechnology, 2007, 82(4): 340-349.
[11] Ballesteros I, Ballesteros M, Cara C, et al. Effect of water extraction on sugars recovery from steam exploded olive tree pruning[J]. Bioresource Technology, 2011, 102(11): 6611-6616.
[12] 陈尚钘, 勇强, 徐勇, 等. 玉米秸秆稀酸预处理的研究[J]. 林产化学与工业, 2009, 29(2): 27-32.
[13] Sluiter A, Hames B, Scarlata C, et al. DE-AC36-08GO28308-2008, Determination of structural carbohydrates and lignin in biomass[S]. United States: National Renewable Energy Laboratory Golden, CO, 2008.
[14] Zhu J, Yang J, Zhu Y, et al. Cause analysis of the effects of acid-catalyzed steam-exploded corn stover prehydrolyzate on ethanol fermentation by Pichia stipitis CBS 5776[J]. Bioprocess and Biosystems Engineering, 2014, 37(11),2215-2222.
[15] Öhgren K, Bura R, Saddler J, et al. Effect of hemicellulose and lignin removal on enzymatic hydrolysis of steam pretreated corn stover[J]. Bioresource Technology, 2007, 98(13): 2503-2510.
[16] Jönsson L J, Alriksson B, Nilvebrant N O. Bioconversion of lignocellulose: Inhibitors and detoxification[J]. Biotechnology for Biofuels, 2013, 6: 16.
[17] Zhu J, Yong Q, Xu Y, et al. Detoxification of corn stover prehydrolyzate by trialkylamine extraction to improve the ethanol production with Pichia stipitis CBS5776[J]. Bioresoure Technology, 2011, 102(2): 1663-1668.
[18] 亓伟, 王闻, 王琼, 等. 木质纤维素预处理技术及其机理研究进展[J]. 新能源进展, 2013, 1(2): 150-158.
Effect of Water Extractives on Enzymatic Hydrolysis of Dilute Sulfuric Acid Pretreated Corn Stover
RONG Ya-yun1, ZHONG Ru-xia1, ZHU Jun-jun1,2,*, YAO Yao1, XU Yong1,2, YONG Qiang1, YU Shi-yuan1,2
(1. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China; 2. Jiangsu Key Lab of Biomass-based Green Fuel and Chemicals, Nanjing 210037, China)
Water extracted materials were obtained by water extraction of corn stover. The effects of water extractives and hydrolyzate of water extractives hydrolyzed by dilute acid on enzymatic hydrolysis of water extracted corn stover (WECS) and dilute acid pretreated WECS (DAP-WECS) were investigated. The results showed that the enzymatic hydrolysis yield of WECS was improved from 9.88% to 23.56% at hydrolysis of 48 h, compared with the un-pretreated corn stover. The enzymatic hydrolysis yield of DAP-WECS enhanced a little, from 67.07% to 73.44% at hydrolysis of 48 h, compared with dilute acid pretreated corn stover. When water extractives were added to the WECS and the DAP-WECS, the added water extractive had a little effect on enzymatic hydrolysis yield (below 2%) compared with the control. However, when the hydrolyzate of water extractives hydrolyzed by dilute acid was added to the WECS and the DAP-WECS, it could be found that the enzymatic hydrolysis yield decreased dramatically compared with the control. The enzymatic hydrolysis yields at 48 h were decreased by 15.03% and 13.96%, respectively. This indicated that some inhibition materials were generated during the process of water extractives pretreated by dilute acid. Therefore a part of water extractives removed through water extraction could reduce the inhibitors generation during the dilute acid pretreatment, so as to improve the ability of enzymatic hydrolysis yield.
water extractives; corn stover; dilute sulfuric acid pretreatment; inhibitor; enzymatic hydrolysis
TQ353;Q815
A
1004-8405(2015)03-0008-07
10.16561/j.cnki.xws.2015.03.09
2015-6-11
国家自然科学基金(31100432);“十二五”国家科技支撑计划项目资助(2015BAD15B09);江苏高校优势学科建设工程资助项目;江苏省普通高校研究生科研创新计划资助项目(SJLX15_0405)。
荣亚运(1990~),男,硕士研究生;研究方向:生物工程。1239589924@qq.com
* 通讯作者:朱均均(1979~),男,博士,副教授;研究方向:生物化工。zhujj@njfu.edu.cn
