多杀性巴氏杆菌同源重组质粒电转化条件研究
2015-12-03李国攀长江大学生命科学学院湖北荆州434025
李国攀 (长江大学生命科学学院,湖北 荆州434025)
荣俊 (长江大学生物医药研究所,湖北 荆州434025)
多杀性巴氏杆菌(Pasteurellamultocida,Pm)是一类属于巴氏杆菌科巴氏杆菌属的球杆状或短杆状细菌,革兰氏染色呈阴性,可以引起家禽、猪、兔、羊、牛和人的感染发病,主要表现为禽霍乱、猪萎缩性鼻炎、牛出血性败血症、牛羊地方性流行性肺炎等[1~3]。目前防治巴氏杆菌病主要以抗生素为主,但是抗生素的过度使用,很容易在细菌中出现耐药性,并且对生物体尤其是泌尿系统产生明显的毒副作用[4]。疫苗免疫防治将是未来防控巴氏杆菌病的重要途径,目前研发和使用的相关疫苗主要有:C48-1强毒株灭活疫苗[5],荚膜、外膜蛋白、脂多糖及交叉保护性抗原因子类的亚单位疫苗[6~9],具备治疗作用的免疫复合物疫苗[9],自然筛选或者人工培养弱化的减毒活疫苗[10,11],异源弱毒多价活载体疫苗[12]。随着基因工程技术的发展,人们从分子水平进行细菌部分基因改造,人工缺失某些毒力因子部分片段,使其毒力减弱,构建弱毒活疫苗候选菌株,这是细菌弱毒活疫苗研究的新方向。巴氏杆菌Pm70(GenBank登录号:NC—002663)和36950(GenBank登录号:CP003022)的全基因组序列测定的完成,为深入地解析多杀性巴氏杆菌的遗传演变、生理代谢及致病机制提供了分子基础,同时为新型疫苗的设计和药物靶标的筛选提供依据。
同源重组技术是基因敲除的一种传统技术,由于该技术的整合位点精确,交换频率较高,而被广泛应用。微生物基因敲除的技术要点主要包括基因敲除同源重组载体的构建;载体的转化、同源重组的筛选、突变体的生理和分子生物学的鉴定等几个方面。在微生物中打靶载体的导入通常用的是电穿孔的方法,但是影响电穿孔效率和筛选同源重组转化子的因素较为复杂,不同的细菌、不同的DNA可能需要不同的方法。本研究以构建的打靶质粒pBluescript-F1KanRF2电转化至多杀性巴氏杆菌R473为例,探讨了最优的电转化方案和最合理的筛选方法。
1 材料与方法
1.1 菌种与质粒
菌种为牛源多杀性巴氏杆菌R473,购自中国兽药药品监察所,血清型6:B;同源重组打靶质粒pBluescript-F1KanRF2为长江大学生命科学学院动物科研平台构建,其中,F1和F2为R473aroA基因的上下游同源臂,具有CmR和KanR2种抗生素筛选标记。
1.2 主要试剂与仪器
Eppendorf Multiporator电穿孔仪、1mm电转化杯、Quawell Q5000超微量紫外分光光度计、讯数抑菌圈(抗生素效价)测量仪,美国BD(Becton Dickinson)公司的脑心浸出汁肉汤(BHI)培养基,血清、琼脂粉、硫酸卡那霉素、TAKARA的DNA聚合酶。
1.3 引物
合成1对可特异性检测多杀性巴氏杆菌的引物,扩增产物大小约1300bp。PMP1:5’-TATAAAATTCAAAGTATATC-3’;PMP2:5’-CGCAGTCCACCCTTTTTTA-3’。合成1对可特异检测KanR基因,大小550bp。pUC4KF:5’-GAC TCG TCC AAC ATC AAT AC-3’;pUC4KR:5’-AAT CAG GTG CGA CAA TCT-3’。
1.4 感受态的制备
将R473菌种划线于BHI平板上,37°C培养24h,挑取单克隆接种到BHI液体培养基中活化培养。将37℃过夜培养的种子液按1%的接种量接种到50mL BHI培养基中,于37℃振荡培养(2h左右)至光密度D600nm为0.4~0.6,将菌液冰浴30min后,4℃离心(5000r/min×10min)收集菌体,用50mL预冷的10%无菌蔗糖清洗菌体2次,再用1mL预冷10%蔗糖10%甘油重悬并分装于1.5mLEP管中(50μL/每管),-80℃冻存备用。
1.5 不同电场强度下的电转化
将电转化仪的脉冲电压分别设定为1.0、1.3、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.5kV几个梯度,电脉冲维持时间为5ms,电脉冲次数为1。每次向50μL巴氏杆菌感受态细胞中加入3μg的质粒pBluescript-F1KanRF2(约100ng/μL),终浓度为37.5μg/mL,混匀后冰上放置10min,转入冰浴的1mm电转化杯中,进行电转化,电击后的细胞立即加入1mL预热的BHI培养液,37℃、200 r/min复苏2h,将细菌离心浓缩后涂布于BHI(50μg/mL Kan,5%血清)平板,37℃培养24~48h后,用讯数抑菌圈(抗生素效价)测量仪计算克隆数,并随机挑取单克隆进行PCR验证。
1.6 不同DNA浓度下的电转化
将电压设定为1.9kV,电脉冲时间5ms,脉冲次数1次,在50μL巴氏杆菌感受态细胞中分别加入0.5、1、2、3、4μg的质粒pBluescript-F1KanRF2,使质粒 DNA 的终浓度分别为9.1、16.7、28.6、37.5、44.4μg/mL,进行电转化。用BHI(50μg/mL Kan,5%血清)平板进行筛选,用讯数抑菌圈(抗生素效价)测量仪计算克隆数,并随机挑取单克隆进行PCR验证。
1.7 不同营养条件下的电转化
将电压设定为1.9kV,电脉冲时间5ms,脉冲次数1次,在50μL巴氏杆菌感受态细胞中加入3μg的质粒pBluescript-F1KanRF2,进行电转化。并分别用含有5%、2.5%、1%、0血清的 BHI(50μg/mL Kan)平板进行筛选,用讯数抑菌圈(抗生素效价)测量仪计算克隆数,并随机挑取单克隆进行PCR验证。
1.8 不同浓度抗生素筛选的电转化
将电压设定为1.9kV,电脉冲时间5ms,脉冲次数1次,在50μL巴氏杆菌感受态细胞中加入3μg的质粒pBluescript-F1KanRF2,进行电转化。并分别用含有50、20、10、5μg/mL Kan抗生素的BHI(5%血清)平板进行筛选,用讯数抑菌圈(抗生素效价)测量仪计算克隆数,并随机挑取单克隆进行PCR验证。
2 结果与分析
2.1 脉冲电压对电转化的影响
不同脉冲电压下的电转化结果见表1。由表1可知,在脉冲电压为1900V(19kV/cm)左右时,可以筛选到较多的发生了同源重组的转化子。
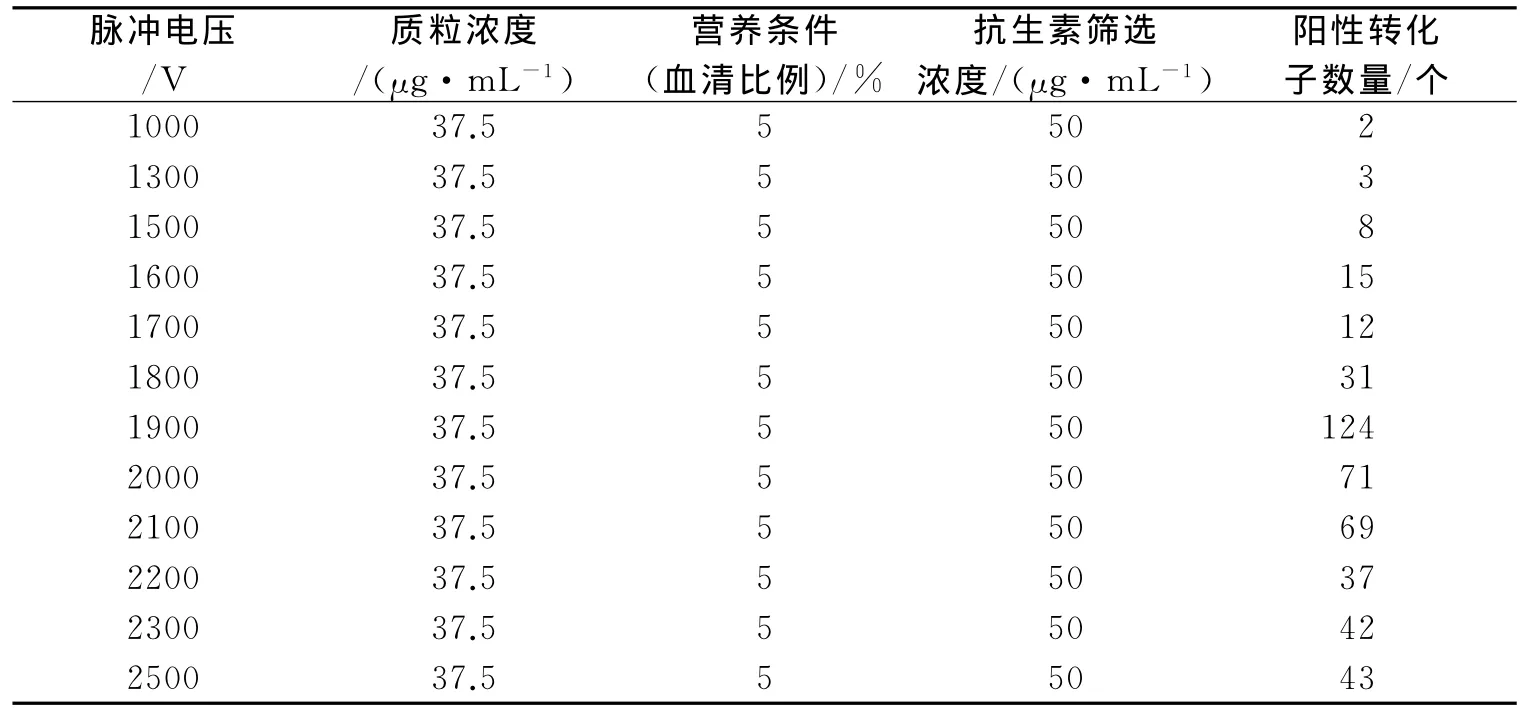
表1 不同电场强度电转化对筛选转化子数量的影响
2.2 质粒DNA浓度对电转化的影响
不同质粒DNA浓度下的电转化结果见表2。由表2可知,当感受态中质粒DNA的浓度在37.5μg/mL左右时,可获得最多的发生了同源重组的转化子。

表2 不同DNA浓度电转化对筛选转化子数量的影响
2.3 营养条件电转化筛选阳性克隆的影响
电转化后采用不同含量的血清培养对筛选转化子数量的影响实验结果见表3。由表3可知,电转化之后加入1%~5%血清进行培养均可以筛选到较多的发生了同源重组的转化子,与不加入任何血清相比,结果极显著。

表3 电转化后用不同营养条件培养对筛选转化子数量的影响
2.4 抗生素浓度对电转化筛选阳性克隆的影响
电转化后用不同浓度抗生素培养对筛选转化子数量的影响的结果见表4。由表4可知,随着抗生素浓度的下降,筛选到的转化子数量会逐渐增多,且效果明显。但是抗生素的浓度过低会增加假阳性的风险,而过高又可能会发生不定向的重组,因此终浓度为20~50μg/mL的硫酸卡那霉素对筛选结果是有利的。

表4 电转化后用不同浓度抗生素培养对筛选转化子数量的影响
2.5 同源重组转化子的鉴定
电转化后,在含有卡那霉素的BHI平板上有单菌落生长,而转化之前R473对卡那霉素敏感,因此这些转化子可能是发生了同源重组,随机挑取单克隆进行PCR鉴定。由图1结果可知,转化子用PMP1与PMP2扩增可以特异得到1300bp目的带;由图2可知,转化子用pUC4KF与pUC4KR扩增可以特异得到550bp目的带。与预期结果相符,转化子为阳性克隆。
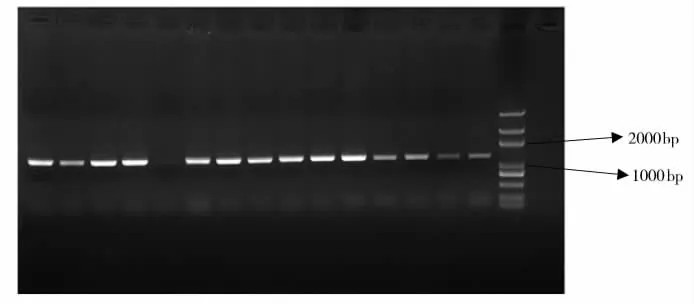
图1 转化子采用PMP1与PMP2引物扩增结果
3 讨论
克隆一段与受体细胞染色体高度类似的DNA序列,中间插入抗生素筛选标记,并高效地电转化至受体细胞中,通过单交换或双交换,筛选得到发生定向突变的突变株,是设计正向筛选的同源重组的一般策略。影响同源重组转化和筛选效率的因素比较复杂,概括起来主要有同源重组载体因素、电转化因素以及筛选因素等。
同源重组打靶载体一般具有1个或者2个筛选标记,并且这种筛选标记能够在受体细胞中发挥功能。构建的载体pBluescript-F1KanRF2具有2种筛选标记:CmR和KanR,且郭东春等[13]已证明这2种筛选标记可以用于多杀性巴氏杆菌的遗传操作体系中。在受体细胞中打靶质粒的非自主复制是同源重组载体的另外一个基本特性;但有研究报道,利用结合转导的方式筛选的转化子,即使在Pir蛋白不存在的情况,其质粒在下巴氏杆菌中也能自我复制,在无抗生素的选择下,传代80~100次,才获得发生同源重组的克隆[14,15],这无疑增加了筛选难度。pBluescript系列载体在多杀性巴氏杆菌中是不能够自我复制的,这在巴氏杆菌的aroA以及purF等基因敲除的研究中得到验证[13,16]。因此电击转化以pBluescript为骨架构建的同源重组载体,只要筛选具有KanR的转化子均已发生了同源重组交换。同源重组序列的长度显著地影响基因同源重组效率。Leloup等[17]的研究表明:同源片段长度在0.3~1.2kb范围内,同源重组的效率呈对数增长。pBluescript-F1KanRF2载体的同源臂在600~700bp之间,经电转化后可以得到较高的重组效率。
影响电转化效率的因素主要包括电场强度、DNA浓度、感受态的质量、电击次数等。其中电场强度是一个很重要的参数,应控制一个合适的电压,使电击细胞后能在细胞壁表面上出现核酸物质可以进入的孔洞,但是电压又不可过高,因为过高的电压会造成细菌大量死亡,同时,死亡的细菌会影响活菌体的生长[18]。一般情况下,细菌越小,将外援DNA导入其中所需要的电场强度越大。酵母约7.2μm×5.6μm,大肠杆菌大小(0.4~0.7)μm×(1~3)μm,而巴氏杆菌为卵圆形或球形的革兰氏阴性小杆菌,大小为(0.2~0.4)μm×(0.5~2.5)μm。巴氏杆菌比酵母、大肠杆菌形态更小,因此在进行电转化时,选择的电压要比对它们的高,这样才能得到所需的阳性转化子。熊萍萍等[19]在多杀性巴氏杆菌C48-16电转化条件的研究中发现,在12kV/cm的电场强度可以得到最大转化效率,而笔者在多杀性巴氏杆菌R473中发现19kV/cm是最合适的,这可能是因为多杀性巴氏杆菌R473比C48-16的荚膜层更厚一些。DNA浓度是另外一个重要的因素。同源重组是一个概率事件,因此理论上,转化时高DNA浓度可以增加同源重组几率,但是将pBluescript-F1KanRF2电转化至R473时发现,44.4μg/mL的DNA浓度筛选到的阳性克隆比37.5μg/mL的少,可能是因为较高的DNA浓度会使细菌更容易发生二次重组,从而产生更多的回复突变,使抗性消失。
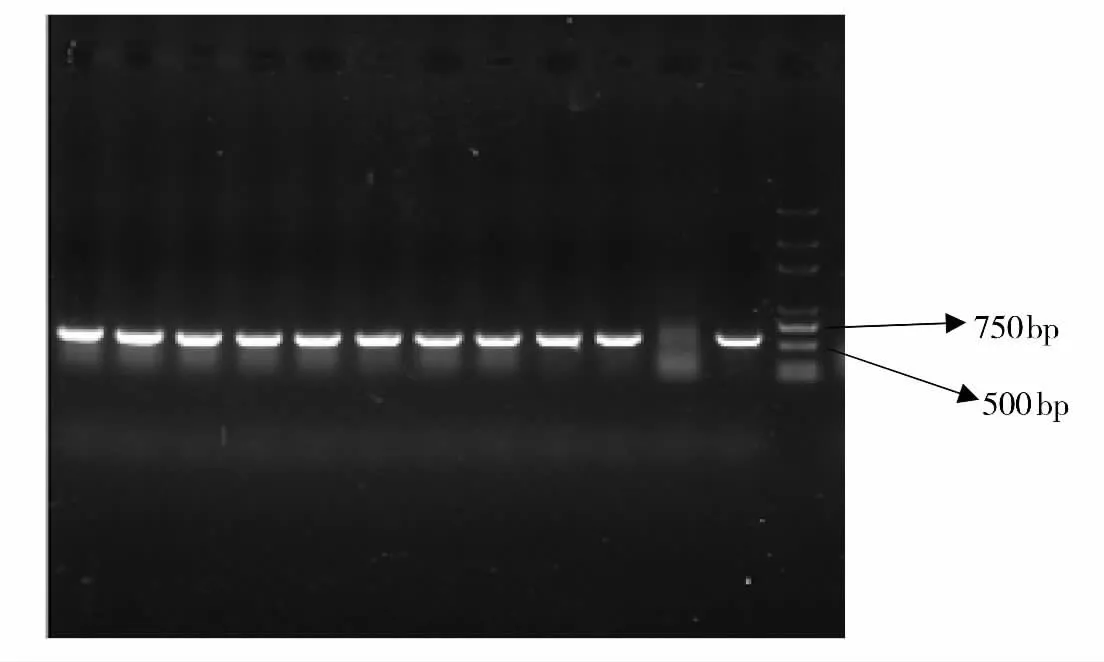
图2 转化子采用pUC4KF与pUC4KR引物扩增结果
本研究主要考察了电转化后的营养条件和抗生素浓度对筛选转化子数量的影响。电击转化是一个物理过程,整个过程对细菌损伤较大,有研究表明电击后剩余30%左右的细菌存活,此时的转化效率最高。血清中含有一些微量生长因子,它们对多杀性巴氏杆菌的增殖和损伤修复起着积极的作用。电转化后用1%~5%血清进行培养均可以筛选到较多的发生了同源重组的转化子,且5%血清的效果更好更经济,而不加入血清培养几乎不产生克隆,结果极显著。抗生素的筛选浓度是与标记基因的表达呈正相关的,即标记基因在多杀性巴氏杆菌R473中的启动子越强,拷贝数越高,可以用较高浓度的抗生素将这些转化子筛选出来。但是定向的基因敲除决定了筛选标记在R473只能有1个拷贝,这与构建酵母表达菌株期望获得高产是相反的。但较低浓度的抗生素会使结果出现更多的假阳性,而较高浓度的抗生素压力会使不定向重组的可能性增加。因此,在本研究中,笔者认为用20~50μg/mL的硫酸卡那霉素对筛选结果是有利的。
通过电转化的方法筛选发生同源重组的阳性转化子是一项基础工作,这为将来敲除多杀性巴氏杆菌的毒力基因,开发基因工程减毒株提供技术支持。
致谢:特别感谢中国农业科学院哈尔滨兽医研究所的郭东春老师惠赠pBluescript-Tn903质粒。
[1]Harper M,Boyce J D,Adler B.Pasteurellamultocidapathogenesis:125years afterPasteurella[J].FEMS Microbiol Lett,2006,265:1~10.
[2]Hill W A,Brown J P.Zoonoses of rabbits and rodents[J].Vet Clin North Am Exot Anim Pract,2011,14:519~531.
[3]陆承平.兽医微生物学 [M].北京:中国农业出版社,2001:123~124.
[4]罗青平,杨峻,温国元,等.禽巴氏杆菌病疫苗研究进展 [J].湖北畜牧兽医.2012,12(2):14~16.
[5]鼎震,刘崔广.禽霍乱鸡胚组织灭活油乳苗的研究 [J].中国畜禽传染病,1997,(4):27~28.
[6]吴彤,缪玲,刘金胜,等.禽霍乱荚膜多糖菌苗的研究-菌苗制造与品质测定 [J].中国兽医科技,1986,(5):3~6.
[7]Lee J,Kim Y B,Kwon M.Outer membrane protein H for protective immunity againstPasteurellamultocida[J].Journal of Microbiology,2007,45:179~184.
[8]卫涛,胡思顺,王延昭,等.禽多杀性巴氏杆菌脂蛋白E基因的原核表达及其对小鼠的免疫原性 [J].湖北农业科学,2011,50(4):854~857.
[9]Rimler R B.Purification of a Cross-protective antigen fromPasteurellamuhocidagrowninvitroandinvivo[J].Avian Diseases,2001,45:572~580.
[10]孙继强,张金平,熊永忠.禽霍乱(G190E40株)弱毒冻干活疫苗的保存期试验 [J].黑龙江畜牧兽医,2004,(1):59~60.
[11]左婉顺,宁振华.禽巴氏杆菌病B26-T1200弱毒疫苗株的选育 [J].中国畜禽传染病,1993,(5):19~20.
[12]黄巧珍,荣俊,匡红艳,等.鸡传染性法氏囊病与巴氏杆菌病二价活载体疫苗的免疫原性及免疫效力研究 [J].长江大学学报(自然科学版)农学卷,2013,(5):44~48.
[13]郭东春,卢艳,刘家森,等.多杀性巴氏杆菌aroA基因缺失突变株的构建及鉴定 [J].微生物学报,2012,52(4):526~531.
[14]Homchampa P,Strugnell R A,Adler B.Molecular analysis of thearoAgene ofPasteurellamultocidaand vaccine potential of a constructed aroA mutant[J].Mol Microbiol,1992,6:3585~3593.
[15]Fernández de Henestrosa A R,Badiola I,Saco M.Importance of the galE gene on the virulence ofPasteurellamultocida[J].FEMS Microbiol Lett,1997,154:311~316.
[16]张爱芹.兔多杀性巴氏杆菌purF缺失突变株的构建及生物学特性的研究 [D].大庆:黑龙江八一农垦大学,2013.
[17]Leloup L,Ehrlich S D,Zagorec M,etal.Single-crossover integration in the Lactobacillus sake chromosome and insertional inactivation of theptsI andlacL genes[J].Applied and Environmental Microbiology,1997,63:2117~2123.
[18]韦晓明,赵晶,苏明权.电转化条件对大肠杆菌XLI-Blue菌株转化效率的影响 [J].生物技术通讯,2003,11(6),566~568.
[19]熊萍萍,荣俊.多杀性巴氏杆菌C48-16电转化条件的研究 [J].长江大学学报(自然科学版)农学卷,2007,4(4):62~64.
