PLEKHQ1基因敲除小鼠基因型鉴定方法*
2015-12-03张鹏飞周晨辰
张鹏飞 张 硌* 陆 琤 周晨辰
PLEKHQ1基因敲除小鼠基因型鉴定方法*
张鹏飞①张 硌①*陆 琤①周晨辰①
目的:探讨鉴定PLEKHQ1基因敲除(KO)小鼠基因型的方法。方法:对PLEKHQ1基因敲除杂合子小鼠进行单独饲养及配种繁殖,繁殖后其子代出现野生型、杂合子型及纯合子型3种基因型,提取每只小鼠的基因组DNA,采用聚合酶链反应(PCR)和变性方法进行基因类型鉴定。结果:采用PCR和变性法成功鉴定出PLEKHQ1基因敲除小鼠的基因型。结论:这种无需T7酶切的小鼠基因型鉴定方法可用于PLEKHQ1基因敲除小鼠的基因型鉴定。
基因敲除小鼠;PLEKHQ1;变性;纯合子;杂合子
DOI∶ 10.3969/J.ISSN.1672-8270.2015.08.001
[First-author’s address] Department of Medical Engineering, 307 Hospital of PLA, Beijing 100071, China.
PLEKHQ1全称为pleckstrin homology domain containing family Q member 1缩写为Q1,属于含有PH结构域的蛋白超家族,目前为止尚未见任何文献专门对其功能进行报道。生物信息学分析显示,Q1可能参与细胞因子与受体的相互作用,并且可能在巨噬细胞功能调控,尤其是巨噬细胞介导的炎性反应过程中发挥作用。为了揭示Q1在巨噬细胞介导的炎性反应中的作用,除了利用已经构建的Q1稳定敲低的RAW264.7细胞株等进行实验外,实验室于2014年成功建立了Q1基因敲除杂合小鼠。基于此,本研究采用PCR和变性法成功鉴定出由Q1基因敲除杂合小鼠繁殖获得的子代小鼠的基因型。
1 材料与方法
1.1 实验动物
Q1基因敲除杂合(Q1+/-)小鼠由赛业(广州)生物科技有限公司建立,利用类转录激活因子效应物核酸酶(transcription activator-like effector nucleases,TALEN)技术获得,品系为C57BL/6,SPF级,共3只(雄性),生产许可证号:SCXK(粤)2013-0032;合格证号:444104000000214。野生型(wide type,WT) C57BL/6小鼠由军事医学科学院提供,无特定病原体(specific pathogen free,SPF)级条件饲养。
1.2 试剂与仪器
1.2.1 试剂
试剂包括:①鼠尾裂解液(SA),NaOH(5 mol/ L)50 μl,EDTA(0.5 mol/L,pH值为8.0)50 μl,置入超纯水中至10 ml;②刺激缓冲液(SB),Tris-HCl(1 mol/L,pH值为8.0)400 μl,置入超纯水中至10 ml;③KOD-Plus-Neo(1.0 U/μl)(配套试剂有10×聚合酶链反应(polymerase chain reaction,PCR Buffer for KOD-Plus-Neo、2 mmol/L dNTP、2 mmol/L MgSO);④琼脂糖(美国Amresco公司);⑤10×TBE缓冲液(Tris 10.8,20 mmol/L EDTA,硼酸5.5 g,加水至100 ml,调整pH值为8.3)。
1.2.2 仪器
实验仪器包括:①GL-1800型干式恒温器(海门其林贝尔仪器制造有限公司);②Thermo LABOFUGE 400R低温离心机(美国Thermofisher公司);③C1000 TouchTMPCR仪(上海伯乐生命医学产品有限公司);④DYY-6D型电泳仪(北京市六一仪器厂);⑤WD-9413B凝胶成像分析仪(北京市六一仪器厂)。
1.3 基因敲除小鼠的饲养和繁殖
建立Q1基因敲除杂合子小鼠后,置于军事医学科学院实验动物中心SPF级动物房内饲养和繁殖。室内饲养温度为18~22 ℃,相对湿度为40%~70%,明暗循环为12 h/d,小鼠自由饮水和饮食。小鼠笼盒、木屑垫料、饲料及饮用水均经过高温、高压消毒灭菌处理。在饲养过程中,每周一和周四进入SPF动物房观察和记录小鼠的生长情况,每周更换2次小鼠垫料,每日补充饲料和饮用水。繁殖初期将1只雄性杂合鼠与2只雌性野生鼠进行合笼饲养,小鼠的性成熟期约为8周,雌性鼠妊娠期约为21 d,繁殖出F2代子鼠后将1只雄性杂合鼠与2只雌性杂合鼠进行合笼饲养,繁殖出F3代子鼠[1]。
1.4 小鼠的基因型鉴定
由于F2代Q1基因敲除小鼠均为杂合子,其子代小鼠可能出现野生型(Q1+/+,WT)、杂合子(Q1+/-,HET)和纯合子(Q1-/-,KO)3种表型,故需对其子代小鼠进行基因类型鉴定。其中,通过基因型测序(北京天-辉远生物科技有限公司)确定了部分F3代子鼠的基因型,并确定获得了野生型、纯合子和杂合子,为后续实验奠定基础。
1.4.1 小鼠基因组DNA提取
剪取小鼠尾尖0.5 cm放入1.5 ml的离心管(EP管)中,加入100 μl的SA裂解液,覆盖小鼠尾部,95 ℃处理30 min,然后加入100 μl的SB裂解液,摇荡,直至组织消失,以3000 r/min离心5 min,提取其小鼠DNA。
1.4.2 PCR扩增反应及琼脂糖凝胶电泳
引物由赛业(广州)生物科技有限公司设计,并由北京天-辉远生物科技有限公司合成,Q1基因引物分别是Primer F:GCTTCATGGCAACAGCCCTCA;Primer R:GAGCCTTCCAGCCACAGTCTTAGG。PCR扩增反应体系根据KOD-Plus-Neo使用说明,按20 μl反应体系进行扩增。分别加入反应物:DNA模板5 μl、F引物(10 μmol/L)1 μl、R引物(10 μmol/L)1 μl、KOD-Plus-Neo(1.0 U/μl)0.4 μl、10×PCR Buffer for KOD-Plus-Neo 2 μl、2 mmol/ L dNTP 2 μl和2 mmol/L MgSO42 μL,加ddH2O补足至20 μl。PCR反应循环设置为:①94 ℃预变性3 min;②98 ℃变性10 s、59 ℃退火30 s及68 ℃延伸30 s/ kb min,循环35次;③72 ℃ 5 min后终止反应。取PCR产物10 μl,加入6×Gel Loading后混匀,进行2%琼脂糖凝胶电泳,并用凝胶成像分析仪进行分析。
1.4.3 变性反应及琼脂糖凝胶电泳的基因类型鉴定
本研究设计了一种无需T7酶切的TALEN技术基因敲除小鼠基因型鉴定的方法,其原理是利用含发夹结构域的双链DNA较纯线性双链DNA具有较小的电泳迁移率的特点,对含发夹结构的双链DNA可以通过T7酶切的方法进行基因型判断,从而区分出野生型和纯合子[2]。
(1)利用测序已确定的小鼠基因型设计实验:①DNA模板中有2组为对照组,即已知WT(5 μl)和KO(5 μl)混匀后的样品(10 μl)以及杂合子(10 μl);②其余为实验组,即已知野生型小鼠WT(10 μl)、纯合型小鼠KO(10 μl)以及WT和KO的PCR扩增产物各5 μl,将其混匀于95 ℃变性5 min,其产物在室温下自然冷却。将上述各样品进行2%琼脂糖凝胶电泳,并利用凝胶成像分析仪进行分析,其分析结果如图1所示。

图1 各基因型PCR产物变性前后电泳图
图1 显示,WT与WT、KO与KO混合变性后的产物均为1条带,并且WT和KO混匀变性后的产物与非变性的产物不同,但是与杂合子的基因型相同,为2条带,表明可以利用WT与KO变性的方法对非杂合的PCR产物进行分析,从而判断出野生型和纯合子型。
(2)无需T7酶切的Q1-KO小鼠基因型鉴定方法具体流程如图2所示。
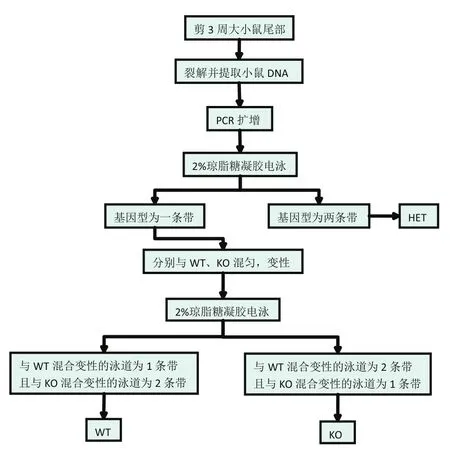
图2 变性法Q1-KO小鼠基因型鉴定方法流程图
2 结果
根据流程图,按照变性方法进行基因型鉴定。小鼠为6号笼中3周大小的小鼠,剪其尾部,分别编号为1~11号,裂解并提取DNA,进行PCR扩增及琼脂糖凝胶电泳,利用凝胶成像分析仪得到图像,结果显示,除2号、4号、8号和10号为1条带外,其余均为2条带,即为杂合子(如图3所示)。

图3 PCR产物变性前电泳图
将2号、4号、8号和10号分别与已知的WT和KO混合、变性之后进行琼脂糖凝胶电泳,利用凝胶成像分析仪得到图像,其结果显示,2号和4号与WT混合变性后为2条带,而与KO混合变性后为1条带,因此为纯合子;8号和10号与WT混合变性后为1条带,而与KO混合变性后为2条带,因此为野生型小鼠(如图4所示)。
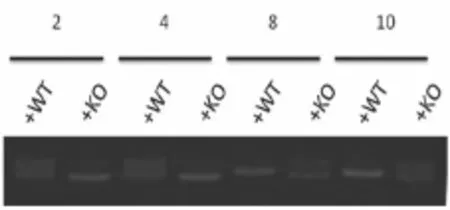
图4 PCR产物变性后电泳图
3 讨论
TALEN技术[3]是一种崭新的分子生物学技术手段,克服了以往基因修饰技术中锌指蛋白(zinc finger protein,ZFP)等不能靶向所有序列、脱靶切割及设计繁复等诸多缺点,能够特异性地实现对任意靶目标DNA的敲除、敲入或点突变[4-5]。其原理是利用TALE和ForkⅠ限制性核酸内切酶的催化区域融合为TALEN,保留TALE的DNA靶序列特异识别功能及ForkⅠ的DNA酶活性[6-7]。目前,该技术已成功地在斑马鱼、线虫、大鼠、小鼠及果蝇等物种的细胞实现了基因组定点突变[8-11]。引进的Q1基因敲除小鼠是通过TALEN技术剪切目标基因外显子DNA,使DNA发生修复后形成移码突变,从而使控制Q1蛋白表达的基因失活,达到实现Q1基因敲除的目的。Q1基因敲除动物模型的构建目前在国内、外均未见报道。
本研究引进的基因敲除小鼠严格遵循SPF级动物标准管理,饲养和繁殖方法均参照文献[12]进行。由于本研究建立的Q1基因敲除小鼠均为杂合子,因此其子代有可能出现WT、KO及HET的3种表型,采用PCR扩增小鼠基因组DNA、再用T7酶切的变性方法成功进行了基因型鉴定。在实验过程中,为不影响小鼠正常生长、保证存活率,选择出生3周左右即离乳后小鼠,剪取尾部组织进行基因鉴定。为了确保鉴定结果的准确性,先通过每个样本琼脂糖凝胶电泳区分开2条带的杂合子,然后将1条带的样品分别与已知确定的WT、KO混合,然后通过凝胶成像分析仪判断琼脂糖凝胶上每组分别对应带的数量,继而判断基因型。由于利用CRISPR/CAS9技术建立的基因敲除小鼠与TALEN技术建立基因敲除小鼠均为短基因片段缺失类型,因此,本实验方法同样适用于CRISPR/ CAS9技术建立的基因敲除小鼠的基因型鉴定[13-15]。
[1]孙青原,陈大元,译,小鼠胚胎操作实验手册[M].3版.北京:化学工业出版社,2005:123-125.
[2]冯世杰,宗英,张子腾,等.NLRP3基因敲除小鼠的繁殖与基因型鉴定[J].第二军医大学学报,2014,35(5):555-559.
[3]Boch J,Scholze H,Schornack S,et al.Breaking the code of DNA binding specificity of TAL-type Ⅲ effectos[J].Science,2009,326(5959):1509-1512.
[4]Li T,Huang S,Jiang WZ,et al.TAL nucleases(TALNs):hybrid proteins composed of TAL effectors and FokⅠDNA-cleavage domain[J]. Nucleic Acids Res,2011,39(1):359-372.
[5]Kim Y,Kweon J,Kim A,et al.A library of TAL effector nucleases spanning the human genome[J]. Nat Biotechnol,2013,31(3):251-258.
[6]Moscou MJ,Bogdanove AJ.A simple cipher governs DNA recognition by TAL effectors[J]. Science,2009,326(5959):1501-1503.
[7]Gingras AC,Raught B,Sonenberg N.elF4 initiation factors:effectors of mRNA recruitment to ribosomes and regulators of translation[J]. Annu Rev Biochem,1999,68:913-963.
[8]沈延,肖安,黄鹏,等.类转录激活因子效应物核酸酶(TALEN)介导的基因组定点修饰技术[J].遗传,2013(35):395-409.
[9]Hemhndez G,Han H,Lasko P,et a1.Eukaryotic initiation factor 4E-3 is essential for meiotic chromosome segregation,cytokinesis and male fertility in Drosophila[J].Development,2012,139(17):3211-3220.
[10]Culjkovic B,Topisirovic I,Borden KL,et a1. elF4E promotes nuclear export of cyclin D1 mRNAs via an element in the 3'UTR[J].J Cell Biol,2005,169(2):245-256.
[11]Hinnebusch AG.Translational Homeostasis via elF4E and 4E-BP1[J].Mol Cell,2012,46(6):717-719.
[12]施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:71-82.
[13]Volpon L,Osbome MJ,Borden KL,et a1.elF4E3,a new actor in mRNA metabolism and tumor suppression[J].Cell Cycle,2013,12(8):1159-1160.
[14]Yoshizawa A,Fukuoka J,Travis WD,et a1.elF4E activation is commonly elevated in advanced human prostate cancers and significantly related to reduced patient survival[J].Cancer Res,2009,69(9):3866-3873.
[15]Dali Li,Zhongwei Qiu,Yanjiao Shao,et al. Heritable gene targeting in the mouse and rat using a CRISPR-Cas system[J].Nature Biotechnology,2013,31(8):681-683.
The method of the identification of the PLEKHQ1 gene knockout mice
ZHANG Peng-fei, ZHANG Ge, LU Cheng, et al
China Medical Equipment,2015,12(8)∶1-3.
Objective∶ To identify PLEKHQ1 gene knock-out mice. Methods∶ The PLEKHQ1 gene knock-out heterozygote mice were bred alone and copulated. The offsprings were to have three genotypes: wild genotype, heterozygote genotype and homozygote genotype. Genomic DNA was obtained from each pups and were subjected to PCR and Denature to identify the genotype. Results∶ The identification of PLEKHQ1 gene knockout mice is successful. Conclusion∶ The identification method of PLEKHQ1-KO mice without T7 can correct identify PLEKHQ1 gene knockout mice.
Knockout mice; PLEKHQ1; Denature; Homozygote; Heterozygote
1672-8270(2015)08-0001-03
R-332
A
张鹏飞,女,(1984- ),硕士,助理工程师。解放军第307医院医学工程科,从事细胞信号转导研究工作。
2015-03-24
国家自然科学基金(31400739)“PH结构域蛋白PLEKHQ1协调巨噬细胞迁移与激活的机制研究”;北京市自然科学基金(5144033)“PH结构域蛋白PLEKHQ1调控巨噬细胞激活及迁移的机制研究”
①解放军第307医院医学工程科 北京 100071
*通讯作者:marbleluo@126.com
