高效液相色谱法测定布洛芬脂肪乳剂中药物含量
2015-12-02刘振波
刘振波
布洛芬为芳基烷酸类非选择性非甾体抗炎药,布洛芬难溶于水,易溶于乙醇、乙腈、丙酮等有机溶剂。布洛芬能通过抑制环氧化物酶(COX-2),抑制前列腺素的合成与释放,具有解热,镇痛,抗炎作用[1-3]。 目前临床现有制剂多为口服制剂,但是布洛芬及其他非选择性非甾体抗炎药口服常常会引起严重的胃肠道炎症、出血溃疡等胃肠道反应[4]。同时对一些不方便口服给药的患者,如手术患者和儿童而言注射剂型也是不可或缺的。2009年6月坎伯兰公司(Cumberland)研制的布洛芬注射液在美国获FDA批准上市,这是首个由美国FDA批准的布洛芬注射药物。布洛芬注射液目前在临床上主要用于治疗术后疼痛,可减少吗啡等阿片类镇痛药的使用量[5]。该布洛芬注射液由摩尔比为0.92∶1的精氨酸和布洛芬以及适量的pH调节剂氢氧化钠组成,临床上使用的规格为4 ml/400 mg或8 ml/800 mg。临床使用时使用生理盐水或5%的葡萄糖注射液稀释至药物浓度不高于4 mg/ml[6]。但是该布洛芬注射液使用精氨酸作为增溶剂,临床用药时使用生理盐水及葡萄糖注射液稀释后布洛芬容易析出,且该布洛芬注射液体内代谢迅速,血浆药物清除速度快,药物半衰期短,需要大量给药,为此研制新型布洛芬注射制剂十分必要。脂肪乳剂具有明显的淋巴系统和单核-巨噬细胞系统(MPS)靶向性[7],对炎症治疗具有被动靶向性。同时脂肪乳剂具有安全性好,生产工艺简单,完全能够工业化生产的特点,为此本研究制备了布洛芬脂肪乳剂(简称为IBU-LE),本文主要对自制IBU-LE中的药物含量的高效液相测定方法进行研究。
1 仪器与材料
Agilent1100型高效液相色谱仪 (美国Agilent公司);BS124S型电子分析天平(德国Sartorius公司);布洛芬标准品(中国药品生物制品检定所,纯度≥99.9%);布洛芬原料药(山东新华制药有限公司);IBU-LE (自制,2 mg/ml, 批号20130725、201130726、20130727);甲醇,乙腈(德国默克公司,色谱纯);其他所用试剂均为分析纯。
2 方法与结果
2.1 溶液的制备
2.1.1 空白溶液 精密量取1 ml自制10%空白脂肪乳剂置于10 ml量瓶中,异丙醇溶解并定容至刻度,得到乳剂空白溶液。
2.1.2 对照品溶液 精密称取15 mg的布洛芬对照品,置于25 ml量瓶中,异丙醇溶解并定容至刻度,得 600 μg/ml的对照品储备液。
2.1.3 供试品溶液 精密量取1 ml自制IBU-LE, 置于10 ml量瓶中,异丙醇溶解并定容至刻度,得IBU-LE供试品溶液。
2.2 色谱条件 色谱柱:Ultimate XB-C18柱(250mm×4.6 mm,5 μm);流动相:乙腈-水(含 0.1%磷酸;70∶30,V/V);流速:1.0 ml/mim;检测波长:220 nm;柱温:30 ℃;进样量:20 μl。 分别取空白溶液,对照品溶液,供试品溶液适量进样,考察乳剂中其他成分是否干扰布洛芬的含量测定。色谱图见图1,布洛芬的保留时间约为7.0 min,其他成分不干扰布洛芬的测定。

图1 布洛芬高效液相色谱图
2.3 标准曲线和线性范围 精密量取对照品储备液适量,用异丙醇稀释成浓度为 35、70、140、280、560 μg/ml的布洛芬系列标准溶液,取20 μl标准溶液注入液相色谱仪进行分析,以标准溶液的峰面积(Y)对相应的标准溶液浓度(X)进行线性回归, 其回归方程为 Y=44.675X-112.5,r=0.9998,线性范围为 35~560 μg/ml。
2.4 精密度 分别取低、中、高(35、140、560 μg/ml)3 个浓度的对照品溶液进行精密度考察,按上述色谱条件于1 d之内连续进样5次,根据标准曲线计算其浓度,其日内RSD值分别为 1.75%,1.29%,0.75%。按上述色谱条件取上述 3 个浓度的供试品溶液连续5 d分别进样,记录峰面积,由标准曲线得布洛芬浓度,其日间 RSD值分别为 1.89%,1.31%,0.77%。表明该方法日内和日间精密度良好。
2.5 重复性考察 取同一批次的供试品溶液6份,20 μl进样,测定供试品中布洛芬含量,计算其RSD值。RSD值为1.04%。表明测定方法的重复性良好。
2.6 稳定性考察 取同一批制备的供试品溶液,分别于0、2、4、6、8、12、24 h 进样 20 μl,测定峰面积,计算布洛芬含量及RSD值。RSD值为1.42%。表明供试品在24 h内稳定。
2.7 加样回收率 精密量取已知浓度的供试品溶液9份,分为3组,分别精密加入低、中、高3个浓度的对照品溶液,测定各组药物含量。计算加样回收率和RSD值。结果如表1所示,回收率均在95%~105%范围内,RSD值均<5%,符合要求。
2.8 布洛芬脂肪乳含量测定 取上述3个批号的自制IBULE按含量测定方法进行测定,含量测定结果如表2所示。
3 讨 论
在载药脂肪乳剂药物含量测定中由于药物包裹在油相中,如何破乳使药物释放出来是测定载药脂肪乳剂药物含量必须解决的问题。实验发现使用常用的有机溶剂如甲醇、乙醇、乙腈等都不能很好地破乳,而在使用异丙醇、四氢呋喃等破乳效果良好,本实验采用异丙醇破乳制备供试品溶液。
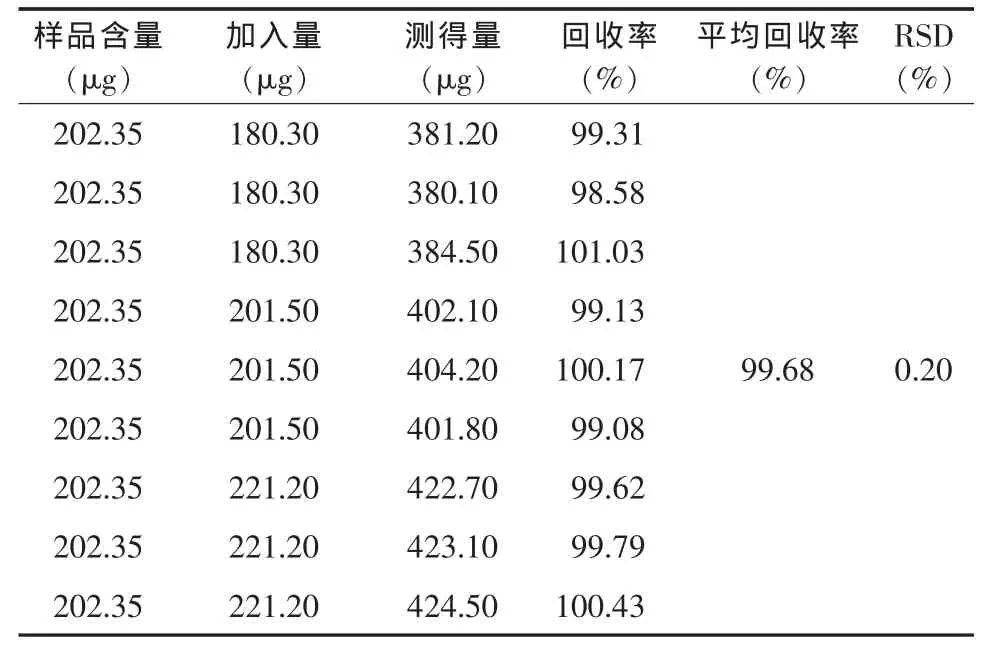
表1 IBU-LE供试品溶液加样回收率

表2 IBU-LE含量测定结果
在布洛芬的高效液相测定条件的选择上,由于布洛芬紫外吸收不强,本研究没有选择2010版中国药典中布洛芬高效液相测定所选择的波长258 nm,在参考相关文献及美国药典的实验方法后选择布洛芬紫外吸收相对较强的220 nm作为测定波长[8]。对于流动相的选择本研究参考美国药典并适当调整选择含 0.1%磷酸的乙腈-水溶液(70∶30,V/V)作为流动相,所测得保留时间,分离度,拖尾因子等符合高效液相测定要求。
[1] Antonio Ortega-álvaro,Esther Berrocoso,et al.Comparison of the antinociceptive effects of ibuprofen arginate and ibuprofen in rat models of inflammatory and neuropathic pain [J].Life Sciences,2012,90(1):13-20.
[2] Wenwen Chen,Xiaohui Hu,Yanzhun Hong,et al.Ibuprofen nanoparticles prepared by a PGSSTM-based method[J].Powder Technology,2013,245(2):241-250.
[3]王润玲,刘印忠,高建华,等.布洛芬精氨酸盐解热镇痛及抗炎作用的研究[J].中国药师,1999,2(1):8-10.
[4]路长飞,田月洁,谢彦军,等.布洛芬口服制剂致不良反应/事件监测数据分析[J].药学研究,2013,32(10):618-620.
[5]彭东明,王福东,卢茂芳,等.HPLC测定精氨酸布洛芬注射液的含量及有关物质[J].华西药学杂志,2013,28(2):195-196.
[6]吴畅烜,吴 军,施存元.布洛芬注射液与临床常用输液配伍稳定性考察[J].中国医院药学杂志,2013,33(14):1201-1202.
[7]何 军,张 兵,陈艳华.脂质乳剂释药机制及其靶向性的研究进展[J].中国医药工业杂志,2008,39(1):56-60.
[8]郝玲花,戚 燕,杨庆云,等.HPLC法和旋光光度法测定布洛芬注射液中精氨酸含量的方法比较[J].沈阳药科大学学报,2013,30(6):442-443.
